灵芝多糖抑制NADPH氧化酶表达防治大鼠动脉粥样硬化
吴 锋,孟国梁,常珊珊,徐济良
(南通大学医学院药理学教研室,江苏南通 226001)
灵芝多糖(Ganoderma lucidum Polysaccharide,GLP)为多孔菌科真菌灵芝[Ganoderma lucidum(Leys.Ex Fr.)Karst]中提取出的以 β(1→3)糖苷键为主链的杂多糖[1]。笔者证实GLP可有效通过调节脂质代谢紊乱减缓大鼠动脉粥样硬化(AS)病程[2],杨丽娟等[3]发现灵芝多糖肽对人脐静脉内皮有抗氧化损伤作用,而氧化应激在AS发生发展过程中为主因之一[4];所以本实验以AS大鼠为实验模型,观察GLP能否通过干预AS氧化应激过程起到治疗作用,并探讨其作用机制,为临床应用提供理论基础。
1 材料与方法
1.1药品与试剂GLP(江苏安惠生物科技有限公司,含量82%),胆固醇(上海蓝季科技发展有限公司),胆酸钠(上海蓝季科技发展有限公司),丙基硫氧嘧啶(上海复星朝晖药业有限公司),维生素D3(上海通用药业股份有限公司),丙二醛(MDA)、超氧化物歧化酶(SOD)测试盒(南京建成生物工程公司),活体组织氧化应激活性氧(ROS)初级荧光测定试剂盒(genmed),兔抗大鼠Nox4多克隆抗体(北京博奥森生物技术有限公司),兔抗大鼠p22phox多克隆抗体(武汉博士德生物工程有限公司)。
1.2模型制作健康♂SD大鼠40只,体质量180~200 g,南通大学实验动物中心提供。随机分为5组:正常对照组(CON)、AS模型组(AS)、GLP低、中、高剂量预防组(GLPL、GLPM、GLPH)。除正常组外其余4组以40 mg·kg-1剂量一次性腹腔注射维生素D3,喂高脂饲料(81.3%基础饲料、10%猪油、3%胆固醇、0.5%胆酸钠、5%白糖、0.2%丙基硫氧嘧啶)。造模同时,GLP低、中、高剂量组每日分别以 GLP 125、250、500 mg·kg-1灌胃,正常组和模型对照组给予等量生理盐水灌胃。
1.3方法
1.3.1血清MDA、SOD检测实验12周后大鼠禁食12 h,20%乌拉糖腹腔麻醉,颈动脉插管取血,2 000 r·min-1分离血清,使用测试盒分别测定血清MDA、SOD含量。
1.3.2主动脉HE染色取大动脉(从主动脉弓至腹主动脉分叉处),以生理盐水冲洗残血,用4%多聚甲醛溶液固定,逐级乙醇脱水,石蜡包埋切片,HE染色观察主动脉内膜情况。
1.3.3主动脉ROS测定手术取出血管,用刀片切碎组织,使用genmed活体组织氧化应激活性氧(ROS)初级荧光测定试剂盒,在激发波长490 nm,散发波长520 nm下使用荧光酶标仪检测。
1.3.4免疫印迹Nox4、p22phox蛋白表达从主动脉弓至腹主动脉分叉处取主动脉,加入含有蛋白酶抑制剂的组织裂解液冰上提取蛋白,BCA法蛋白定量。8%的SDS-PAGE凝胶电泳分离蛋白,电流100 V;300 mA转膜150 min;含5%脱脂奶粉TBST室温封闭1 h;分别加Nox4和p22phox一抗4℃过夜;d 2加相应的二抗室温反应1 h,扫膜并使用imageJ进行灰度分析。
1.4统计学处理利用SPSS11.5统计软件分析处理数据,计量资料用±s表示,组间采用单因素方差分析,两两比较采用SNK检验。
2 结果
2.1大鼠血清MDA、SOD变化与CON组比较,AS组 MDA、SOD明显升高(P<0.01),给药组MDA、SOD较AS组均明显下降(P<0.01),Tab 1。
Tab 1 Comparison of MDA,SOD levels of serum in rats of each group after 12 weeks’administration(±s,n=8)

Tab 1 Comparison of MDA,SOD levels of serum in rats of each group after 12 weeks’administration(±s,n=8)
*P <0.05,**P <0.01 vs CON;##P <0.01 vs AS
Group MDA/μmol·L-1 SOD/NU·ml -1 CON 6.2 ±1.0## 160.23 ±32.58##AS 10.3 ±2.1* 206.01 ±39.34**GLPL 8.7 ±0.9*## 178.04 ±15.23*##GLPM 7.1 ±1.2*## 170.85 ±23.07*##GLPH 7.3 ±1.6*## 174.57 ±33.78*##
2.2大鼠动脉粥样斑块改变如Fig 1所示,正常对照组大鼠胸、腹主动脉壁结构完整,层次清晰,内膜连续而光滑,中层平滑肌层均匀无萎缩;动脉粥样硬化模型组血管壁内皮脱落,内膜增厚,内皮下间隙增宽,内弹力板断裂,斑块内含有大量泡沫细胞、平滑肌细胞、巨噬细胞,纤维组织增生伴片状钙化,中膜平滑肌明显萎缩;GLP预防组内皮细胞部分脱落,结构较完整,有少量脂质沉积,少见内弹力板断裂。
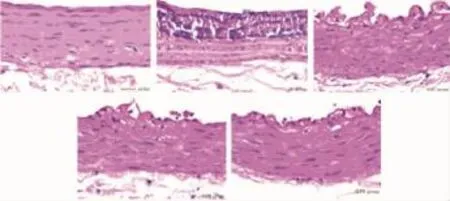
Fig 1 HE staining of aorta(×400)
2.3主动脉ROS含量变化如Fig 2所示,AS组大鼠主动脉ROS含量明显增高;与AS组比较,GLP各给药组主动脉ROS含量均明显下降(P<0.01)。
2.4主动脉Nox4、p22phox表达变化如Fig 3免疫印迹结果显示,AS组Nox4、p22phox蛋白表达量均较CON组增高(P<0.01),GLP干预后目的蛋白表达量明显下降(P<0.01)。
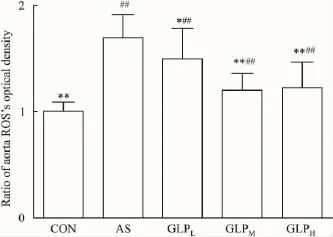
Fig 2 Ratio of aorta ROS’s optical density(±s,n=8)
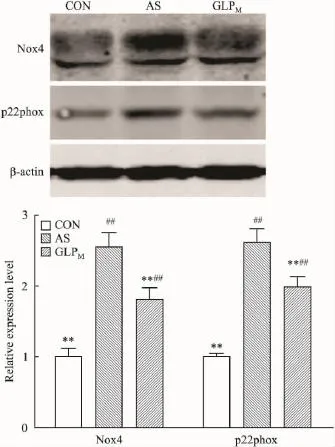
Fig 3 Westen blot of vascular Nox4 and p22phox in rats of each group(±s,n=3)
3 讨论
食饵性实验AS动物模型通常用于模拟AS早期病变,病变首先呈现于主动脉[5],实验大鼠12周后形态学检测大鼠主动脉显示AS模型成立。血清中氧化应激指标MDA水平AS组较CON组明显增高,MDA是ROS攻击细胞膜多不饱和脂肪酸形成的脂质过氧化物,间接反映ROS的生成量和对组织损伤的程度[6];结合主动脉ROS试剂盒检测,均提示AS状态下机体可能存在抗氧化防御机制的下降和体内ROS生成的增多。灵芝多糖药理学研究证实具有多种生物活性和药理作用,除了主要的免疫调节和抗肿瘤作用外,Zhao等[7]报道GLP可以通过抑制氧化应激减少大鼠皮层原代神经元缺氧/复氧损伤,杨丽娟等[3]也发现灵芝多糖肽对人脐静脉内皮有抗氧化损伤作用,我们证实GLP具备减缓大鼠氧化应激反应阻遏主动脉粥样硬化病程进展的作用。
目前认为SOD是体内有效清除ROS的天然抗氧化酶[8],实验发现AS模型组SOD血清含量较正常组明显上调,可解释为病程中ROS增多后抗氧化酶的合成分泌在一定时程内代偿性增加,但实验中提示这一代偿机制不足以消除体内积聚的过多ROS。GLP能够有效降低主动脉ROS水平和血清MDA值,说明GLP可能是通过减少ROS的生成途径阻遏动脉粥样硬化病程。
NADPH氧化酶目前被认为是血管内生成ROS的主要酶体,NADPH氧化酶参与了AS的发生和发展全过程[9]。NADPH氧化酶,包含胞膜成分细胞色素b558(gp91phox和p22phox)和胞质成分p47phox、p67phox及小的 GTP结合蛋白 rac等5个亚组分[10],其中p22phox在各种细胞中都高表达。近年来至少发现了两种新的gp91phox同工酶家族即Nox和 DUOX,Nox家族有 Nox1、Nox2(gp91phox)、Nox3、Nox4、Nox5等成员;在血管细胞中,内皮细胞和平滑肌细胞主要表达 Nox1和 Nox4。Sorescu等[11]发现在动脉粥样硬化患者体内,冠脉斑块肩部存在大量过氧化物沉积,同时增高的 p22phox和 Nox2(gp91phox)结合后主要位于斑块中的巨噬细胞,Nox4定位于血管平滑肌和内皮细胞。血管生理学认为,Nox家族是血管ROS的主要来源,并且血管平滑肌的NADPH氧化酶活性主要依赖于Nox4的表达[12-13]。血管平滑肌的分化表型在动脉粥样硬化病理过程中起关键作用,Clempus等[14]Nox家族中只有Nox4在血管平滑机分化过程中起决定作用。我们实验发现GLP药物干预能够有效下调主动脉p22phox和Nox4蛋白表达,这可能是GLP能够下调AS大鼠主动脉ROS水平,起到防治动脉粥样硬化作用的主要原因,但详细机制有待进一步研究。
[1]Huang S Q,Li J W,Li Y Q,Wang Z.Purification and structural characterization of a new water-soluble neutral polysaccharide GLPF1-1 from Ganoderma lucidum[J].Int J Biol Macromol,2011,48(1):165-9.
[2]吴 锋,孟国梁,杨丽云,等.灵芝多糖预防大鼠动脉粥样硬化的实验研究[J].南通大学学报(医学版),2008,341(10):709-17.
[2]Wu F,Meng G L,Yang L Y,et al.Preventive effect of Ganoderma lucidum polysaccharides on formation of atherosclerosis in experimental rats[J].J Nantong Univ(Med Sci),2008,341(10):709-17.
[3]杨丽娟,游育红,林志彬,等.灵芝多糖肽对人脐静脉内皮细胞氧化损伤的保护作用[J].中国药理学通报,2010,26(5):657-60.
[3]Yang L J,You Y H,Lin Z B,Guo Z J,et al.Protective effects of ganoderma lucidum polysaccharides peptide on human umbilical vein endothelial cells injury by reactive oxygen species[J].Chin Pharmacol Bull,2010,26(5):657 -60.
[4]Liu S X,Hou F F,Guo Z J,et al.Advanced oxidation protein products accelerate atherosclerosis through promoting oxidative stress and inflammation[J].Arterioscler Thromb Vasc Biol,2006,26(5):1156-62.
[5]徐叔云,卞如濂,陈 修,主编.药理实验方法学[M].第3版.北京:人民卫生出版社,2002:1202-4.
[5]Xu S Y,Bian R L,Chen X,chief editor.Pharmacology experiment methodology[M].3rd ed.Beijing:People’s Medical Publishing House,2002:1202 -4.
[6]Duryee M J,Klassen L W,Schaffert C S,et al.Malondialdehydeacetaldehyde adduct is the dominant epitope after MDA modification of proteins in atherosclerosis[J].Free Radic Biol Med,2010,49(10):1480-6.
[7]Zhao H B,Lin S Q,Liu J H,Lin Z B.Polysaccharide extract isolated from ganoderma lucidum protects rat cerebral cortical neurons from hypoxia/reoxygenation injury[J].J Pharmacol Sci,2004,95:294-8.
[8]Zawadzka-Bartczak E.Activities of red blood cell anti-oxidative enzymes(SOD,GPx)and total anti-oxidative capacity of serum(TAS)in men with coronary atherosclerosis and in healthy pilots[J].Med Sci Monit,2005,11(9):CR440 -4.
[9]Violi F,Basili S,Nigro C,Pignatelli P.Role of NADPH oxidase in atherosclerosis[J].Future Cardiol,2009,5(1):83 - 92.
[10]Brown D I,Griendling K K.Nox proteins in signal transduction[J].Free Radic Biol Med,2009,47(9):1239 -53.
[11]Sorescu D,Weiss D,Lassègue B,et al.Superoxide production and expression of Nox family proteins in human atherosclerosis[J].Circulation,2002,105(12):1429-35.
[12]Lassegue B,Griendling K K.NADPH oxidases:functions and pathologies in the vasculature[J].Arterioscler Thromb Vasc Biol,2010,30(4):653-61.
[13]Ellmark S H,Dusting G J,Fui M N,et al.The contribution of Nox4 to NADPH oxidase activity in mouse vascular smooth muscle[J].Cardiovasc Res,2005,65(2):495 -504.
[14]Clempus R E,Sorescu D,Dikalova A E,et al.Nox4 is required for maintenance of the differentiated vascular smooth muscle cell phenotype[J].Arterioscler Thromb Vasc Biol,2007,27(1):42-8.

