嘌呤核苷磷酸化酶检测体系优化及芒果苷对其活性的影响
袁丽仙,牛艳芬,高丽辉,董馨怡,李 玲,刘 旭
(昆明医学院1.生物医学工程研究中心、2.科研实验中心,云南昆明 650500)
尿酸(uric acid,UA)是人类嘌呤代谢的终末产物,任何原因引起UA生成增多和(或)排泄减少均可导致高尿酸血症。通常高尿酸血症被认为是痛风的标志,据统计约有5% ~12%的高尿酸血症患者最终可发展为痛风[1]。近年来随着我国人民生活水平的提高,饮食结构的改变、肥胖者的增加,痛风的发病率已较15年前增长了15~30倍,成为我国常见多发的疾病之一。高尿酸血症不仅是痛风最重要的生化基础,最近还发现它与代谢紊乱综合征密切相关,是心血管疾病、高血压、肾脏疾病等独立的危险因素[2-3],也已成为严重威胁人类健康的代谢性疾病,联合国将其列为21世纪的20大顽症之一。
尿酸是由次黄嘌呤、黄嘌呤在黄嘌呤氧化酶的作用下生成的。内源性的嘌呤代谢紊乱导致尿酸生成过多,是原发性高尿酸血症的重要原因之一。除黄嘌呤氧化酶外,嘌呤代谢过程中还有许多酶的参与,其中嘌呤核苷磷酸化酶(purine nucleoside phosphorylase,PNP)也是嘌呤代谢途径中的关键酶之一,它催化腺苷、肌苷和鸟苷生成尿酸的前体物质腺嘌呤、次黄嘌呤和鸟嘌呤,它的活性异常可导致尿酸生成增加,形成高尿酸血症。
芒果苷(mangiferin,Fig 1)系四羟基吡酮的碳糖苷、属双苯吡酮类化合物,存在于多种植物中,资源非常丰富。国内外学者对芒果苷的药理学活性进行了较为广泛的研究,发现芒果苷具有一定的抗氧化、抗糖尿病、抗肿瘤、抗病毒和肝保护等多种药理作用[4-8]。本课题组前期研究发现芒果苷具有降低尿酸的作用,已获国家发明专利,其降尿酸作用与抑制黄嘌呤氧化酶的活性有关[9],但对PNP是否有抑制作用尚未见报道,因此,本文参照文献报道对PNP浓度、底物浓度及保持酶稳定性的DTT浓度进行优化,并研究芒果苷及其苷元对PNP活性的影响。
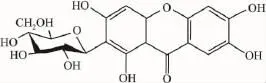
Fig 1 Chemical structure of mangiferin
1 材料及仪器
1.1主要试剂PNP(批号:57K1480)、鸟苷(批号:106K1848)均为美国Sigma公司产品,PNP蛋白含量57.8%,酶活性31 kU·g-1Pro;二硫苏糖醇(DTT)为Merck公司产品;其他试剂均为国产分析纯。
1.2供试药品芒果苷由昆明医学院生物医学工程研究中心提供,纯度≥95%,芒果苷元由昆明制药集团股份有限公司提供,纯度≥98%,临用前用DMSO配制,终浓度<1%。
1.3仪器SPECTRA MAX190全波长紫外-可见光酶标仪为美国Molecular Devices公司产品;紫外检测板(96孔)为美国Costar公司产品。
2 实验方法
2.1体外PNP活性检测体系的建立及优化参照文献[10-11],在96孔紫外检测板中加入不同浓度的PNP和 DTT 于 50 mmol·L-1KH2PO4-NaOH(pH 7.5)的缓冲液中,25℃温育15 min,再加入不同浓度的鸟苷启动反应,反应总体积为100 μl。在25℃、波长258 nm处动态监测反应,确定反应的最佳PNP、鸟苷、DTT浓度及反应时间。
2.2芒果苷及苷元对PNP活性的影响以优化后的反应体系研究芒果苷和芒果苷元对PNP活性的影响,即在96孔紫外检测板中加入系列浓度的芒果苷(苷元)、250 U·L-1PNP、0.5 mmol·L-1DTT,于25℃预温 15 min 后加入鸟苷 400 μmol·L-1启动酶促反应,波长258 nm处动态监测15 min,每30 s测1次,以15 min时的测量数据按下列公式计算出酶活性抑制率:酶活性抑制率/%=(酶组OD-样品组OD)/(酶组OD-空白组OD)×100%。
2.3统计学处理数据均用±s表示,采用软件GraphPad Prism 5.0进行统计学分析。
3 结果
3.1体外PNP活性检测体系的建立及优化
3.1.1探索最佳PNP浓度如Fig 2所示,当底物鸟苷浓度为 400 μmol·L-1,PNP 浓度为 125 U·L-1时,吸光度值(A)减少较缓慢,且变化不大,而酶浓度在250与500 U·L-1时,吸光度值减少量均较明显,能较好的反映酶的活力,且两者的反应曲线相似,故本实验PNP浓度采用250 U·L-1。
3.1.2探索最佳鸟苷浓度由Fig 3可知,随着鸟苷浓度的增加,底物的消耗量逐渐增多,对应的吸光值变化也逐渐增大,而当鸟苷浓度增加至400 μmol·L-1以上时,其吸光度值变化量减小,由此可见反应中的PNP可被浓度为400 μmol·L-1鸟苷完全饱和,在此条件下可完全反映PNP的活力。故本实验体系中鸟苷浓度采用 400 μmol·L-1。
3.1.3探索最佳DTT浓度随着DTT浓度的增加,反应时间缩短,反应速度加快(见Fig 4)。为便于观测反应情况,更好地体现PNP的活力,故选用DTT 的浓度为 0.5 mmol·L-1。

Fig 2 Time-course of the PNP activity(n=4)
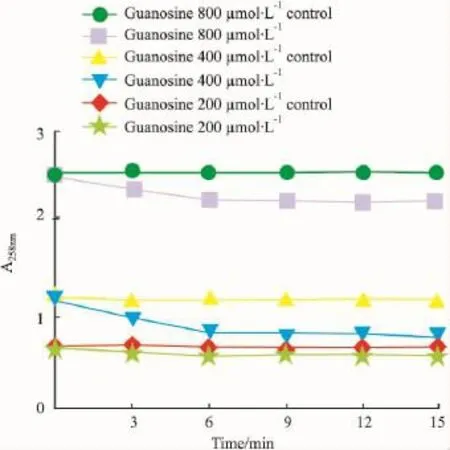
Fig 3 Effect of guanosine on the time-course of PNP activity(n=4)
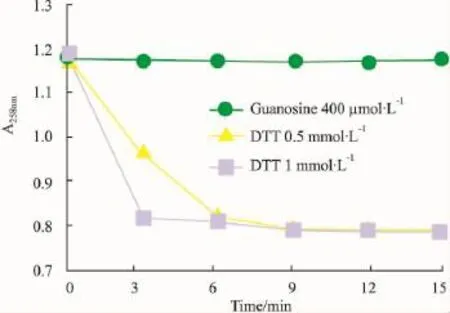
Fig 4 Effect of DTT on the time-course of PNP activity(n=4)
3.1.4探索反应时间上述采用的最佳PNP浓度250 U·L-1、最佳鸟嘌呤核苷浓度400 μmol·L-1及最佳DTT浓度所示的吸光度-时间曲线中可看出,反应达到平台期的时间为7~8 min,考虑到后续反应中受试样品对酶的影响,故延长反应时间,本实验采用动态监测反应时间为15 min。
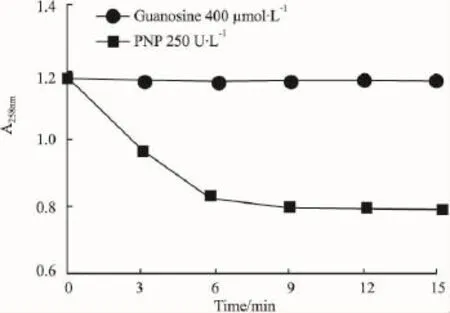
Fig 5 Time-course of 250 U·L-1PNP(n=4)
3.2芒果苷及苷元对PNP活性的影响在PNP浓度为 250 U·L-1、底物鸟苷为 400 μmol·L-1、DTT为0.5 mmol·L-1的反应条件下,动态监测15 min,观察芒果苷及其苷元对PNP活性的影响。结果表明在本实验条件下,芒果苷及其苷元在浓度高达100 μmol·L-1时,对 PNP 的活性没有明显抑制作用(Fig 6,7),反应15 min时的抑制率见Tab 1;溶媒对照1%DMSO对PNP活性没有影响,抑制率为0.18%。
4 讨论
PNP参与了嘌呤代谢,是尿酸生成途经中的关键酶之一。PNP活性增加,可以促进尿酸前体物质次黄嘌呤和黄嘌呤的生成增加,最终导致尿酸生成增多,促进高尿酸血症的发生及痛风的形成;PNP的过度抑制则引起体内肌苷、鸟苷等的堆积,而高浓度的鸟苷能抑制淋巴细胞的增殖[12],因而,维持适当的PNP活性具有重要的意义。
Tab 1 Effects of mangiferin and its aglycone on the activity of purine nucleoside phosphorylase in vitro(±s,n=4)
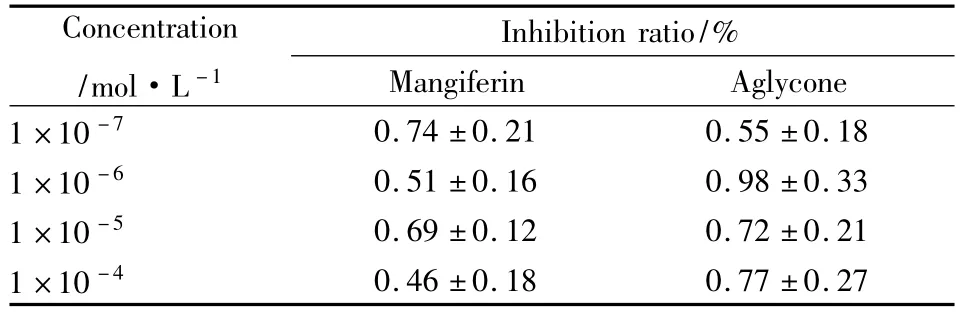
Tab 1 Effects of mangiferin and its aglycone on the activity of purine nucleoside phosphorylase in vitro(±s,n=4)
Mangiferin Aglycone 1×10-7 Concentration/mol·L -1 Inhibition ratio/%0.74 ±0.21 0.55 ±0.18 1 ×10 -6 0.51 ±0.16 0.98 ±0.33 1 ×10 -5 0.69 ±0.12 0.72 ±0.21 1×10-40.46 ±0.18 0.77 ±0.27

Fig 6 Effect of mangiferin on the time-course of PNP activity(n=4)
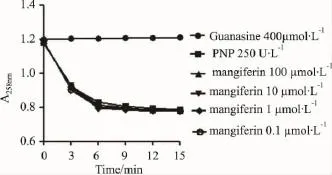
Fig 7 Effect of aglycone on the time-course of PNP activity(n=4)
腺苷、肌苷和鸟苷均可作为PNP的底物,目前PNP活性的检测方法主要有以鸟苷为底物,在258 nm检测底物消耗的紫外检测法[10],以及以肌苷为底物,与黄嘌呤氧化酶联合,以尿酸生成量为观察指标的紫外检测法[11],前者较为简便,因此,选择鸟苷作为PNP的底物,采用紫外法测定PNP的活性。本实验中PNP为商品化的高纯度酶,有较好的活性31 kU·g-1Pro。根据文献[10-11],对底物、酶、DTT 浓度进行优化,结果表明在PNP浓度为250 U·L-1、底物鸟苷为 400 μmol·L-1、DTT 0.5 mmol·L-1的反应条件下,PNP表现出较好的活性,有利于酶抑制剂的研究。
我们前期研究发现芒果苷灌胃给药能降低氧嗪酸钾所致高尿酸血症小鼠的血清尿酸水平,其机制与抑制黄嘌呤氧化脱氢酶的活性有关[9],在此基础上,进一步研究芒果苷及其代谢产物苷元对嘌呤代谢途径中的其他关键酶的影响,以明确芒果苷及苷元的降尿酸作用机制,结果显示在本实验条件下,芒果苷及其苷元在浓度高达100 μmol·L-1时,对PNP的活性没有抑制作用,提示芒果苷及苷元的降尿酸作用机制与抑制PNP的活性无关,可能对嘌呤代谢途径中的关键酶黄嘌呤氧化脱氢酶有较高的选择性。
[1]阎胜利,杨乃龙.高尿酸血症和痛风的流行病学[M]∥苗志敏,主编.痛风病学.北京:人民卫生出版社,2006:33-4.
[1]Yan S L,Yang N L.The epidemiology of hyperuricemia and gout[M]∥Miao Z M,Editior-in-chief.Gout.Beijing:People’s Medical Publishing House,2006:33 -4.
[2]Puig J G ,Martinez M A.Hyperuricemia,gout and the metabolic syndrome[J].Curr Opin Rheumatol,2008,20(2):187 -91.
[3]Edwards N L.The role of hyperuricemia and gout in kidney and cardiovascular disease[J].Cleve Clin J Med,2008,75(5):S13-6.
[4]Sato T,Kawamoto A,Tamura A,et al.Mechanism of antioxidant action of pueraia lycoside(PG-1)(anisoflovonoid)and mangiferin(axanthonoid)[J].Chem Pharm Bull,1992,40(3):721-4.
[5]Ichiki H,Miura T,Kubo M,et al.New antidiabetic compounds,mangiferin and its glucoside[J].Biol Pharm Bull,1998,21(12):1389-90.
[6]Guha S,Ghosal S,Chattopadhyay U.Antitumor,immunomodulatory and anti-HIV effect of mangiferin,a naturally occurring glucosylxanthone[J].Chemotherapy,1996,42(6):443 - 51.
[7]Yoosook C,Bunyapraphatsara N,Boonyakiat Y,Kantasuk C.Anti-herpes simplex virus activities of crude water extracts of Thai medicinal plants[J].Phytomedicine,2000,6(6):411 - 9.
[8]Yoshimi N,Matsunaga K,Katayama M,et al.The inhibitory effects of mangiferin,a naturally occurring glucosylxanthone,in bowel carcinogenesis of male F344 rats[J].Cancer Lett,2001,163(2):163-70.
[9]Niu Y F,Lu W,Gao L H ,et al.Reducing effect of mangiferin on serum uric acid levels in mice [J].Pharm Biol,DOI:10.3109/13880209.2012.663763.
[10]Takano Y,Hase-Aoki K,Horiuchi H,et al.Selectivity of febuxostat,a novel non-purine inhibitor of xanthine oxidase/xanthine dehydrogenase[J].Life Sci,2005,76(16):1835 -47.
[11]Kim B K,Cha S,Parks R E Jr.Purine nucleoside phosphorylase from human erythrocytes[J].J Biol Chem,1968,243(8):1763-70.
[12]Nishida Y,Kamatani N,Tanimoto K,Akaoka I.Inhibition of purine nucleoside phosphorylase activity and of T-cell function with allopurinol-riboside[J].Agents Actions,1979,9(5-6):549 - 52.

