四丁基丙二胺对人MG63骨髓瘤细胞增殖、凋亡和迁移能力的影响
张贺吉,王 凯,韩 钰,杨建林,王艳林
(1.三峡大学医学院,三峡大学分子生物学研究所,湖北宜昌 443002;2.武汉工程大学,湖北省新型反应器与绿色化学工艺重点实验室,湖北武汉 430073)
多胺(腐胺、精眯、精胺)是存在于真核细胞中的有机小分子,广泛参与细胞增殖、分化和基因表达与调控等重要生理功能[1-3]。近来研究发现,肿瘤细胞的快速生长依赖于细胞内异常升高的多胺含量,由此多胺代谢途径成为抗肿瘤治疗和抗肿瘤药物设计的新靶点[4-5]。多胺类似物是与天然多胺具有相似结构的小分子化合物,它们或者通过干扰多胺代谢而耗竭细胞内多胺库,或者竞争性抑制多胺的正常功能而阻遏肿瘤细胞增殖,诱导肿瘤细胞凋亡[6-9]。正在研究中的一批多胺类似物在体外虽能有效抑制肿瘤细胞生长,但高效低毒、能用于人体肿瘤治疗的类似物却为数不多。研发和筛选新的多胺类似物用于临床抗肿瘤治疗仍为当前的热点研究领域。四丁基丙二胺(tetrabutyl propanediamine,TBP)是本课题组协作单位武汉工程大学新合成的一种腐胺类似物,具有潜在的抗肿瘤药理活性。本研究分析了TBP对人MG63骨髓瘤细胞生长,凋亡及迁移能力的影响。
1 材料与方法
1.1材料人骨髓瘤细胞株MG63由本实验室保存,多胺类似物四丁基丙二胺(tetrabutyl propanediamine,TBP)由武汉工程大学王凯副教授合成,PVDF膜为Millipore公司产品;ECL试剂盒为Thermo公司产品;兔抗人Bax和细胞色素C多克隆抗体为Santa Cruz公司产品,羊抗兔IgG-HRP为Jackson公司产品。其它化学试剂来自Invitrogen和Sigma公司。Transwell细胞培养板为Corning公司产品。GelLogic-200凝胶图像分析仪为Kodak公司产品,EPLCS XL流式细胞分析仪为Becman-Coulter公司产品,全波长酶标仪为Thermo公司产品。
1.2方法
1.2.1MTT法测定细胞增殖速度取对数生长期的MG63细胞,调整细胞浓度至2×107·L-1后接种于96孔板中,每孔100 μl。37℃培养24 h后,向孔内加入含不同浓度TBP的DMEM培养液100 μl并继续培养。在设定的培养时间点去培养液,加入含200 mg·L-1MTT的无血清培养液,37℃孵育4 h后去上清,然后加入 DMSO 200 μl·well-1,室温振摇20 min溶解结晶,570 nm波长下检测每孔的吸光值A。细胞生存率/%=A药物/A对照×100%。
1.2.2Western blot法鉴定相关基因在蛋白水平上的表达将收集的培养细胞分为两份,一份用细胞裂解液 A(10 mmol·L-1HEPES,pH 7.2,210 mmol·L-1D-mannitol,70 mmol·L-1sucrose,5 mmol·L-1sodium succinate,0.2 mmol·L-1EGTA,100 mg·L-1digitonin)在冰浴裂解20 min,室温保温5 min后,600 r·min-1离心 5 min去细胞核,将上清转移至另一试管中,12 000 r·min-1离心10 min去线粒体,取上层裂解液用于细胞色素C(Cyt-C)检测。另一份用细胞裂解液 B(20 mmol·L-1Tris-HCl,pH 8.0,150 mmol·L-1NaCl,2 g·L-1NP-40)裂解、离心取上清用于Bax的检测。上述裂解液中的蛋白经10%的SDS-PAGE分离后,电转移至PVDF膜上。膜先后与第一抗体和HRP标记的第二抗体作用,ECL法示踪目标蛋白。实验中以β-actin作为内参照蛋白。
1.2.3流式细胞术(FCM)检测细胞周期收集对数生长期细胞,用含75%乙醇和0.5 mmol·L-1EDTA的PBS重悬细胞,4℃固定30 min后2 000 r·min-1离心 5 min 弃上清,用含1 g·L-1Triton X-100和50 mg·L-1RNAse的 PBS混合液500 μl重悬细胞,加入 0.5 g·L-1PI(Propidium Iodide)90 μl,37℃避光保温30 min,尼龙膜过滤,流式细胞分析仪检测。
1.2.4Transwell技术分析肿瘤细胞的迁移能力无血清DMEM培养基培养MG63细胞4 h,收集细胞后用含2 g·L-1BSA的DMEM基础培养基重悬细胞,调整细胞密度为 2.5 ×108·L-1,取 200 μl细胞悬液铺在Transwell上室中,同时加入TBP(终浓度为 40 μmol·L-1),下室内加入 800 μl含 10% 胎牛血清的DMEM培养基,37℃培养18 h后,PBS清洗小室细胞2次,4%多聚甲醛室温固定小室膜30 min,PBS清洗3次后,苏木精染细胞核5 min,清水浸泡20 min,用棉签轻轻擦拭上室内侧面的细胞,同时清水冲洗3~5遍,用镊子拨下小室的膜,下侧面向上平铺于载玻片,显微镜下随机观察5个视野并做细胞计数,取其平均值代表细胞的迁移能力。
1.2.5统计学分析实验数据采用组间t检验经SPSS 2.0软件进行统计分析,结果用±s表示。
2 结果
2.1TBP对MG63细胞增殖的影响用MTT法检测了TBP对MG63细胞生长的影响,结果显示,TBP能明显抑制MG63细胞生长,抑制效应呈浓度和时间依赖性(Tab 1)。
2.2TBP对肿瘤细胞生长周期的影响分别收集40 μmol·L-1TBP 处理48 h 和对照 MG63 细胞,利用流式细胞仪检测细胞周期变化,结果显示,TBP处理MG63细胞后,G1期和G2期细胞增加但S期细胞明显减少,同时出现大量凋亡细胞(亚凋亡峰),提示多胺类似物TBP可能通过干扰细胞周期而影响MG63细胞的正常生长,并同时诱导MG63骨肉瘤细胞发生凋亡(Tab 2,Fig 1)。
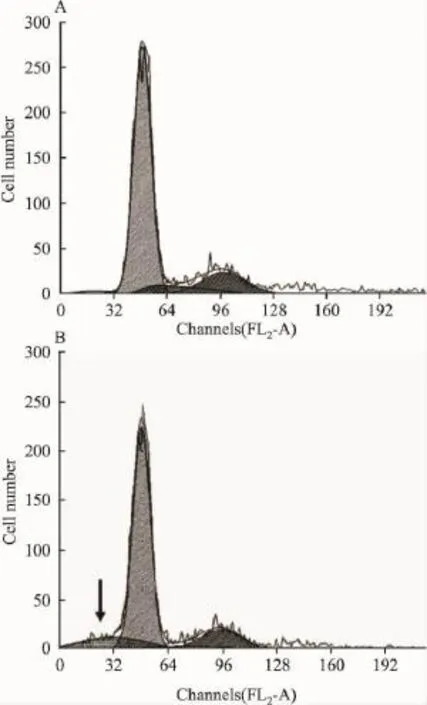
Fig 1 Effect of TBP on cell cycle and apoptosis in MG63 cells
Tab 1 Effect of TBP on cell survival rate in MG63 cells with MTT method(±s,n=3)
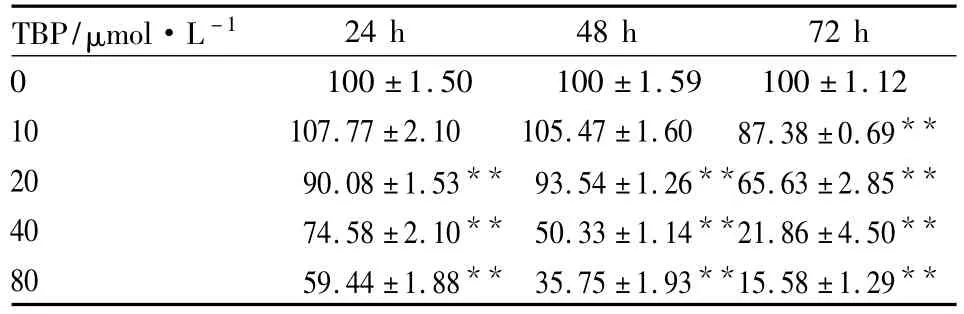
Tab 1 Effect of TBP on cell survival rate in MG63 cells with MTT method(±s,n=3)
The cells were treated by 0~40 μmol·L-1TBP for 24~72 h.**P <0.01 vs 0 μmol·L -1TBP group.
TBP/μmol·L -124 h 48 h 72 h 0 100 ±1.50 100 ±1.59 100 ±1.12 10 107.77 ±2.10 105.47 ±1.60 87.38 ±0.69**20 90.08 ±1.53** 93.54 ±1.26**65.63 ±2.85**40 74.58 ±2.10** 50.33 ±1.14**21.86 ±4.50**80 59.44 ±1.88** 35.75 ±1.93**15.58 ±1.29**
Tab 2 Effect of TBP on cell cycle in MG56 cells with flow cytometry method(±s,n=3)

Tab 2 Effect of TBP on cell cycle in MG56 cells with flow cytometry method(±s,n=3)
The cells were treated by 40 μmol·L -1TBP for 48 h.**P <0.01 vs control group
MG63-control 75.61 ±0.55 12.57±0.40 11.82±0.45 0.46 ±0.06 MG63-TBP 79.68 ±1.42**16.24±0.43** 4.08±0.79**11.74 ±1.44**
2.3TBP对DNA片段化的影响40 μmol·L-1TBP处理MG63细胞48 h后,分别提取处理细胞和对照细胞胞质中的DNA,然后对样本进行Agarose凝胶电泳分析,结果显示,TBP处理导致凋亡细胞典型的DNA的片段化现象(Fig 2)。

Fig 2 Cell apoptosis induced by TBP with DNA degradation assay
2.4TBP对凋亡相关蛋白的影响用Western blot分析了TPB处理后,MG63细胞质中凋亡相关蛋白Bax和Cyt C水平的影响。结果发现,TBP导致促凋亡蛋白Bax蛋白水平增加和Cyt C从线粒体的释放(Fig 3)。
2.5药物对肿瘤细胞迁移能力的影响用Transwell技术分析了TBP对MG63细胞迁移能力的影响,结果显示,TBP处理细胞降低MG63细胞的迁移能力,与对照细胞比较,差异具有显著性(Tab 3)。
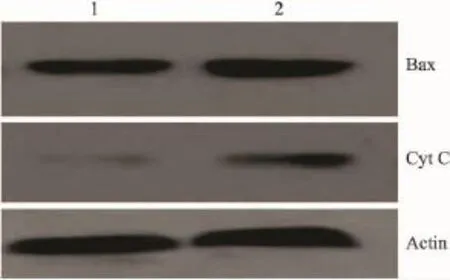
Fig 3 Bax and Cyt C levels in the cytosol of MG63 cells with Western blot
Tab 3 Effect of TBP on cell migration in MG63 cells(cell number/Each field of vision,±s,n=5)

Tab 3 Effect of TBP on cell migration in MG63 cells(cell number/Each field of vision,±s,n=5)
The cells were treated by 40 μmol·L -1TBP for 48 h.**P <0.01 vs control group
Group Migrated cell MG63-control 43.7 ±9.29 MG63-TBP 5.2 ±1.58**
3 讨论
通过控制多胺代谢和干扰多胺功能而抑制肿瘤生长是抗肿瘤药物设计的新策略,其中抗肿瘤多胺类似物的合成与筛选为当前的研究热点,本研究应用的TBP即为新合成的一种腐胺对称性修饰物。为探讨TBP作为抗肿瘤药物的潜在价值,本研究以人骨髓瘤MG63细胞为实验对象,分析了TBP对瘤细胞增殖、迁移和凋亡的影响。结果证实,TBP能有效抑制MG63细胞的生长,且这种抑制呈时间和剂量依赖性。随后的细胞周期和细胞凋亡分析提示,上述抑制作用可能与TBP抑制细胞周期和诱导细胞凋亡密切相关。多胺能与DNA分子结合,参与DNA构象转换,结构稳定、染色质凝缩和解凝缩等过程,以及调节转录因子与DNA元件间的相互作用,并由此加快DNA复制和细胞分裂[10-12]。作为一种多胺的结构类似物,TBP可能干扰了上述多胺的正常功能,导致DNA复制障碍,细胞周期抑制,S期细胞明显减少。肿瘤细胞的典型特征之一是丧失发生凋亡的能力,因而诱发肿瘤细胞凋亡是抗肿瘤药物设计的重要目标。细胞凋亡分为外源性凋亡和内源性凋亡两大类,而线粒体结构和功能的改变是内源性细胞凋亡的核心事件[13]。在本研究中,TBP处理导致MG63细胞发生典型的DNA片段化现象和流式细胞分析中亚凋亡峰(Sub-G1)的出现,以及线粒体促凋亡蛋白Bax和Cyt C在胞质中含量增加,均提示TBP激活了线粒体介导的凋亡途径。
上述结果提示,TBP有作为骨髓瘤治疗药物的临床应用前景。在后续研究中,我们将进一步探讨TBP抗肿瘤药理活性的分子机制,特别是对多胺代谢的影响,以及在动物水平上评价该药的安全性。
[1]Casero R A,Pegg A E.Polyamine catabolism and disease[J].Biochem J,2009,421(3):323 -38.
[2]Wallace H M,Fracer A V,Hughes A.A perspective of polyamine metabolism[J].Biochem J,2003,374:1 -14.
[3]Childs A C,Mehta D J,Gerner E W.Polyamine-dependent gene expression[J].Cell Mol Life Sci,2003,60:1394 - 406.
[4]Gerner E W,Meyskens F L Jr.Polyamines and cancer:old molecules,new understanding[J].Nat Rev Cancer,2004,4(10):781-92.
[5]Casero R A,Marton L J.Targeting polyamine metabolism and function in cancer and other hyperproliferative diseases[J].Nature Rev Drug Disc,2007,6(5):373 -90.
[6]Seiler N.Pharmacological aspects of cytotoxic polyamine analogues and derivatives for cancer therapy[J].Pharmacol Ther,2005,107(1):99-119.
[7]Huang Y,Pledgie A,Casero R A Jr,Davidson N E.Molecular mechanisms of polyamine analogues in cancer cells[J].Anticancer Drugs,2005,16(3):229 -41.
[8]王艳林,韩 钰,袁太宁,周永琴.多胺类似物CPENSpm通过干扰多胺代谢抑制肺癌细胞的增殖[J].中国药理学通报,2008,24(1):132 -5.
[8]Wang Y L,Han Y,Yuan T N,Zhou Y Q.Polyamine analogue CPENSpm inhibits proliferation of human lung cancer cells by interfering polyamine metabolism[J].Chin Pharmacol Bull,2008,24(1):132-5.
[9]Casero R A,Woster P M.Recent advances in the development of polyamine analogues as antitumor agents[J].J Med Chem,2009,52:4551-73.
[10]Thomas T J,Messner R P.Structural specificity of polyamines in left-handed Z-DNA formation.Immunological and spectroscopic studies[J].J Mol Biol,1988,201:463 - 7.
[11]Feuerstein B G,Williams L D,Basu H S,Marton L J.Implications and concepts of polyamine-nucleic acid interactions[J].J Cell Biochem,1991,46:37 -47.
[12]Panagiotidis C A,Artandi S,Calame K,Silverstein S J.Polyamines alter sequence-specific DNA-protein interactions[J].Nucleic Acids Res,1995,23:1800 -9.
[13]Kimi H E,Du F H,Fang M,Wang X D.Formation of apoptosome is initiated by cytochromecinduced dATP hydrolysis and subsequent nucleotide exchange on Apaf-1[J].PNAS USA,2005,102(4):17545-50.

