在线固相萃取-液质联用法定量分析生物基质中丁香醛及其在大鼠体内药代动力学研究中的应用
王允吉,王清清,杨志晖,杨 杰,关 华,周平坤,宋海峰
(1.安徽医科大学药学院,安徽合肥 230032;2.军事医学科学院放射与辐射医学研究所,北京 100850)
香兰素又名香草醛(结构见Fig 1),其具有特殊香气,作为食品添加剂被广泛使用。近年来,香兰素在医药领域的应用与研究也受到了关注,多应用于慢性疼痛和神经性疼痛[1],也有报道称香兰素能抑制X射线和紫外线诱导的染色体畸变,但香兰素抗辐射作用浓度相对较高,活性较低[2-3]。研究人员筛选出抗辐射作用更好的香兰素衍生物丁香醛(结构见Fig 2),前期药效学结果显示♂BALB/C小鼠照射前灌胃给予丁香醛混悬液(给药剂量10,50,100 mg·kg-1),均能有效地降低小鼠骨髓嗜多染红细胞微核率和染色体畸变率,同时提高骨髓有丝分裂指数,对60Co γ射线诱发的小鼠骨髓损伤有良好的保护作用[4]。因此,丁香醛具有发展成为新型辐射防护药物的价值。为了阐明其药代动力学特性,需建立针对生物样品中丁香醛的定量分析方法。本研究根据丁香醛的结构特点及理化性质建立了一种快速、特异、灵敏和准确的在线固相萃取-液质联用方法(on-line SPE LC-MS/MS),并将验证后的方法应用于大鼠体内丁香醛的初步药代动力学研究中。
1 材料
1.1仪器API 4000型三重四极杆串联质谱仪,配有电喷雾离子源以及Analyst 1.5数据处理系统(美国Applied Biosystem公司);岛津SIL-20AC型高效液相色谱输液泵和自动进样器(日本SHIMADZU公司)。On-line SPE HPLC-MS/MS装置为实验室自行搭建[5-7],装置工作原理见Fig 3。固相萃取柱的出口连接至切换阀,其两个出口通过切换阀的切换功能,可分别连接废液瓶(Waste)和分析柱。转动切换阀切换至Fig 3中(A)位置,固相萃取柱和反相分析柱各自独立,固相萃取柱平衡后,血浆样品进入固相萃取柱,经大流速流动相萃取和冲洗;转动切换阀至Fig 3中(B)位置,固相萃取柱和反相分析柱成串联状态,待测组分经洗脱后从分析柱分离进入质谱仪检测。
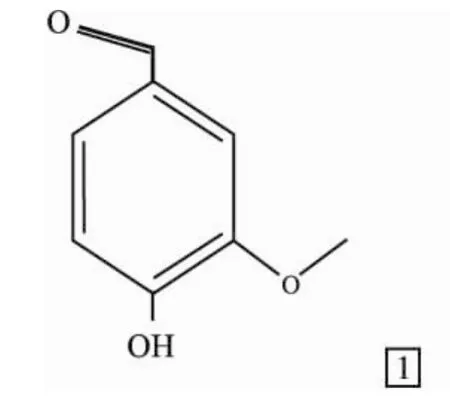
Fig 1 The structure of vanillin
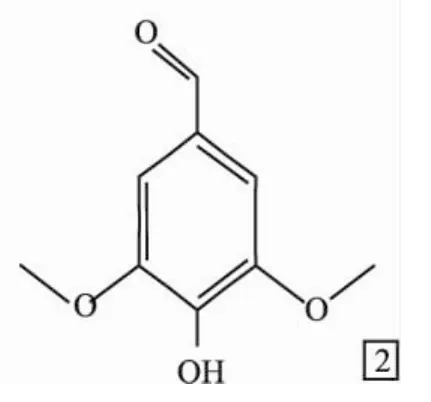
Fig 2 The structure of syringaldehyde
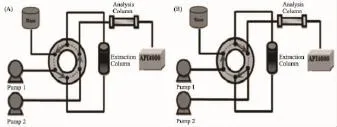
Fig 3 The configuration of on-line SPE HPLC-MS/MS system
1.2试剂丁香醛对照品(军事医学科学院二所七室提供,批号:20100316,纯度为99.5%,4℃保存);香兰素对照品(军事医学科学院二所七室提供,批号:20100409,纯度为99.5%,4℃保存);乙腈(Merck公司,色谱纯),甲酸(北京化学试剂公司,分析纯)。实验用水为Millipore Synergy UV纯水仪制备的超纯水。
1.3动物健康SD大鼠4只(清洁级),♂♀各半,2月龄,体质量(200±20)g,军事医学科学院实验动物中心提供(许可证号:SCXK-[军]2007-004)。单笼饲养,12 h昼夜节律照明,实验期间自由饮水。
2 方法
2.1 HPLC-MS/MS条件液相条件:分析柱:Alltima HP C18 柱(50 mm ×2.1 mm,5 μm),在线固相萃取柱:Alltech公司不锈钢柱(50 mm×2.1 mm),固相萃取柱填料(Zobax球形填料,40 μm ~60 μm粒径),分析柱流动相:乙腈-0.1%甲酸(60∶40,V∶V),流速:0.4 ml·min-1;固相萃取柱流动相为乙腈-0.1%甲酸,流速为3.0 ml·min-1;进样量为10 μl;流动相梯度程序见Tab 1。
质谱条件:API 4000离子喷射电压为4500 V;温度 450℃;离子源气体 1(N2)压力为 45 p.s.i,离子源气体2(N2)压力为 60 p.s.i,气帘气体(N2)压力为 20 p.s.i,碰撞气压力为 6 p.s.i;去簇电压(DP)为50 V;碰撞能量(CE)为52 V;扫描时间均为0.2 s。正离子方式检测;扫描方式为多反应监测(MRM);用于定性的离子反应为m/z 183.2→m/z 155.0(丁香醛),用于定量分析的离子反应分别为m/z 183.2→m/z 123.1(丁香醛),m/z 153.1→m/z 93.0(内标,香兰素)。
2.2溶液配制精密称取丁香醛对照品1.0 mg,置于1.5 ml离心管中,用乙腈-水(50∶50,V∶V)配制成1.0 g·L-1的储备液,取10 μl上述储备液,加入90 μl的乙腈 - 水(50 ∶50,V∶V)配制0.1 g·L-1的母液A,用乙腈 - 水(50∶50,V∶V)逐级稀释母液 A 得到系列工作液(200、400、1 000、2 000、4 000、10 000、20 000和40 000 μg·L-1)。按上述方法另配制0.1 g·L-1的丁香醛母液B,用乙腈-水(50∶50,V∶V)稀释母液B得到质控样品溶液(500、15 000和30 000 μg·L-1)。取香兰素对照品1.0 mg,置于1.5 ml离心管中,用乙腈-水(50∶50,V∶V)配制成1.0 g·L-1的储备液,精密量取储备液适量,用乙腈稀释成浓度为50 μg·L-1的内标溶液,4℃保存备用。

Tab 1 The procedure of On-line SPE HPLC-MS/MS system
2.3血浆样品预处理将样品在室温解冻,取30 μl的血浆样品加入 90 μl冰乙腈(含 50 μg·L-1内标),涡旋混匀,离心7 min(13 000 r·min-1),取上清10 μl进样,用于在线提取和分析过程。
2.4动物实验方法取SD大鼠4只(♀♂各2只),分为两组,实验期间自由饮水。以上述丁香醛剂量(17.5 和70 mg·kg-1)经灌胃给药 0.6 ml,于0 min(给药前),1、5、10、15、25、30、45 min,1、1.5、2、2.5、3、4 h 眼眶静脉丛取血。用 1.09 mol·L-1柠檬酸钠抗凝管收集血样,5 000 r·min-1离心10 min,分离血浆,置于-80℃冰箱保存待测。
3 结果
3.1线性范围分别取“2.2”项方法配制的系列工作液5 μl加入到95 μl的空白大鼠血浆中,得到浓度为 10、20、50、100、200、500、1 000和2 000 μg·L-1的标准血浆样品,按照“2.3血浆样品预处理”项下方法操作,进样10 μl,记录色谱图。以丁香醛和内标香兰素的峰面积比值为纵坐标(Y),以丁香醛浓度为横坐标(X),用加权最小二乘法进行回归运算,权重系数为1/x,求得回归方程为Y=0.00518X+0.0538(r=0.9997),本方法在 10.0 μg·L-1~2 000 μg·L-1范围内线性关系良好。定量下限为10 μg·L-1。
3.2准确度和精密度按“3.1”项下方法分别制备低、中、高3个浓度(浓度分别为25、750和1500 μg·L-1)的SD大鼠血浆QC样品,每一浓度进行6样本分析,连续测定3 d,根据当日随行标准曲线,分别计算QC样品的测得浓度,求得方法的准确度RE(QC样品测量均值对真值的相对误差)与精密度RSD(QC样品测得值的相对标准偏差),结果见Tab 2。本分析方法的日内精密度RSD均<16.3%,日间精密度RSD均<13.8%,准确度RE在-8.5% ~5.9%之间,均符合目前生物样品分析方法指导原则的有关规定,该法可用于准确测定SD大鼠血浆中丁香醛的浓度。
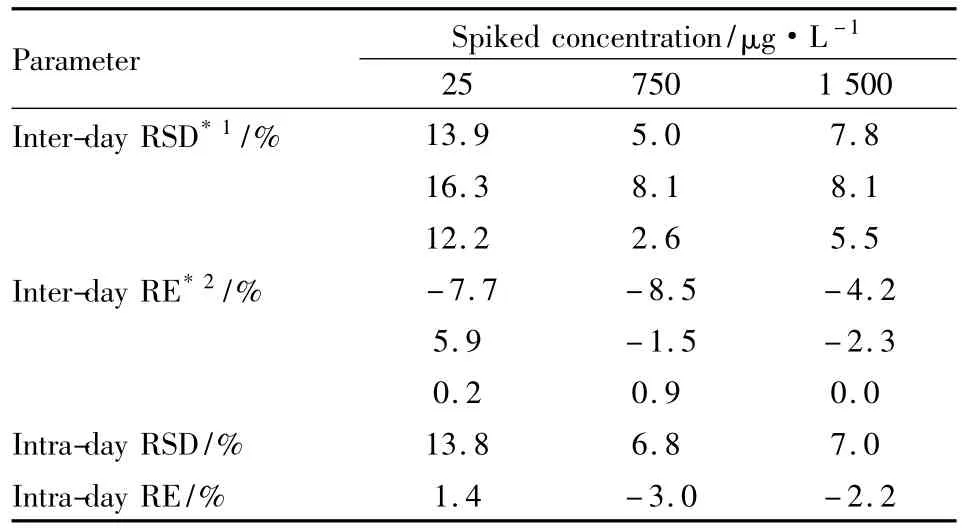
Tab 2 Precision and accuracy of syringaldehyde in Sprague-Dawley rat plasma(n=6)
3.3特异性分别取6个不同个体SD大鼠的空白血浆、空白血浆外加定量下限(10 μg·L-1)的丁香醛样品,以及SD大鼠给药后的血浆样品,按照“2.3血浆样品预处理”项下方法操作,结果显示血浆中内源性物质不会干扰丁香醛和内标香兰素的测定。Fig 4是丁香醛大鼠血浆样品处理后经on-line SPE HPLC-MS/MS测定后的结果。
3.4提取回收率按“3.2”项下所述方法分别制备低、中、高3个浓度(浓度分别为25、750和1 500 μg·L-1)的萃取血浆样品,每个浓度平行6样本分析。未萃取血浆样品分别取上述6个不同个体的空白血浆经蛋白沉淀后,用On-line SPE系统收集萃取液,用上述萃取液配制低、中、高3个浓度的QC样品。提取回收率为萃取血浆样品的峰面积之比(分析物/内标)与未经萃取血浆样品的峰面积之比(分析物/内标)的比值。结果表明丁香醛在低、中、高3个浓度QC样品中的提取回收率分别为(97.2±12.9)%、(116.7±7.7)%和(109.6±8.8)%,可见方法提取回收率良好。
3.5样品稳定性按“3.2”项下方法分别制备低、中、高3个浓度(浓度分别为 25、750 和1 500 μg·L-1)的SD大鼠血浆QC样品,每个浓度平行制备6样本,分别在室温放置12 h、反复冻(-80℃)融3个循环,以及QC待进样样品(经样品预处理后)在样品盘中室温放置8 h,将上述样品按“2.3血浆样品预处理”项下操作,以当日标准曲线分别计算QC样品的测得浓度,与加入浓度进行比较,Tab 3分别为丁香醛大鼠血浆样品在不同条件下的稳定性。结果表明丁香醛大鼠血浆样品室温放置12 h,反复冻融3次,处理后在样品盘放置8 h条件下均保持稳定。
3.6方法的通用性按“3.2”项下方法分别制备低、中、高3个浓度(浓度分别为25、750和1 500 μg·L-1)的猕猴血浆QC样品,每一浓度进行6样本分析,连续测定3 d,以当日标准曲线计算QC样品浓度,求得方法的准确度RE与精密度RSD。本分析方法的日内精密度RSD均<8.4%,日间精密度RSD均<9.9%,准确度RE在 -10.6% ~7.6%之间,均符合目前生物样品分析方法指导原则的有关规定。故该方法同样适用于猕猴血浆样品的检测,具有一定的通用性。
3.7SD大鼠药代动力学参数SD大鼠灌胃给予丁香醛药液后取样测定,通过Origin7.5软件处理得到的血药浓度-时间曲线见Fig 5。通过WinNonlin软件进行数据处理,用非房室模型统计距方法计算各种药代动力学参数。低、高剂量组的Tmax分别为10.0 min 和 27.5 min;Cmax分别为 361 μg·L-1和944 μg·L-1;消除半衰期分别为41.9 min和54.0 min;CL 分别为 848.1 ml·min-1·kg-1和683.9 ml·min-1·kg-1;AUC0-t分别为 19016.8 μg·min·L-1和 89322.0 μg·min·L-1。

Fig 4 The specific chromatograms of method(1:syringaldehyde;2:IS)
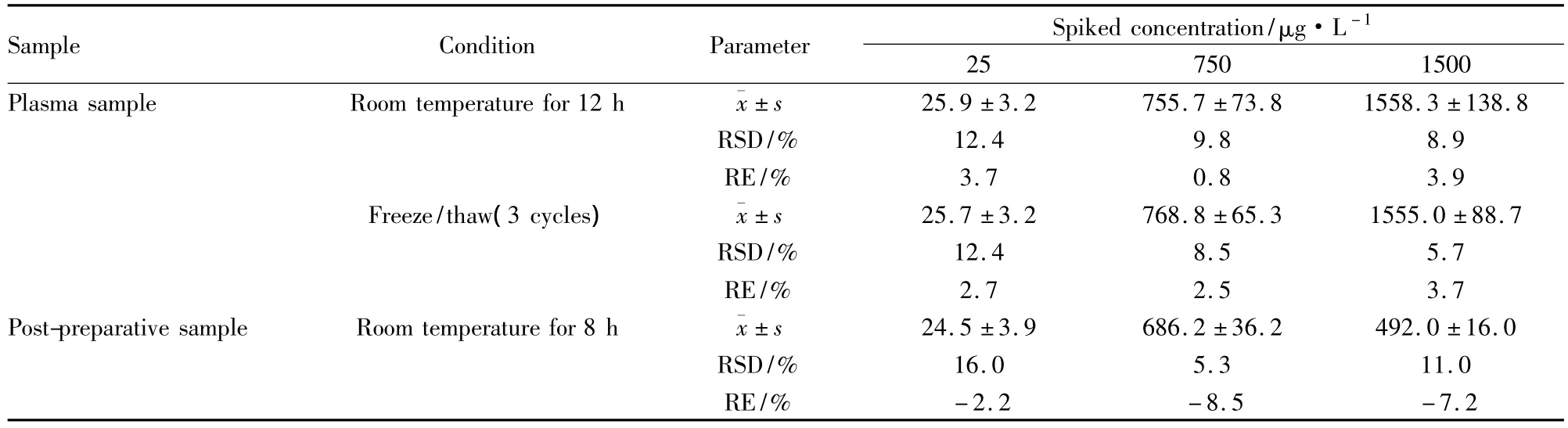
Tab 3 Stability of syringaldehyde in different conditions
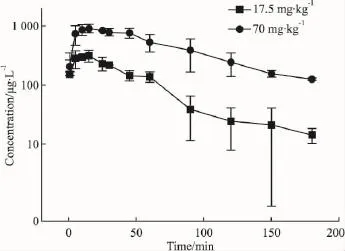
Fig 5 Mean plasma concentration-time curve of syringaldehyde in Sprague-Dawley rats after intragastric administration(17.5 mg·kg-1and 70 mg·kg-1,±s)
4 讨论
4.1分析条件的优化实验考察了乙腈与不同比例醋酸铵和甲酸水溶液对丁香醛和内标香兰素峰形和响应值的影响,最终确定分析用流动相为乙腈:0.1%甲酸水溶液(60∶40,V∶V)。文献报道[1]选用C8柱(100 mm ×2.1 mm,5 μm)可以获得较好的峰形和分离度,但是分析时间较长,本实验选用Alltima HP C18 柱(50 mm ×2.1 mm,5 μm)作为分析柱,不仅峰形良好且缩短了分析时间,整个分析周期仅为5 min。
在ESI源正离子模式下对丁香醛和内标香兰素进行Q1全扫描,丁香醛和内标香兰素的分子离子峰[M+H]+分别为 m/z 183.2和 m/z 153.1,选择其作为母离子进行碎片离子扫描,丁香醛和内标香兰素的主要碎片离子分别为 m/z 123.1和m/z 93.0,故选二者主要离子对m/z 183.2→m/z 123.1和m/z 153.1→m/z 93.0为MRM分析的定量离子对。采用MRM较选择离子监测方式(SRM)具有更高的专属性和灵敏度。
4.2样品前处理方法的选择由于血浆中内源性基质较为复杂,在样品分析过程中随着进样次数的增多系统压力增高而损坏分析柱,同时会造成灵敏度下降。目前蛋白沉淀法是生物样品前处理最常用的方法[8-10]。On-line SPE HPLC-MS/MS 系统是本实验室自行搭建的一套样品前处理和样品定量分析于一体的在线装置,可以实现高通量样品分析,在样品制备过程中能有效的去除杂质,提高分析柱使用寿命。针对丁香醛,分别优化了上样体积、上样溶剂、活化溶剂及时间,最终选择乙腈为活化溶剂,活化时间为2 min,水为上样试剂,时间为3 min(见Tab 1)。文献报道香兰素[1]和丁香酚[11-13]均采用蛋白沉淀后进行丹酰氯衍生化反应,采用LC-MS/MS法检测。虽然灵敏度较高,但是样品的处理过程繁琐耗时,且易引入衍生化反应的副产物。对比文献报道丁香酚[12]在SD大鼠血浆中的定量下限20 μg·L-1,本研究建立的方法更加灵敏,且分析时间较短,更适合高通量样品检测。
本研究对丁香醛在SD大鼠血浆中定量分析方法进行了优化,建立了SD大鼠血浆样品中丁香醛的on-line SPE LC-MS/MS定量分析方法,并进行了严格的方法学确证。确证后的方法被应用于SD大鼠体内丁香醛的初步药代动力学研究中。结果表明,本研究建立的生物基质中丁香醛的on-line SPE LC-MS/MS定量分析方法较文献报道方法更为快速灵敏,适用于丁香醛在SD大鼠体内的药代动力学研究。且本方法的适用性广泛,有望应用于后续临床前和临床药代动力学和相关定性和定量分析研究中。
[1]Beaudry F,Ross A,Lema P P,et al.Pharmacokinetics of vanillin and its effects on mechanical hypersensitivity in a rat model of neuropathic pain[J].Phytother Res,2010,24(4):525 - 30.
[2]黄 锐,贺性鹏,徐勤枝,等.香兰素衍生物VND3207对γ射线照射人淋巴母细胞基因组织损伤和凋亡的保护作用[J].辐射防护,2009,29(4):225-31.
[2]Huang R,He X P,Xu Q Z,et al.Protection of Vanillin derivative VND3207 on genome damage and apoptosis of human lymphoblastoid cells induced by γ-ray irradiation[J].Radiat Protec,2009,29(4):225-31.
[3]郑 红,汪思应,严雨倩,等.香兰素衍生物对辐射损伤细胞保护作用的初步研究[J].辐射防护,2008,28(4):226-31.
[3]Zheng H,Wang S Y,Yan Y Q,et al.The primary study on protective effects of Vallinin derivative on cell injury induced by radiation[J].Radiat Protect,2008,28(4):226 -31.
[4]汪传高,汪 黎,周平坤,等.香兰素衍生物VND3207对小鼠骨髓细胞遗传损伤的防护效应研究[J].中华放射医学与防护杂志,2010,30(5):558-60.
[4]Wang C G,Wang L,Zhou P K,et al.Radiological protection effect of vanillin derivative VND3207 against radiation-induced cytogenetic damage in mouse bone marrow cells[J].Chin J Radiol Med Protect,2010,30(5):558 -60.
[5]Wang Q Q,Xiang S S,Jia Y B,et al.An improved on-line solid phase extraction coupled HPLC-MS/MS system for quantification of sifuvirtide in human plasma[J].J Chromatogr B Analyt Technol Biomed Sci,2010,878(21):1893 -8.
[6]李小双,王清清,孙 效,等.自动化在线固相萃取HPLC/MS/MS法分析比格犬血浆中的葛根素含量[J].军事医学科学院院刊,2007,31(3):246-9.
[6]Li X S,Wang Q Q,Sun X,et al.Application of an on-line solid phase extraction column switching liquid chromatography tandem mass spectrometry system to quantification of puerarin beagle plasma[J].Milit Med Sci,2007,31(3):246 -9.
[7]Wang Q Q,Li X S,Dai S,et al.Quantification of puerarin in plasma by on-line solid phase extraction column switching liquid chromatography-tandem mass spectrometry and its applications to a pharmacokinetic study[J].J Chromatogr B Analyt Technol Biomed Life Sci,2008,863(1):55 -63.
[8]刘史佳,居文政,刘子修,等.液相色谱-电喷雾离子化-质谱联用法测定大鼠血浆中紫胡皂苷α浓度及其药代动力学[J].中国药理学通报,2009,25(10):1380-3.
[8]Liu S J,Ju W Z,Liu Z X,et al.Pharmacokinetic study of saikosaponin α in rat plasma by LC-ESI-MS[J].Chin Pharmacol Bull,2009,25(10):1380-3.
[9]王 莉,贾彦波,陈 方,等.HPLC-MS/MS法测定大鼠血浆中的知母皂苷B-Ⅱ[J].中国药理学通报,2010,26(8):1064-8.
[9]Wang L,Jia Y B,Chen F,et al.Quantification of Timosaponin B-Ⅱin rat plasma by liquid chromatography tandem mass spectrometry[J].Chin Pharmacol Bull,2010,26(8):1064 -8.
[10]单晨啸,李 伟,文红梅,等.UPLC法测定大鼠血浆中Liguzinediol浓度以及动力学研究[J].中国药理学通报,2011,27(5):709-12.
[10]Shan C X,Lei W,Wen H M,et al.Determination of Liguzinediol and its pharmacokinetics in rat by ultra performance of liquid chromatograph[J].Chin Pharmacol Bull,2011,27(5):709 -12.
[11]Guénette S A,Ross A,Marier J F,et al.Pharmacokinetics of eugenol and its effects on thermal hypersensitivity in rats[J].Eur J Pharmacol,2007,562(1 -2):60 -7.
[12]Guenette S A,Beaudry F,Marier J F,et al.Pharmacokinetics and anesthetic activity of eugenol in male Sprague-Dawley rats[J].Vet Pharmacol Ther,2006,29(4):265 -70.
[13]Beaudry F,Guénette S A,Winterborn A,et al.Development of a rapid and sensitive LC-ESI/MS/MS assay for the quantification of propofol using a simple off-line dansyl chloride derivatization reaction to enhance signal intensity[J].Pharm Biomed Anal,2005,39(3-4):411-7.

