PPARγ基因靶向shRNA真核表达载体的构建及表达
高 艳,占日新,刘丽丽,陈芳辉,李宙雪,张 盈,孔 滢,黄起壬
(南昌大学药学系药理学与分子治疗学实验室,江西南昌 330006)
过氧化物酶体增殖物激活受体(PPARs)是一类由配体激活的转录因子,属于核受体超家族成员,包括3种亚型:PPARα、PPARβ 和 PPARγ[1]。其中 PPARγ 与脂肪细胞分化、胰岛素抵抗、能量代谢和胰岛素的敏感性密切相关,表达于成纤维细胞、平滑肌细胞、乳腺细胞、脾脏的红白髓质、骨髓前体细胞、单核细胞和巨噬细胞、肺泡及气道上皮细胞和血管内皮细胞等细胞中[2-3]。关于PPARγ改善机体胰岛素敏感性的机制研究,一直是人们关注的热点之一。美国加州大学和瑞士洛桑联邦理工学院的研究表明,敲除实验鼠脂肪细胞内核受体共抑制因子(NCoR)可改善胰岛素敏感性。NCoR存在于很多细胞中,是转录因子辅助调节蛋白,是主要的PPARγ的共抑制因子。敲除实验鼠脂肪细胞内NCoR后,PPARγ磷酸化受阻,最后导致肝脏、肌肉和脂肪胰岛素敏感性增加[4-5]。本实验拟构建针对PPARγ基因的短发夹环状小干扰RNA(shRNA)重组载体,并将其转染到人脐静脉内皮细胞(HUVECs),筛选出抑制效果最好的重组表达载体,为进一步研究PPARγ低表达对高糖诱导血管内皮胰岛素抵抗及其敏感性的作用及机制奠定实验基础。
1 材料与方法
1.1质粒、菌种与细胞株pGPU6/GFP/Neo质粒购自上海吉玛公司;脂质体为LipofectamineTM2000;人脐静脉内皮细胞株购自ATCC。
1.2工具酶及主要试剂限制性内切酶BbsⅠ和BamHⅠ购自美国NEB公司;限制性内切酶PstⅠ购自Promega公司;T4连接酶和DNA Marker购自TaKaRa公司;质粒小提试剂盒和DNA胶回收纯化试剂盒购自Qiagen公司;Top10感受态细胞购自天根公司;DMEM培养基干粉购自Invitrogen公司;特级胎牛血清购自杭州四季青生物制品公司;Kanamycin购自Sigma公司;PPARγ多克隆抗体及HRP标记的二抗购自Cell Signaling公司;BCA蛋白浓度测定试剂盒购自碧云天生物技术公司。
1.3引物设计及合成利用GenBank检索人PPARγ mRNA系列(GenBank Accession:NM_138712),根据siRNA设计原则,通过Ambion公司在线设计软件辅助设计,使用Blast将选定的序列进行同源性分析,最后选出3条片段作为PPARγ基因干扰片段,设计shRNA模板中的 loop结构选用了TTCAAGAGA以避免形成终止信号,shRNA的转录终止序列采用TTTTTT结构。正义链模板的5'端添加了CACC与BbsⅠ酶切后形成的黏端互补;反义链模板的5'端添加了GATC与BamHⅠ酶切后形成的黏端互补;如果siRNA的第1个碱基不是G,则在CACC后补加个G。将合成的发夹结构寡核苷酸单链用无核酶水稀释为浓度0.46 mmol·L-1。按照以下体系退火得到shRNA模板:1 μl正义链、1 μl反义链、48 μl TE(pH 8.0)共50 μl在PCR仪上按照如下程序进行退火处理:90 ℃ 4 min,80 ℃ 4 min,75 ℃ 4 min,70 ℃ 10 min,37℃ 20 min,10℃ 40 min,4℃保存。将退火后产物稀释20倍,终浓度为 0.92 μmol·L-1用于连接反应。
1.4酶切和连接反应pGPU6/GFP/Neo载体按如下反应体系进行双酶切:10 × NEB buffer 2 μl、100 × BSA 0.2 μl、pGPU6/GFP/Neo 1 μg、Bbs Ⅰ 0.8 μl、Bam HⅠ 0.5 μl、加无核酶水至20 μl,37℃酶切3 h。1%TAE琼脂糖凝胶电泳,使用凝胶回收试剂盒回收。将退火片段与经双酶切后的载体按摩尔比4∶1进行连接反应,置16℃连接16 h。
1.5重组质粒的转化、筛选和鉴定将连接产物接种于Top10感受态细胞进行转化,涂布到3 ml含Kanamycin(终浓度为4.62 μmol·L-1)的LB固体培养基平板上,37℃恒温箱培养过夜,各挑取2个菌落,接种到含4.62 μmol·L-1Kanamycin的LB液体培养基中摇菌过夜。用质粒小提试剂盒抽提质粒,所得质粒用PstⅠ和BamHⅠ分别酶切鉴定。得到的重组质粒分别命名pGPU6/GFP/Neo-shRNAPPARγ1,2,3。将初步鉴定证实的细菌扩增培养,取1 ml菌液送天根生化科技(北京)有限公司进行测序鉴定,测序引物为T7,测序方向为正向测序。
1.6重组质粒转染HUVECs取处于对数生长期的HUVECs,用胰酶消化后使用含血清和不含抗生素的正常培养基重悬为2×108~8×108个·L-1后,接种至6孔培养板上,待细胞生长至70% ~80%汇合时进行转染。LipofectamineTM2000试剂和质粒比例为 10 μl∶4 μg,按照转染试剂说明书进行转染,6 h后换成高糖培养基(33 mmol·L-1)。转染24 h时后荧光显微镜下观察HUVECs绿色荧光的表达情况,观察质粒的转染效率。实验分为空白对照组(Control组)、高糖组(IR组)、空质粒转染组(IR+Non-silencing shRNA组)和重组质粒转染组(IR+shRNAPPARγ 1,2,3 组),每组重复3次。
1.7Western blot检测PPARγ基因的蛋白表达转染48 h后提取HUVECs总蛋白,BCA试剂盒检测蛋白浓度。上样量为40μg,经SDS-PAGE电泳后,PVDF膜印迹,室温10%脱脂牛奶封闭2 h,加入PPARγ一抗(1∶500)孵育过夜,辣根过氧化物酶HRP标记的二抗孵育2 h,ECL化学发光显色,X线片显影、定影。ImageTool图像分析软件测定各条带灰度值,以β-actin为内参照进行数据分析,计算抑制率,抑制率/%=(对照组-干扰组)/对照组×100%。
1.8统计学分析采用SPSS16.0统计分析软件对实验数据进行单因素方差分析,实验数据比较采用t检验,所得数值以±s表示。
2 结果
2.1引物设计及合成根据siRNA设计原则,通过Ambion公司在线设计软件辅助设计3条片段作为PPARγ基因干扰片段(Tab 1),由宝生物工程(大连)有限公司合成。

Tab 1 Design there shRNA sequence for the synthesis of PPARγ gene
2.2重组质粒酶切鉴定用PstⅠ和BamHI分别酶切重组载体,质粒pGPU6/GFP/Neo的BamHⅠ和BbsⅠ酶切位点之间是PstⅠ的酶切位点;插入目的基因干扰片段之后,PstⅠ酶切位点被取代,故不能被PstⅠ所酶切,但可被BamHⅠ酶切开,条带在5 100 bp左右(Fig 1)。

Fig 1 Restriction enzyme analysis of recombinant plasmid pGPU6/GFP/Neo
2.3重组质粒测序鉴定将筛选克隆送天根生化科技(北京)有限公司测序,结果显示重组质粒测序鉴定shRNA编码序列与设计的片段完全一致,表明载体构建成功(Fig 2)。
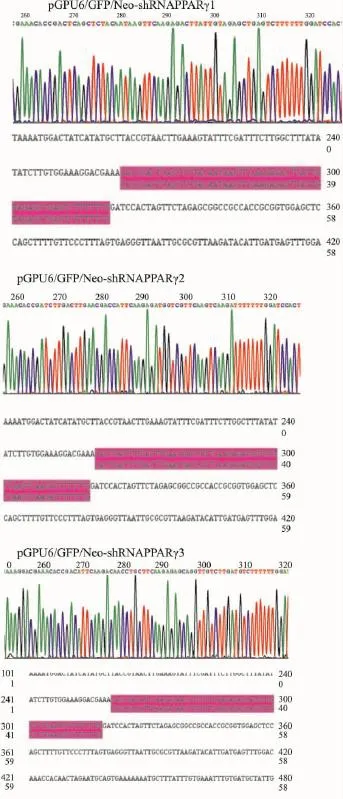
Fig 2 The sequencing result of recombinant plasmid of pGPU6/GFP/Neo-PPARγ-1,2,3
2.4重组质粒的转染效率因为干扰质粒带有EGFP片段,进入细胞后可以产生能被激发出绿色荧光的蛋白,所以可以据此判断转染效率。转染效率/%=发出绿色荧光的细胞个数/明场中总细胞个数×100%,转染效率为45%(Fig 3)。
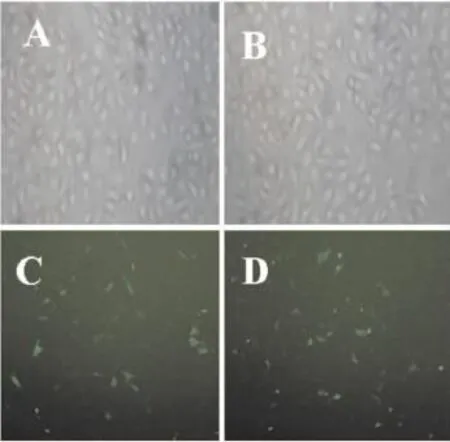
Fig 3 Fluorescence microscope restructuring recombinant plasmid transfected HUVECs(×100)
2.5重组质粒中PPARγ蛋白的表达Western blot检测结果显示(Fig 4),IR组与Control组相比差异具有显著性(P<0.01);IR组和Non-silencing shRNA组间相比无差异(P>0.05);shRNAPPARγ1和shRNAPPARγ2组与IR组相比无差异(P>0.05),无干扰效应;shRNAPPARγ3组与IR组相比差异有显著性(P<0.05),说明转入 PPARγshRNAPPARγ3后,抑制了PPARγ基因的表达,使PPARγ蛋白在高糖诱导下转录生成减少。
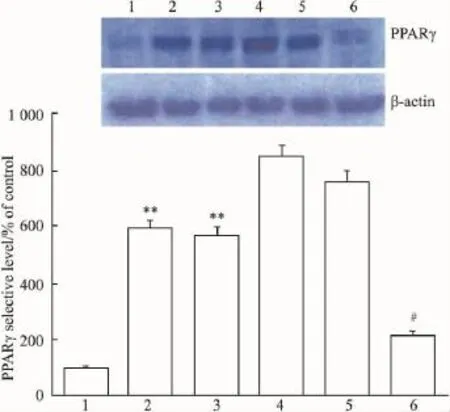
Fig 4 Western blot control to detect the expression of PPARγ protein
3 讨论
过氧化物酶体增殖物激活受体(PPARγ)是类固醇/甲状腺素核受体超家族成员之一,与NF-κB及活化剂蛋白-1(AP-1)等因子关系密切[6-7]。PPARγ可在体内体外调节基因转录和细胞分化,在脂肪形成、糖脂代谢及免疫系统中发挥重要作用,并且与糖尿病、肥胖、高血压、癌症等的发生发展有关,但是在血管内皮细胞中PPARγ对胰岛素抵抗的作用机制还未完全阐明。
胰岛素抵抗是指胰岛素的靶器官对生理浓度的胰岛素反应减弱,是2型糖尿病的重要发病因素。胰岛素抵抗是代谢综合征的中心环节,PPARγ对糖代谢的调节主要是增加外周组织对胰岛素的敏感性,从而改善胰岛素抵抗[8]。有研究表明[9],PPARγ功能受损会导致严重的胰岛素抵抗,而合成的PPARγ激动剂噻唑烷二酮类药物包括曲格列酮(troglitazone)、罗格列酮、吡格列酮可以有效改善2型糖尿病患者的胰岛素敏感性并降低血糖。PPARγ增加胰岛素敏感性的机制可能是:磷脂酰肌醇3激酶(PI3K)是靶细胞介导葡萄糖进入细胞内的关键性激酶,PPARγ在PI3K信号通路中可以促进PI3K基因表达,增强胰岛素的敏感性,还可增强葡萄糖转运体4(GluT4)基因表达,促进对葡萄糖的摄取[10];PPARγ活化可以加速甘油三酯在外周组织的分解和抑制转录因子Pax6的活性,抑制胰高血糖素的生成和表达,改善胰岛素抵抗[11]。
RNAi技术具有快速、高效、便于操作等优点,被广泛应用到基因功能研究、基因表达调控机制研究等热门领域[12]。本实验应用RNAi技术,成功构建了PPARγ低表达质粒,并成功筛选出了沉默效果最好的重组表达载体。为进一步研究PPARγ低表达对高糖诱导胰岛素抵抗及其敏感性的作用及机制奠定了基础。
[1]Holness M J,Samsuddin S,Sugden M C.The role of PPARs in modulating cardiac metabolism in diabetes[J].Pharmacol Res,2009,60(3):185 -94.
[2]Zieleniak A,Wójcik M,Woniak L A.Structure and physiological functions of the human peroxisome proliferator-aetivated receptor gamma[J].Arch Immunol Ther Exp,2008,56:331 -45.
[3]Braissant O,Foufelle F,Scotto C,et al.Differential expression of peroxisome proliferator-activated receptors(PPARs):tissue distribution of PPAR-alpha,-beta,and-gamma in the adult rat[J].Endocrinology,1996,137(1):354 -66.
[4]Auwerx J,Yamamoto H,Williams E G.NCoR1 is a conserved physiological modulator of muscle mass and oxidative function[J].Cell,2011,147(4),827 -39.
[5]Olefsky J M,Li P P,Nalbandian S.Adipocyte NCoR knockout decreases PPAR phosphorylation and enhances PPAR activity and insulin sensitivity[J].Cell,2011,147(4),815 -26.
[6]马悦颖,刘建勋.AS炎性信号通路与中医药干预[J].中国药理学通报,2011,27(6):745 -7.
[6]Ma Y Y,Liu J S.Progression on inflammatory signaling pathway of atherosclerosis and the intervention of TCM[J].Chin Pharmacol Bull,2011,27(6):745 - 7.
[7]Genini D,Carbone G M,Catapano C V.Multiple interactions between peroxisome proliferators-activated receptors and the ubiquitin-proteasome system and implications for cancer pathogenesis[J].PPAR Res,2008,2008:195065.
[8]环 奕,申竹芳.选择性PPARγ调节剂治疗糖尿病的研究新进展[J].中国药理学通报,2008,24(2):149 -52.
[8]Huan Y,Shen Z F.The update research on selective PPARγ modulator in anti-diabetic treatment[J].Chin Pharmacol Bull,2008,24(2):149-52.
[9]Deng T,Shan S,Li P P,et al.Peroxisome proliferator-activated receptor gamma transcriptionally up-regulates hormone-sensitive lipase via the involvement of specificity protein-1[J].Endocrinology,2006,147(2):875 -84.
[10]Anandharajan R,Pathmanathan K,Shankernarayanan N P,et al.Upregulation of Glut-4 and PPAR gamma by an isoflavone from pterocarpus marsupium on L6 myotubes:a possible mechanism of action[J].J Ethnopharmacol,2005,97(2):253 -60.
[11]Kurosaki E,Nakano R,Shimaya A,et al.Differential effects of YM440 a hypoglyc-emic agent on binding to a peroxisome proliferator-activated receptor gamma and its transactivation[J].Biochem Pharmacol,2003,65(5):795 -80.
[12]Kim D,Rossi J.RNAi mechanisms and applications[J].Biotechniques,2008,44:613 -6.

