促红细胞生成素变异体与脊髓损伤的相关性
顾 兵,王烁宇,李华南,王 俊,金建波
(1.江西科技师范大学生命科学学院,江西南昌 330013;2.江西中医学院附属医院,江西南昌 330006)
脊髓损伤(spinal cord injury,SCI)的发病机制比较复杂,一般分为原发性损伤和继发性损伤。前者是指脊髓直接的机械损伤,一旦发生便无法控制。具体表现有撞击后持续性压迫、撞击后短暂性压迫、牵张损伤和裂伤(或横断伤)4种形态学类型[1]。直接的损伤包括创伤即刻造成的神经元大量死亡,传导束断裂以及血-脊髓屏障破坏所引起的脊髓内环境失衡等,继而引起兴奋性毒性反应、自由基形成、微循环障碍、炎症反应和细胞凋亡等一系列继发性损害。目前SCI的治疗药物研究主要集中于糖皮质激素、神经节苷脂、米诺环素、Cethrin(一种Rho GTPase的抑制剂)、利鲁唑(钠离子通道抑制剂,又是谷氨酸盐拮抗剂)以及神经营养因子等一些神经保护剂[2],它们通过阻断髓鞘抑制因子、抗凋亡、阻断离子通道等途径而起到神经保护作用[3-4]。甲基强的松龙是唯一被美国FDA批准的标准药物,作为常规药物用于治疗SCI始于上世纪90年代。然而,在使用的过程中常出现诸多不良反应和并发症,单独使用尚不能使已损伤的脊髓结构重建和神经功能恢复。神经节苷脂虽然可提高患者膀胱和肠道功能[5],但患者的生活质量或神经功能没有从根本上得到改善,使得在临床SCI治疗中受到极大限制。
最近的临床试验结果提示在各种神经损伤的治疗中,促红细胞生成素(erythropoietin,EPO)可能是一种很有前途的神经保护剂,其具有抗凋亡、调制神经炎性反应、减轻水肿、促进神经元和少突胶质细胞存活,以及恢复血管完整性的功能(Fig 1)[6]。但是,长期或反复静注EPO容易诱发红细胞增多症、高血压以及血栓形成等多种血源性不良反应,甚至还会使机体产生中和性抗体,导致纯红细胞再生障碍性贫血[7]。这种剂量相关性毒副作用,严重的妨碍EPO作为SCI标准药物的FDA认证。从这个意义上讲,合成和开发具有内源活性、能透过血脑屏障的EPO变异体具有潜在的实际应用价值。根据已有的文献报道,EPO变异体通常有衍生物、类似物和模拟肽3种形式[8]。本文拟从EPO变异体与SCI相关性的角度,根据神经保护机制的不同分别进行综述,旨在为进一步开发新型EPO制剂提供科学依据。
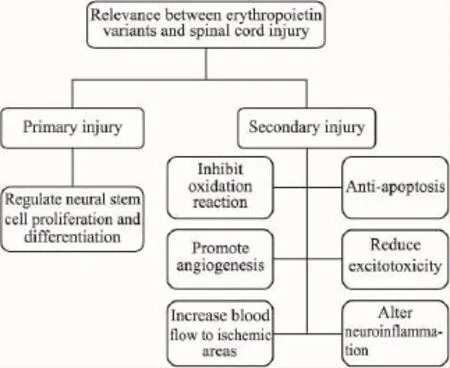
Fig 1 Schematic of the relevance between erythropoietin variants and spinal cord injury
1 调节神经干细胞的增殖与分化,促进神经再生
针对原发性损伤,EPO能长期直接作用于神经干细胞,促进受损处神经再生。在实验性自身免疫脑脊髓炎模型的研究中,rhEPO能够通过增强少突胶质细胞增殖和髓鞘的形成,促进神经功能恢复。但是,由于EPO结构中富含糖基化,使肽链的稳定性增强,导致血液中的清除速率相对较慢。去唾液酸EPO(asialoEPO)作为一种去糖基化的EPO衍生物,可减少半衰期和阻止红细胞慢性增生等不良反应。Erbayraktar等在大鼠SCI模型上证实,asialoEPO在体内可以生成一种半衰期很短,且有神经保护作用的生成物。Grasso等[9]也报道asialoEPO在体内的生成物,除了能明显改善SCI大鼠的运动功能,还可将血浆半衰期从5~6 h缩短到不足2 min。
2 抑制神经细胞的凋亡
损伤后出现大量神经细胞的死亡不只是缘于直接损伤,还有继发性损伤所致的细胞凋亡。通过对EPO抗凋亡机制的研究发现,EPO首先与EPOR结合生成二聚体激活JAK2磷酰化STAT-5,并活化PI3-K和NF-κB。活化的PI3-K则通过PIP3磷酸化使蛋白激酶B(AKT)激活,最终激活抗凋亡基因bcl-xL。PIP3通过AKT使BAD磷酸化而灭活,抑制了半胱天冬酶-1、3、9的激活而起到抗凋亡的作用。同时,活化的NF-κB从胞质入核直接与DNA作用,调节凋亡抑制基因的表达,从而整体上减少神经元的凋亡,促进神经元的发生。此外,磷酸化的STAT-5入核又可与DNA结合,促进抑制凋亡基因bcl-xL和bcl-2转录,Arishima等[10]报道 EPO能够明显降低神经元凋亡和caspase-3免疫反应细胞浸润数量。Knabe等也在压碎性的脊柱神经根损伤模型中发现,EPO能够抑制背根神经节神经元的凋亡。
作为一种经过改造的EPO衍生物,氨甲基酰化EPO(carbamylated EPO,CEPO)长期大剂量使用不会引发血源性不良反应。它是由EPOR与一个βcR亚基通过异源二聚体介导发挥其神经保护作用,而不与造血细胞表面的受体结合。Leist等在SCI模型上证实,CEPO治疗具有十分广泛的治疗时间窗,长期高剂量使用CEPO能够明显改善神经功能。King等[11]也报道CEPO治疗大鼠SCI,可以减小病灶区域的面积和神经细胞的凋亡。另外,Lapchak等[12]报道通过对小鼠颈部脊髓摇摆的治疗,CEPO明显减少运动神经元的损失,从而促进运动功能恢复。
3 减轻兴奋性氨基酸介导的细胞毒性
目前研究认为,在继发性损伤中兴奋性氨基酸(EAA)具有明显的神经毒性作用。其作用机制主要有两个方面:一方面,EAA大量释放导致神经细胞的通透性改变,Na+、H2O内流致细胞毒性;另一方面,EAA的过度释放可介导Ca2+大量内流,胞内Ca2+升高激活各种组织酶类,导致DNA、蛋白质和磷脂降解,生成具高度反应活性的氧自由基,破坏生物膜加重SCI。同时,EPO不仅能抑制谷氨酸、NMDA、红藻氨酸等兴奋性氨基酸介导的细胞毒性损伤,而且还能减少缺氧时谷氨酸的大量释放。Yoo等[13]在体外培养脊髓神经元的研究中发现,EPO能够保护神经元免受兴奋毒性导致的神经突生长抑制EPOR表达明显减少,进而减少了继发性脊髓神经元损伤。Nagańska等[14]建立大鼠脊髓兴奋性谷氨酸模型,EPO处理和加入谷氨酸受体阻断剂都能够抑制神经细胞坏死。另外,Brines等报道CEPO不仅可以阻止红细胞增生,而且能抑制谷氨酸介导的细胞毒性。不仅如此,Pankratova等[15]还报道通过模拟rhEPO的C-螺旋区域氨基酸残基(92-111),设计并合成了一种名为Epotris的无造血活性的短肽。其不仅能促进小脑颗粒细胞轴突生长和减轻低钾诱导的细胞毒性,而且能降低红藻氨酸诱导的神经毒性致小鼠死亡率。
4 调制继发性神经炎症反应
EPO及其衍生物调制神经组织炎症反应的机制主要是通过抑制促炎性因子TNF-α、IL-6及IL-8表达,增强抗炎性因子IL-10的表达以及调控以NF-κB族为主的炎症基因表达,增强其抗炎作用。在体外试验中,Yuan等[16]通过自身免疫性脑脊髓炎组织培养发现,EPO能够抑制免疫反应特有的T细胞增殖以及T细胞生产的炎症性细胞因子。Okutan等通过大鼠急性SCI模型证实,rhEPO治疗其能明显降低caspase-3和过氧化物酶的表达水平。另外Ning等[17]建立大鼠亚急性压迫性颈椎SCI模型,rhEPO治疗能够增强脊髓运动功能。通过ELISA法检测发现可以降低IL-8、TNF-α、IL-6的水平,减少炎症反应的发生。Mennini等[18]也报道在小鼠脊髓侧索硬化症模型中,CEPO治疗可以降低运动神经元损失,减少星形胶质细胞和小胶质细胞的激活。
5 抑制氧化反应
脊髓组织膜结构中含有丰富的脂质,损伤以后细胞线粒体氧化还原酶会发生脱偶联反应,并不断产生大量氧自由基,进而攻击细胞膜上不饱和脂肪酸,诱发过氧化反应导致膜结构的破坏,致使细胞死亡。EPO及其衍生物能够降低脂质过氧化,抑制氧自由基的产生,增加抗氧化酶的表达。脂质过氧化产物的增多会引发继发性SCI。Kaptanoglu等报道EPO抑制脂质过氧化反应和对超微结构的神经保护作用均强于甲强龙。另外,Fu等[19]在硬膜外压迫与脑血管夹闭的大鼠模型上证实,EPO治疗可以明显降低脂质过氧化产物水平,减弱大鼠脊髓氧化性损伤。Yazihan等[20]用EPO治疗大鼠SCI,1 h后大鼠体内抗氧化酵素和过氧化氢酶活性增加,同时脂质过氧化产物水平降低。
6 对血管内皮细胞的作用,促进新血管生成
EPO及其衍生物不仅能够通过结合血管内皮细胞上的EPO受体,调节血管内皮细胞的迁移和增生,从而刺激新血管的生成,而且能够增加缺血区域的血流量,减轻缺氧引起的血管内皮损伤。EPO还可通过上调NO合酶的表达,舒张血管改善组织供血。Grasso等[21]报道在EPO治疗大鼠SCI研究中,损伤区域神经元和血管内皮细胞EPO受体表达明显增加。Ramirez等[22]报道CEPO既不能刺激内皮祖细胞的增殖,又不增加红细胞生成。
7 促进微循环,增加缺血区血流量
SCI以后会导致体内多个器官的缺血,而缺血/再灌注也可导致中性粒细胞释放过多,进而浸润损伤区组织,加剧继发性损伤。Cetin等[23]发现rhEPO能够明显减少急性SCI引起的局部缺血组织的损伤。Sönmez等[24]报道大鼠缺血/再灌注损伤之后,EPO治疗能够明显增加脊髓前角运动神经元磷酸化cAMP反应元件结合蛋白的表达。Simon等[25]在主动脉栓塞导致猪脊髓缺血/再灌注损伤,EPO治疗可减轻神经损伤和细胞凋亡。之后,Simon等又在猪主动脉栓塞4h后的脊髓缺血/再灌注损伤模型上证实,采用CEPO-FC融合蛋白治疗能够防止功能障碍和神经损伤,并且没有血源性不良反应,具有更好的发展前景。
总而言之,EPO变异体通过减少半衰期、与受体上的不同位点结合、模拟活性中心等一系列修饰方法,不仅保留了原有的神经组织保护功能,而且消除了EPO治疗带来的血源性不良反应。故EPO变异体的开发日益受到神经药物学家的广泛重视。然而,脊髓继发性损伤是多种因素的交互作用,机制错综复杂,发挥神经保护效应的信号转导通路也受其它多种因子或受体因素的调控。因此,深入细致地探讨EPO变异体与SCI的相关性,将会为临床治疗发现新的药物靶标。
[1]Oyinbo C A.Secondary injury mechanisms in traumatic spinal cord injury:a nugget of this multiply cascade[J].Acta Neurobiol Exp(Wars),2011,71(2):281-99.
[2]Cadotte D W,Fehlings M G.Spinal cord injury:a systematic review of current treatment options[J].Clin Orthop Relat Res,2011,469(3):732-41.
[3]Rabchevsky A G,Patel S P,Springer J E.Pharmacological interventions for spinal cord injury:where do we stand?How might we step forward[J]?Pharmacol Ther,2011,132(1):15-29.
[4]Tohda C,Kuboyama T.Current and future therapeutic strategies for functional repair of spinal cord injury[J].Pharmacol Ther,2011,132(1):57-71.
[5]Hyun J K,Kim H W.Clinical and experimental advances in regeneration of spinal cord injury[J].J Tissue Eng,2010:650857.
[6]Carelli S,Marfia G,Di Giulio A M,et al.Erythropoietin:recent developments in the treatment of spinal cord injury[J].Neurol Res Int,2011:453179.
[7]Sirén A L,Fasshauer T,Bartels C,et al.Therapeutic potential of erythropoietin and its structural or functional variants in the nervous system[J].Neurotherapeutics,2009,6(1):108-27.
[8]Mofidi A,Bader A,Pavlica S.The use of erythropoietin and its derivatives to treat spinal cord injury[J].Mini Rev Med Chem,2011,11(9):763-70.
[9]Grasso G,Sfacteria A,Erbayraktar S,et al.Amelioration of spinal cord compressive injury by pharmacological preconditioning with erythropoietin and a nonerythropoietic erythropoietin derivative[J].J Neurosurg Spine,2006,4(4):310-8.
[10]Arishima Y,Setoguchi T,Yamaura I,et al.Preventive effect of erythropoietin on spinal cord cell apoptosis following acute traumatic injury in rats[J].Spine(Phila Pa1976),2006,31(21):2432-8.
[11]King V R,Averill S A,Hewazy D,et al.Erythropoietin and carbamylated erythropoietin are neuroprotective following spinal cord hemisection in the rat[J].Eur J Neurosci,2007,26(1):90-100.
[12]Lapchak P A.Carbamylated erythropoietin to treat neuronal injury:new development strategies[J].Expert Opin Investig Drugs,2008,17(8):1175-86.
[13]Yoo J Y,Won Y J,Lee J H,et al.Neuroprotective effects of erythropoietin posttreatment against kainate-induced excitotoxicity in mixed spinal cultures[J].J Neurosci Res,2009,87(1):150-63.
[14]Nagańska E,Taraszewska A,Matyja E,et al.Neuroprotective effect of erythropoietin in amyotrophic lateral sclerosis(ALS)modelin vitroultrastructural study[J].Folia Neuropathol,2010,48(1):35-44.
[15]Pankratova S,Kiryushko D,Sonn K,et al.Neuroprotective properties of a novel,non-haematopoietic agonist of the erythropoietin receptor[J].Brain,2010,133(Pt 8):2281-94.
[16]Yuan R,Maeda Y,Li W,et al.Erythropoietin:a potent inducer of peripheral immuno/inflammatory modulation in autoimmune EAE[J].PLoS One,2008,3(4):e1924.
[17]Ning B,Zhang A,Song H,et al.Recombinant human erythropoietin prevents motor neuron apoptosis in a rat model of cervical subacute spinal cord compression[J].Neurosci Lett,2011,490(1):57-62.
[18]Mennini T,De Paola M,Bigini P,et al.Nonhematopoietic erythropoietin derivatives prevent motoneuron degeneration in vitro andin vivo[J].Mol Med,2006,12(7-8):153-60.
[19]Fu E S,Tummala R P.Neuroprotection in brain and spinal cord trauma[J].Curr Opin Anaesthesiol,2005,18(2):181-7.
[20]Yazihan N,Uzuner K,Salman B,et al.Erythropoietin improves oxidative stress following spinal cord trauma in rats[J].Injury,2008,39(12):1408-13.
[21]Grasso G,Buemi M,Alafaci C,et al.Beneficial effects of systemic administration of recombinant human erythropoietin in rabbits subjected to subarachnoid hemorrhage[J].Proc Natl Acad Sci USA,2002,99(8):5627-31.
[22]Ramirez R,Carracedo J,Nogueras S,et al.Carbamylated darbepoetin derivative prevents endothelial progenitor cell damage with no effect on angiogenesis[J].J Mol Cell Cardiol,2009,47(6):781-8.
[23]Cetib A,Nas K,Büyükbayram H,et al.The effects of systemically administered methylprednisolone and recombinant human erythropoietin after acute spinal cord compressive injury in rats[J].Eur Spine J,2006,15(10)1539-44.
[24]Sönmez A,Kabakçi B,Vardar E,et al.Erythropoietin attenuates neuronal injury and potentiates the expression of pCREB in anterior horn after transient spinal cord ischemia in rats[J].Surg Neurol,2007,68(3):297-303.
[25]Simon F,Scheuerle A,Gröger M,et al.Comparison of carbamylated erythropoietin-FC fusion protein and recombinant human erythropoietin during porcine aortic balloon occlusion-induced spinal cord ischemia/reperfusion injury[J].Intensive Care Med,2011,37(9):1525-33.

