高等动植物网格蛋白介导的内吞
王 超,潘建伟
(浙江师范大学化学与生命科学学院,浙江金华 321004)
内吞作用(endocytosis)又称入胞作用,是通过质膜的变形运动将细胞外物质转运至胞内的过程.内吞作用之所以让很多生物学家沉迷了大半个世纪,是因为其具有多种重要的生物学功能,包括抗原呈递、养分摄取、凋亡细胞清除、病原体入侵、质膜蛋白(如受体蛋白和运输蛋白)的水平调控、胞内外信号传导等等[1-2].
根据所转运的物质大小和转运机制的不同,可将内吞作用大致分为五大类[3]:1)吞噬作用(phagocytosis):主要吸收大颗粒物质;2)大胞饮作用(macropinocytosis):主要吸收液相物质;3)网格蛋白介导的内吞(clathrin-mediated endocytosis,CME):吸收一些小分子物质或病原体,或调控质膜蛋白水平,需要动力蛋白(dynamin)的参与;4)小窝蛋白介导的内吞(caveolin-mediated endocytosis):功能与3)相似,也需要动力蛋白的参与;5)不依赖于动力蛋白的内吞(dynamin-independent endocytosis):这类内吞的功能与3)和4)相似,但机理仍不清楚.关于动植物内吞的研究结果表明,网格蛋白介导的内吞是受体介导内吞的主要方式之一,在质膜蛋白内吞及胞内外信号传导过程中起着重要的调控作用[4-5].因此,该途径成为动植物分子细胞生物学的研究热点之一.本文着重介绍了最近几年动植物中网格蛋白介导的内吞途径的一些新进展.
1 网格蛋白复合体的组成及其功能
自从1976年网格蛋白首次在动物细胞中发现[4]后,至今,网格蛋白在动物细胞和酵母中已得到很好的鉴定.已知动物中有一个网格蛋白重链基因(clathrin heavy chain,CHC)和2个轻链基因(clathrin light chains,CLCs),而酵母中编码CHC和CLC的基因均为单拷贝基因[6].网格蛋白是由3条重链和3条轻链组成的三脚架结构,轻链与重链的C端相互结合.重链是三脚架结构的主要骨架,轻链则用于调节网格蛋白笼型结构的组装和拆解.重链长约47.5 nm,厚约2 nm,由1 670多个氨基酸组成,可分为6个部分:N端区域、脚踝区、远端腿、膝、近端腿、三聚作用区域(又叫做hub),N端区域由包括7个两叶状的β螺旋构成,其他部分是由多个串联的α螺旋构成.轻链与重链的近端腿相互结合,多个三脚架结构相互结合形成六边形或五边形的网格,多个网格组成一个笼型结构.网格蛋白(clathrin)因此得名.在细胞内,3条轻链 CLCs分别与3条重链CHCs的HUB区形成一个三脚架的复合体,再与质膜内吞起始位点结合,共由36或60个三脚架复合体形成一个由12个五边形和若干个六边形组成的笼形结构[7],把内陷质膜包裹在笼形结构中,其他辅助蛋白通过网格进入笼形结构中行使各自的生物学功能[6,8].
重链CHC起到一个复合体脚手架的作用,而轻链CLC的作用则是调控复合体的装配与稳定性[4-5].复合体在质膜上形成笼形结构即内吞小窝(pits)后,轻链暴露在小窝外,能与细胞质中的一些辅助因子如钙离子、钙调蛋白、Hsp70(uncoating ATPase)等接触进一步调控小窝的生物学功能[9-10].轻链在体内外均能被磷酸化.离体实验表明,轻链能够阻止网格蛋白重链的自由装配[11].暗示轻链具有多种网格蛋白复合体的调控作用.
网格蛋白复合体在细胞内外物质转运中起到关键性调控作用.网格蛋白包被的小窝(clathrincoated pits,CCPs)在质膜、反式高尔基体网络TGN(trans-Golgi network)、内体(endosome)等细胞器之间的货物转运具有货物选择性作用.包裹货物和部分质膜的小窝通过质膜内陷从细胞膜上脱离后进入细胞质,形成网格蛋白包被小泡(clathrin-coated vesicles,CCVs).小泡上的包被迅速脱离,使得网格蛋白复合体重新回到质膜上,同时,包裹货物的小泡与内体融合将货物转运到内体中,内体通过不同的转运途径将货物运输到不同的目的地.
网格蛋白除了介导膜蛋白等货物进行内吞外,还具有多种生物学功能,如生长因子和受体的内吞、病原体的入侵、突出的传递等[12].最近的研究表明,在有丝分裂过程中,网格蛋白可与纺锤体结合,提高纺锤体的稳定性,以促进染色体的联会.另外,网格蛋白可与微管或者微管相关蛋白直接结合来稳定着丝粒[13].在细胞有丝分裂过程中,网格蛋白包被的小泡连续形成,暗示着有丝分裂马上要结束[13].这些研究表明,网格蛋白参与多种细胞生物学过程,对细胞生长发育、分化和环境响应具有重要的生物学功能[14].
2 接头蛋白复合体的组成及其功能
在网格蛋白介导的内吞过程中,接头蛋白(adaptor proteins,APs)主要负责货物蛋白的分拣(cargo protein sorting),网格蛋白的招募(recruitment)、装配和拆卸,以及辅助蛋白的招募等[15].接头蛋白与质膜受体蛋白等货物蛋白结合后,接头蛋白才可招募网格蛋白和一些辅助蛋白因子.
目前已知有2类接头蛋白分子[16-17].第一类是最早发现的经典接头蛋白,主要有4种:AP1,AP2,AP3和AP4,均为4个亚基组成的异源四聚体.AP1复合体主要作用于TGN的货物分拣;AP2复合体作用于质膜货物分拣;AP3复合体可能作用于高尔基体至溶酶体之间的运输过程中的货物分拣;AP4复合体,可能与TGN有关,目前机理尚不清楚[18-19].目前,对AP2的研究相对较为深入,它主要作用于网格蛋白介导膜内吞与货物分拣.AP2复合体由2个大亚基α和β2,1个中亚基μ2和1个小亚基σ2组成.这个复合体可以分为3个区域:C端是一个大亚基粘合在质膜上的关键区域,N端是小亚基和中亚基构成的核心区域及α和β2的铰链.AP2大亚基α与质膜上的磷脂酰肌醇二磷酸(phosphatidylinositol(4,5)-bisphosphate,PtdIns(4,5)P2/PIP2)或磷脂酰肌醇三磷酸(PtdIns(3,4,5)P3/PIP3)相结合[20].大亚基 β2通过自身含有的网格蛋白结合序列LФxФD/E基序(motif)招募网格蛋白,此基序横跨β2亚基的铰链区[17].中亚基μ2位于2个区,其N端1/3位于AP2的核心区域,C端2/3是与货物分拣直接相关的一段YxxФ序列,C端还有一个磷脂酰肌醇二磷酸的结合位点[21].当AP2与质膜的PIP2或PIP3结合后,其构象发生变化,打开μ2亚基的YxxФ序列.有研究表明,这种构象变化需要Ark激酶家族中的AAK1激酶的作用,使得本来μ2-β2相互作用的构象发生磷酸化让YxxФ序列得以打开[20].小亚基 σ2的主要功能是稳定复合体[22-23].
另一类接头蛋白是一类结构非常简单的蛋白因子,它们可以连接货物进入网格蛋白包被的小窝.典型的接头蛋白如:GGAs[24],epsins[25],Hrs和disabled2[26].这类蛋白也能够与其他辅助蛋白结合,共同作用于内吞途径.GGAs是一个选择性的网格蛋白接头蛋白,对这些蛋白因子的作用机制仍需进一步研究.
3 动物细胞网格蛋白介导的内吞
通过一些高技术的电子显微镜,能在形态学上观察到附着在质膜细胞质面的包被.到目前为止,调节包被的形成和质膜货物的选择主要有3类包被复合体:包被蛋白Ⅰ(coat protein-Ⅰ,COP-Ⅰ)、包被蛋白Ⅱ(COP-Ⅱ)和网格蛋白,其中COP-Ⅰ包被与高尔基体和内质网膜有关,COP-Ⅱ包被涉及从内质网到高尔基体的运输[27].而网格蛋白包被参与2个重要的运输过程:1)从质膜内吞到与早期内体(early endosome)融合;2)从反式高尔基网络TGN内吞到与内体融合[15].目前,对哺乳动物网格蛋白介导的内吞过程研究得相对比较清楚,主要包括质膜招募网格蛋白、质膜内陷、包被小窝CCPs的形成、包被小泡CCVs的形成和小泡包被的脱离等过程[1].
3.1 质膜招募
AP2复合体是网格蛋白介导内吞的主要组件,它是质膜蛋白与网格蛋白的连接纽带,AP2的μ2亚基货物分拣识别序列YxxФ基序特异性地选择货物蛋白,同时,大亚基β2通过网格蛋白结合序列LФxФD/E基序招募网格蛋白.在AP2复合体招募网格蛋白过程中,AP180起着重要的作用.它首先通过其保守区域N端区域(ANTH)与质膜上的 PtdIns(4,5)P2 相互作用[28],然后协助AP2招募网格蛋白到质膜表面.AP180的C端具有很强的功能特异性,在网格蛋白招募过程中具有重要的生物学功能[29].
3.2 小窝CCP的形成
在内吞早期,质膜招募网格蛋白除了需要接头蛋白 AP2外,还需要多个辅助蛋白因子如AP180和epsin1等的协同作用,才能准确地招募网格蛋白到质膜上,从而促进质膜向内凹陷形成小窝(CCP).AP180除了具有招募网格蛋白的功能外,还具有促进质膜内陷的功能.有研究表明,在果蝇中,敲除AP180的同源基因后导致小窝CCP数量减少[29].epsin1也是一个促进质膜内陷的重要蛋白因子.有实验证据表明,epsin1和网格蛋白共定位于内陷的质膜中,epsin1先与质膜磷脂酰肌醇二磷酸(PIP2)结合,再与网格蛋白复合体相互作用,促进质膜凹陷[30].epsinR是 epsin1的一个同源蛋白,它的主要功能是促进囊泡从高尔基体TGN区运输到内体上[31].
3.3 小泡CCV的形成
网格蛋白包被的小窝CCP从质膜脱离形成网格蛋白包被的小泡CCV.小窝CCP的形成受2个重要的辅助蛋白因子如两性蛋白(amphiphysin)和动力蛋白(dynamin)的调控[32].两性蛋白结合于小窝茎质膜上,将动力蛋白招募到小窝茎的部位,然后与动力蛋白相互作用,激活质膜切断的过程.动力蛋白是一个大GTP酶蛋白家族,在动植物和酵母中高度保守,其主要作用是调控小窝CCP从质膜上脱离,形成小泡 CCV[33].实验证据表明,动力蛋白在两性蛋白的作用下缠绕内吞小窝的茎部位,然后催化GTP水解导致小窝茎部位的断裂,从而释放小窝 CCP,形成小泡 CCV[34].最近的研究发现,在小泡CCV形成过程中也受另一类小GTP酶如ADP糖基化因子(ADP ribosylation factors,ARFs)及其相关调控因子 GEF(guanine nucleotide exchange factors)和GAPs(GTPase activating proteins)的调控[35].这些研究表明,小泡CCV的形成过程是一个由多种蛋白因子参与的复杂调控过程.
3.4 小泡包被的脱离
在小泡与早期内体融合之前,网格蛋白必须从小泡上脱离.脱离过程需要 hsc70,auxilin和ATP的参与,以及 miRNA[36],其可能的作用机制是破坏网格蛋白与接头蛋白AP2之间的连接,从而释放网格蛋白[37].释放后的网格蛋白通过再循环(recycling)途径被招募到质膜内吞起始位点或进入降解途径.
4 植物细胞网格蛋白介导的内吞
由于植物细胞具有细胞壁和较高的细胞膨压,因此,20世纪80年代曾经针对植物细胞是否存在像动物一样的内吞及其生理学意义开展过激烈的讨论[38].但随后的电子显微镜观察表明,在植物细胞中的确存在内吞现象,并且细胞膨压并没有阻止内吞的发生[39].
在哺乳动物细胞中,酪氨酸磷酸化抑制剂A23通过特异性地抑制货物蛋白YxxØ序列与AP2亚基μ2的相互作用,从而阻止网格蛋白介导内吞的发生[40].最近几年的药理学实验表明,A23也同样有效地抑制植物细胞发生内吞[41].通过免疫电镜观察到网格蛋白介导内吞的发生过程[41].这些结果暗示,在植物细胞中很可能也存在类似于动物细胞网格蛋白介导的内吞机制.生物信息学分析表明,在拟南芥基因组中存在2个网格蛋白重链基因CHCs和3个轻链基因CLCs,以及一些重要的内吞调控基因,如编码AP2复合体亚基,AP180,hsc70,epsin,dynamin 和 amphiphysin等的同源基因[42-43](见表 1).最近的遗传学实验表明:敲除一个CHC基因引起部分胚胎、子叶发育、生长素极性分布不正常;同时敲除2个CHC基因引起胚胎致死[44].这些研究结果表明,网格蛋白介导的内吞在植物生长发育中起着重要的调控作用.
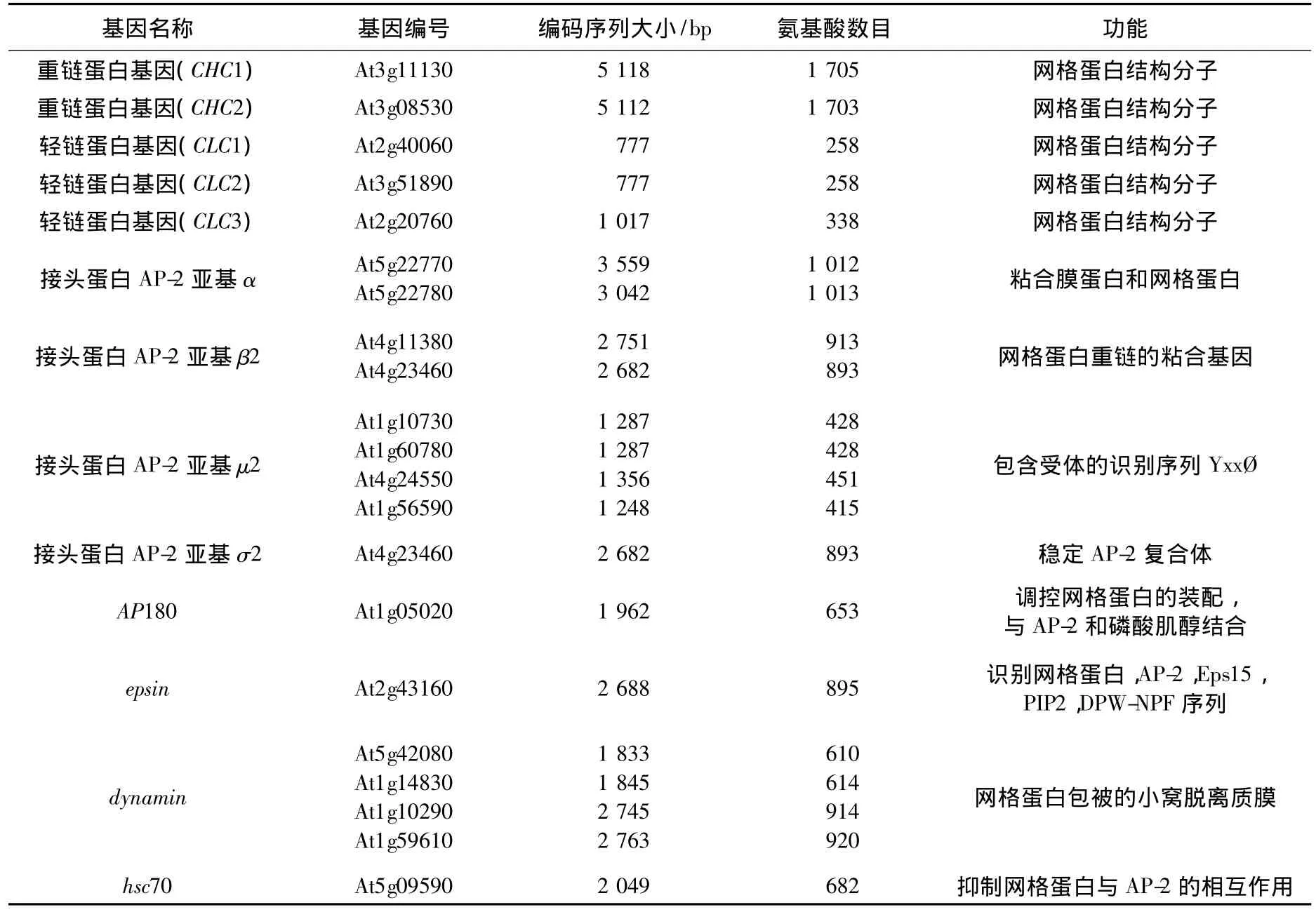
表1 植物网格蛋白、接头蛋白和一些重要的辅助蛋白
至今,有证据表明,植物网格蛋白介导的内吞参与调控细胞极性的建立、细胞分裂、细胞壁的形成、根毛和花粉管等的顶端生长、胚胎发生、配子体发生、防御和抗逆反应等[45],暗示网格蛋白介导的内吞是植物细胞膜蛋白内吞的主要途径,也是植物生长发育在逆境响应过程中呈现可塑性的重要机制之一.植物生长素是调控植物生长发育和逆境响应的重要激素之一,其极性运输方式是其他激素所没有的.生长素输出载体PIN在细胞膜上的极性定位决定了生长素的极性流向和梯度分布[46-47],而生长素的极性流向和梯度分布对植物胚胎和器官的极性发育、向性生长等重要的生命活动过程中起着重要的作用[48-49].外源生长素和A23均可有效地抑制PIN蛋白的内吞[50],暗示外源生长素通过调控网格蛋白的生物学功能来调控PIN蛋白的内吞.这些研究结果表明,网格蛋白介导的内吞在生长素极性运输中具有重要的调控作用.最近的研究表明,生长素受体abp1突变体中生长素不能抑制PIN蛋白的内吞[51],同样说明了生长素调控PIN的内吞是通过调控网格蛋白介导的内吞来实现的.重链T-DNA插入单突变体chc2除15%~20%的幼苗出现不正常的子叶外,其余幼苗均表现为野生型表型;chc1-1chc2-1双突变体引起胚胎致死,从而影响重链CHC活体生物学功能的鉴定.然而,植物网格蛋白轻链的生物学功能至今仍没有被鉴定.
5 结论
已知网格蛋白介导的内吞机制是一个相对保守的内吞机制,在动物中已有广泛、深入的研究,人们对其本身的分子机理已有较深入的了解.尽管已知网格蛋白能够介导细胞内外的信号转导和质膜受体的内吞,但细胞通过什么机制来诱导启动和终止这一重要的生命现象?目前仍不清楚.另外,网格蛋白在细胞药物选择性吸收、肿瘤发生过程中的分子机理仍有待于进一步的研究.
已有大量的实验证据表明,在植物细胞中也同样存在内吞,并且参与调控多个发育过程.近几年来,对植物网格蛋白的研究也取得了较大的进展,但与动物相比,仍相对比较落后.在网格蛋白介导的内吞过程中,对内吞货物的特异性选择机制仍不清楚,许多重要辅助蛋白因子仍没有得到鉴定,植物根系是否通过网格蛋白介导的内吞途径从土壤中吸收营养物质仍需要进一步的遗传与分子证据.这些科学问题很可能成为今后几年植物学研究领域中的新热点.
[1]Doherty G J,McMahon H T.Mechanisms of endocytosis[J].Annu Rev Biochem,2009,78:857-902.
[2]Huang K M,D'Hondt K,Riezman H,et al.Clathrin functions in the absence of heterotetrameric adaptors and AP180-related proteins in yeast[J].EMBO J,1999,18(14):3897-3908.
[3]Wieffer M,Maritzen T,Haucke V.SnapShot:endocytic trafficking[J].Cell,2009,137(2):382.e1-3.
[4]Pearse B M.Clathrin:a unique protein associated with intracellular transfer of membrane by coated vesicles[J].PNAS,1976,73:1255-1259.
[5]Puertollano R.Clathrin-mediated transport:assembly required[J].EMBO Rep,2004,5(10):942-946.
[6]Kirchhausen T.Clathrin[J].Annu Rev Biochem,2000,69:699-727.
[7]Royle S J.The cellular functions of clathrin[J].Cell Mol Life Sci,2006,63(16):1823-1832.
[8]Marcote M,Gu F,Gruenberg J,et al.Membrane transport in the endocytic pathway:animal versus plant cells[J].Protoplasma,2000,210(3):123-132.
[9]DeLuca-Flaherty C,McKay D B,Parham P,et al.Uncoating protein(hsc70)binds a conformationally labile domain of clathrin light chain LCa to stimulate ATP hydrolysis[J].Cell,1990,62(5):875-887.
[10]Nathke I,Hill B L,Parham P,et al.The calcium-binding site of clathrin light chains[J].Biol Chem,1990,265(30):18621-18627.
[11]Hill B L,Drickamer K,Brodsky F M,et al.Identification of the phosphorylation sites of clathrin light chain LCb[J].J Biol Chem,1988,263(12):5499-5501.
[12]Von Kleist L,Stahlschmidt W,Bulut H,et al.Role of the clathrin terminal domain in regulating coated pit dynamics revealed by small molecule inhibition[J].Cell,2011,146(3):471-484.
[13]Royle S J,Bright N A,Lagnado L.Clathrin is required for the function of the mitotic spindle[J].Nature,2005,434(7037):1152-1157.
[14]Royle S J.The role of clathrin in mitotic spindle organization[J].J Cell Sci,2012,125(Pt 1):19-28.
[15]Marsh M,McMahon H T.The structural era of endocytosis[J].Science,1999,285(5425):215-220.
[16]Owen D J,Vallis Y,Noble M E M,et al.A structural explanation for the binding of multiple ligands by the α-adaptin appendage domain[J].Cell,1999,97(6):805-815.
[17]Irani N G,Russinova E.Receptor endocytosis and signaling in plants[J].Curr Opin Plant Biol,2009,12(6):653-659.
[18]Ohno H.Clathrin-associated adaptor protein complexes[J].J Cell Sci,2006,119:3719-3721.
[19]姚鹏程,叶恭银.网格蛋白介导的内吞作用机制[J].生命科学研究,2003,7(2):22-25.
[20]Boucrot E,Saffarian S,Zhang Rongying,et al.Roles of AP-2 in clathrin-mediated endocytosis[J].PLoS ONE,2010,5(5):e10597.
[21]Conner S D,Schmid S L.Identification of an adaptor-associated kinase,AAK1,as a regulator of clathrin-mediated endocytosis[J].J Biol Chem,2002,156(5):921-929.
[22]Praefcke G J K,Ford M G J,Schmid E M,et al.Evolving nature of the AP2 α-appendage hub during clathrin-coated vesicle endocytosis[J].EMBO J,2004,23(22):4371-4383.
[23]Collins B M,McCoy A J,Kent H M,et al.Molecular architecture and functional model of the endocytic AP2 complex[J].Cell,2002,109(4):523-535.
[24]Dell'Angelica E C,Puertollano R,Mullins C,et al.GGAs:a family of ADP ribosylation factor-binding proteins related to adaptors and associated with the Golgi complex[J].J Cell Biol,2000,149(1):81-94.
[25]Horvath C A J,Vanden Broeck D,Boulet G A V,et al.Epsin:inducing membrane curvature[J].Int J Biochem Cell Biol,2007,39(10):1765-1770.
[26]Huang C L,Cheng J C,Stern A,et al.Disabled-2 is a novel α IIb-integrin-binding protein that negatively regulates platelet-fibrinogen interactions and platelet aggregation[J].J Cell Sci,2006,119:4420-4430.
[27]McMahon H T,Mills I G.COP and clathrin-coated vesicle budding:different pathways,common approaches[J].Cur Opin Cell Biol,2004,16(4):379-391.
[28]Zhao Yan,Yan An,Feijó J A,et al.Phosphoinositides regulate clathrin-dependent endocytosis at the tip of pollen tubes in Arabidopsis and tobacco[J].Plant Cell,2010,22(12):4031-4044.
[29]Stahelin R V,Long Fei,Peter B J,et al.Contrasting membrane interaction mechanisms of AP180 N-terminal homology(ANTH)and epsin N-terminal homology(ENTH)domains[J].J Biol Chem,2003,278(31):28993-28999.
[30]Ford M G J,Mills I G,Peter B J,et al.Curvature of clathrin-coated pits driven by epsin[J].Nature,2002,419(6905):361-366.
[31]Saint-Pol A,Yélamos B,Amessou M,et al.Clathrin adaptor epsinR is required for retrograde sorting on early endosomal membranes[J].Dev Cell,2004,6(4):525-538.
[32]Wigge P,McMahon H T.The amphiphysin family of proteins and their role in endocytosis at the synapse[J].Trends in Neurosciences,1998,21(8):339-344.
[33]Uyhazi K,Frost A,De Camilli P.GTP-dependent twisting of dynamin implicates constriction and tension in membrane fission[J].Nature,2006,441(7092):528-531.
[34]Backues S K,Korasick D A,Heese A,et al.The Arabidopsis dynamin-related protein 2 family is essential for gametophyte development[J].Plant Cell,2010,22(10):3218-3231.
[35]Naramoto S,Kleine-Vehn J,Robert S,et al.ADP-ribosylation factor machinery mediates endocytosis in plant cells[J].PNAS,2010,107(50):21890-21895.
[36]Scott H,Howarth J,Lee Y B,et al.Mir-3120 is a mirror microRNA that targets heat shock cognate protein 70 and auxilin and regulatesclathrin vesicle uncoating[J/OL].J Biol Chem,2012-03-05.http://www.jbc.org/content/early/2012/03/05/jbc.M111.326041.abstract.
[37]Xing Yi,Böcking T,Wolf M,et al.Structure of clathrin coat with bound Hsc70 and auxilin:mechanism of Hsc70-facilitated disassembly[J].EMBO J,2010,29(3):655-665.
[38]Cram A E,Tye J B.Emergency medical services in Iowa:an update[J].J Iowa Med Soc,1980,70(7):297-299.
[39]Gradmann D,Robinson D G.Does turgor prevent endocytosis in plant-cells[J].Plant Cell Environ,1989,12(2):151-154.
[40]Banbury D N,Oakley J D,Sessions R B,et al.Tyrphostin A23 inhibits internalization of the transferrin receptor by perturbing the interaction between tyrosine motifs and the medium chain subunit of the AP-2 adaptor complex[J].J Biol Chem,2003,278(14):12022-12028.
[41]Dhonukshe P,Aniento F,Hwang I,et al.Clathrin-mediated constitutive endocytosis of PIN auxin efflux carriers in Arabidopsis[J].Curr Biol,2007,17(6):520-527.
[42]Holstein S E H.Clathrin and plant endocytosis[J].Traffic,2002,3(9):614-620.
[43]Chen Xu,Irani N G,Friml J.Clathrin-mediated endocytosis:the gateway into plant cells[J].Curr Opin Plant Biol,2011,14(6):674-682.
[44]Kitakura S,Vanneste S,Robert S,et al.Clathrin mediates endocytosis and polar distribution of PIN auxin transporters in Arabidopsis[J].Plant Cell,2011,23(5):1920-1931.
[45]McMahon H T,Boucrot E.Molecular mechanism and physiological functions of clathrin-mediated endocytosis[J].Nat Rev Mol Cell Biol,2011,12(8):517-533.
[46]Wisniewska J,Xu Jian,Seifertová D,et al.Polar PIN localization directs auxin flow in plants[J].Science,2006,312(5775):883.
[47]Grieneisen V A,Xu Jian,Marée A F M,et al.Auxin transport is sufficient to generate a maximum and gradient guiding root growth[J].Nature,2007,449(7165):1008-1013.
[48]Friml J,Vieten A,Sauer M,et al.Efflux-dependent auxin gradients establish the apical-basal axis of Arabidopsis[J].Nature,2003,426(6963):147-153.
[49]Blilou I,Xu Jian,Wildwater M,et al.The PIN auxin efflux facilitator network controls growth and patterning in Arabidopsis roots[J].Nature,2005,433:39-44.
[50]Paciorek T,Zazimalova E,Ruthardt N,et al.Auxin inhibits endocytosis and promotes its own efflux from cells[J].Nature,2005,435(7046):1251-1256.
[51]Robert S,Kleine-Vehn J,Barbez E,et al.ABP1 mediates auxin inhibition of clathrin-dependent endocytosis in Arabidopsis[J].Cell,2010,143(1):111-121.

