人参皂苷Re酶转化的F1皂苷等产品的分离提纯
宋 建 国, 肖 永 坤, 王 东 明, 鱼 红 闪, 金 凤 燮
( 1.大连工业大学 轻工与化学工程学院, 辽宁 大连 116034; 2.大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
药材人参为五加科植物人参(PanaxginsengC. A. Meyer)的干燥根和块茎[1],是驰名中外的中药。人参皂苷是人参主要的有效成分,天然存在的人参皂苷往往是大体积的多糖基皂苷,如Rb1、Rb2、Rc、Rd、Re等;而另外一些皂苷,如Rh1、Rh2、F1、C-K等皂苷在野生人参或红参中含量都极低,被称为稀有人参皂苷[2]。研究表明,口服人参以后,主要皂苷在人的消化系统中被转化成稀有皂苷后吸收起药效[3],但这种转化的程度是因人而异的,因此制备稀有皂苷具有重要意义。
本实验室工作人员多年致力于制备稀有人参皂苷[4-6]的研究,并报道了多种人参皂苷糖苷酶,如Ⅰ型人参皂苷糖苷酶[7]、Ⅱ型人参皂苷糖苷酶[8]和Ⅳ型人参皂苷糖苷酶[9]等。其中,Ⅳ型人参皂苷酶能水解原人参三醇类皂苷(protopanaxatriol ginsenoside)6-O-上的多种糖基,例如,人参皂苷Re上的6-O-鼠李糖基、R1上的6-O-木糖基、Rg2上的6-O-鼠李糖基和Rf上的6-O-葡萄糖基。
稀有人参皂苷F1在天然人参根中几乎不存在,仅少量存在于人参茎叶中[2],但它却是Re等三醇类皂苷在人体内的代谢产物,即起药效的物质[10-11]。F1属于PPT型人参皂苷,与Re、Rg1具有相同的母环结构,它们在20-O-上都有一个葡萄糖基,仅在6-O-上的糖基不同,Re比Rg1多一个鼠李糖,Rg1比F1多一个葡萄糖,因此,可利用它们结构上的关系,采用酶转化法,对低糖基的皂苷进行制备。Ⅳ型人参皂苷糖苷酶可先水解掉Re上的6-O-鼠李糖基生成Rg1,再水解掉Rg1上的6-O-葡萄糖基生成F1[9]。
本实验室前期已经以人参皂苷Re为底物,采用酶转化法,利用Ⅳ型人参皂苷糖苷酶制备了Rg1和F1的混合物粗产品,本研究是利用大孔吸附树脂和硅胶柱层析法分离纯化人参皂苷Re的酶解产物,即Rg1和F1,达到制备稀有人参皂苷F1的目的。
1 材料与方法
1.1 材料和仪器
人参皂苷标准品Re、Rg1、F1、人参皂苷Re酶解产物,本实验室提供;大孔吸附树脂,南开大学化工厂;硅胶,青岛海洋化工厂;薄层层析板Silica Gel 60-F254,德国Merck公司;高效液相色谱仪,美国Waters公司;色谱所用试剂为色谱醇,其他实验所用试剂均为分析醇。
1.2 方 法
1.2.1 大孔吸附树脂法脱糖、脱色
分别采用大孔吸附树脂AB-8和D-296对Re的酶解产物进行脱糖脱色处理。
树脂的预处理:先将树脂用甲醇浸泡12 h,然后用去离子水洗至出水清亮无色,再以5%的NaOH和HCl交替处理,在碱洗和酸洗之间用去离子水洗至中性,交替处理两个循环。最后用5%的NaOH溶液再生,水洗至中性后待用。
脱糖:将样品溶于水中后,上柱,直至皂苷全部被吸附,然后用水洗柱子,洗至无糖为止,再用75%的乙醇将树脂吸附的皂苷全部洗脱下来。
脱色:将从脱糖步骤洗脱下来的皂苷溶液直接上D-296脱色柱,最后用1~2倍柱体积的75%乙醇洗脱,收集,至洗脱液TLC检测至无样品为止。
1.2.2 硅胶层析法分离纯化F1
样品胶的制备:将样品溶于甲醇后,与2.5~3.0倍样品质量的80~100目硅胶混合,在通风柜中的水浴锅上均匀搅拌使其混合完全,颗粒均匀,溶剂充分挥发干燥后即制得样品胶。
装柱:将圆柱形玻璃柱的下端用脱脂棉封好,取300~400目硅胶(样品质量的12倍)作为分离胶,用漏斗匀速装入玻璃柱内,使其铺放均匀平坦,轻轻拍打柱体至柱面不再下降,在硅胶上面平铺80~100目的硅胶15.0 g,在下面抽真空使其紧实,最后加入样品胶。
洗脱:先用纯氯仿通柱,洗脱硅胶中的杂质和极性较小的色素等物质,然后以氯仿-甲醇洗脱液[V(氯仿)∶V(甲醇)=9.0∶1.0]进行洗脱,薄层层析跟踪检测结果,直至人参皂苷Rg1全部洗脱下来。最后以纯甲醇洗柱,直到点板无样品为止。
1.2.3 人参皂苷的检测
薄层层析法(TLC):采用毛细管吸取样品液,并少量多次点样于事先切好的薄层层析板上,电吹风吹干。将点好样品的薄层层析板放入展开剂已挥发平衡的层析缸中,盖严,待展开剂接近层析板上边缘时,取出层析板,电吹风吹干,喷洒10% 的H2SO4水溶液,加热显色。研究所使用的展开剂为氯仿-甲醇-水[V(氯仿)∶V(甲醇)∶V(水)=7∶3∶0.5]。
高效液相色谱法(HPLC):美国Waters 2695高效液相色谱仪,Waters 2996二极管阵列检测器,Empower 2色谱工作站,Kromasil C 18色谱柱(5 μm,250 mm×4.6 mm)。柱温35 ℃,体积流量1 mL/min,按需要配制1 mg/mL 样品液,样品进样量10 μL,检测波长203 nm。乙腈-水梯度洗脱,洗脱条件:0~15 min,乙腈体积分数为20%;16~35 min,乙腈体积分数由20%增至32%;36~50 min,乙腈体积分数由32%增至43%;51~80 min,乙腈体积分数由43%增至100%。
2 结果与讨论
为了将Re的酶解产物进行分离提纯,首先用大孔吸附树脂进行脱糖、脱色处理,再用硅胶层析法进一步纯化。纯化过程中,采用TLC和HPLC进行检测。
2.1 大孔吸附树脂脱糖脱色
将65.0 g Re的酶解产物按照“1.2.1”中所述的方法,经大孔吸附树脂AB-8脱糖、D-296脱色,浓缩蒸干后称重,共得到粗产品37.0 g,得率为56.9%。产品用TLC进行检测,如图1所示。从图1中可以看出,脱糖、脱色后的粗产品中,主要含有人参皂苷Rg1和F1。对此粗产品按“1.2.2”所述方法,采用硅胶柱进行分离提纯。
2.2 硅胶层析分离
将从65.0 g的Re酶解产物经脱糖、脱色处理后得到的37.0 g干燥粗产品制成样品胶。柱子装好后先用纯氯仿通柱,然后以氯仿-甲醇洗脱液进行洗脱,每瓶收集200 mL,直到Rg1全洗出为止。TLC跟踪检测,结果如图2所示。
将洗脱出来具有相同组分的皂苷减压浓缩,真空干燥,分别收集称重。23~33号瓶为单体F1,共4.75 g,在37.0 g粗产品中的得率为12.8%。采用HPLC方法检测分离后的人参皂苷F1的纯度,结果如图3所示,F1皂苷的纯度为98.0%。
收集92~120号瓶为单体Rg1,共11.2 g,在37.0 g粗产品中的得率为30.2%。经HPLC检测,结果如图4所示。Rg1皂苷的纯度为96.0%。

Re、F1、Rg1,人参皂苷标准品;产,粗产品
Fig.1 TLC of crude product after desugarization and decoloration

Re、Rg1、F1,标准品;样,原料;1~140,收集瓶号

图3 人参皂苷F1的HPLC检测图
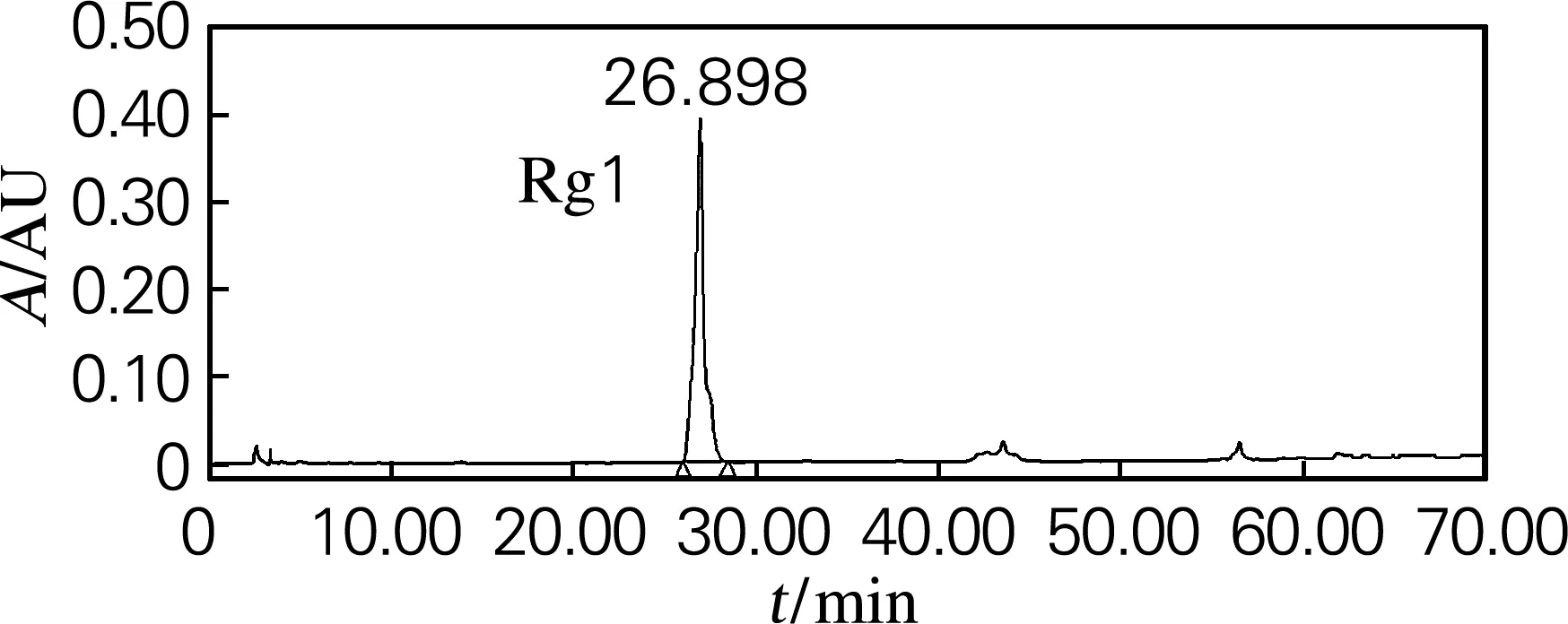
图4 人参皂苷Rg1的HPLC检测图
因此,将经脱糖脱色处理后得到的37.0 g干燥粗产品经硅胶分离后,得单体F1 4.75 g,在粗产品中的得率为12.8%;得单体Rg1 11.2 g,在粗产品中的得率为30.2%。重复进行3次实验,得到的结果接近。
3 结 论
本研究是采用大孔吸附树脂和硅胶层析相结合的方法,对主要含有人参皂苷Rg1和F1两种物质的人参皂苷Re的酶解产物进行分离纯化来制备F1,并采用TLC和HPLC两种方法进行检测。结果显示,65.0 g人参皂苷Re的酶解产物经脱糖脱色处理后,得到37.0 g产物粗品,得率为56.9%。此37.0 g粗产物经硅胶柱分离纯化后,共得到纯度为96.0%的Rg1皂苷11.2 g,在粗产品中的得率为30.2%;得到纯度为98.0%的F1皂苷4.75 g,在粗产品中的得率为12.8%;重复进行3次实验的结果接近。由此可见,65.0 g的Re人参皂苷酶转化得到Rg1皂苷的得率为17.2%,得到F1皂苷的得率为7.31%。
[1] 国家药典编委会. 中华人民共和国药典[M]. 北京:中国医药科技出版社, 2010:8.
[2] 金凤燮. 天然产物生物转化[M]. 北京:化学工业出版社, 2009:80-130.
[3] HASEGAWA H, SUNG J, MATSUMIYA S, et al. Main ginseng saponin metabolites formed by intestinal bacteria[J]. Planta Medica, 1996, 62:453-457.
[4] 李翠翠,刘廷强,王颖,等. 酶转化人参皂苷C-K的提取工艺[J]. 大连工业大学学报, 2009, 28(2):87-89.
(LI Cui-cui, LIU Ting-qiang, WANG Ying, et al. Extraction of ginsenoside Compound-K[J]. Journal of Dalian Polytechnic University, 2009, 28(2):87-89.)
[5] 孙斯宜,宋建国,鱼红闪,等.Arthrobactersp. No.3细菌酶转化三醇类人参皂苷Rg1生成Rh1的反应条件[J]. 大连工业大学学报, 2011, 30(1):1-4.
(SUN Si-yi, SONG Jian-guo, YU Hong-shan, et al. Transformation of ginsenoside Rg1 to ginsenoside Rh1 by the enzyme fromArthrobactersp. No.3 bacterium[J]. Journal of Dalian Polytechnic University, 2011, 30(1):1-4.)
[6] 田桐,宋建国,赵慕,等. 人参皂苷Rg3 与Rg5的分离及Rg3异构体的拆分[J]. 大连工业大学学报, 2011, 30(2):109-112.
(TIAN Tong, SONG Jian-guo, ZHAO Mu, et al. Separation and preparation of ginsenosides Rg3 enantiomers and Rg5[J]. Journal of Dalian Polytechnic University, 2011, 30(2):109-112.)
[7] YU Hongshan, ZHANG Chunzhi, LU Mingchun, et al. Purification and characterization of new special ginsenosidase hydrolyzing multi-glycosides of protopanaxadiol ginsenosides, ginsenosidase type Ⅰ[J]. Chemical and Pharmaceutical Bulletin, 2007, 26(2):97-100.
[8] YU Hongshan, LIU Qingmei, ZHANG Chunzhi, et al. A new ginsenosidase fromAspergillusstrain hydrolyzing 20-O-multi-glycoside of PPD ginsenoside[J]. Process Biochemistry, 2009, 44:772-775.
[9] WANG Dongming, YU Hongshan, SONG Jianguo, et al. A novel ginsenosidase from anAspergillusstrain hydrolyzing 6-O-multi-glycosides of protopanaxatriol-type ginsenosides, named ginsenosidase type Ⅳ[J]. Journal of Microbiology and Biotechnology, 2011, 21(10):1057-1063.
[10] BAE E, SHIN J, KIM D. Metabolism of ginsenoside Re by human intestinal microflora and its estrogenic effect[J]. Biological and Pharmaceutical Bulletin, 2005, 28:1903-1908.
[11] LEE E, CHO S, KIM S, et al. Ginsenoside F1 protects human HaCaT keratinocytes from ultraviolet-B-induced apoptosis by maintaining constant levels of Bcl-2[J]. Journal of Investigative Dermatology, 2003, 121:607-613.

