RP-HPLC-APCI MS和 RP-HPLC- ELSD法分析鸡脂甘油酯组成及结构
靳林溪,谢建春*,王 石,孙宝国
(北京工商大学 北京市食品风味化学重点实验室,食品添加剂与配料北京市高等学校工程中心,北京 100048)
RP-HPLC-APCI MS和 RP-HPLC- ELSD法分析鸡脂甘油酯组成及结构
靳林溪,谢建春*,王 石,孙宝国
(北京工商大学 北京市食品风味化学重点实验室,食品添加剂与配料北京市高等学校工程中心,北京 100048)
利用反相高效液相色谱-大气压化学电离质谱(RP-HPLC-APCI MS)及反相高效液相色谱-蒸发光散射检测(RP-HPLC- ELSD)分析鸡脂甘油酯组成及结构。C18色谱柱,乙腈-二氯甲烷(60:40,V/V)为流动相,APCI MS正离子模式。根据APCI一级质谱的准分子离子及二酰基甘油碎片离子鉴定出26种甘油酯,包括4种甘油二酯和22种甘油三酯。根据二酰基甘油碎片离子的丰度高低及离子阱碰撞诱导解离产生的二级/三级碎片离子的丰度高低,判定各甘油酯中脂肪酸的位置分布。采用RP-HPLC-ELSD分析,面积归一化法定量,甘油三酯占总甘油酯的99.88%,含量最高的为1-棕榈酸-2,3-二油酸甘油酯(23.65%),其次为1-棕榈酸-2-油酸-3-亚油酸甘油酯(19.37%)、1-亚油酸-2,3-二油酸甘油酯(16.02%)。
鸡脂;甘油酯;高效液相色谱;大气压化学电离质谱;蒸发光散射检测
油脂的甘油三酯组成,不仅包括脂肪酸组成信息,还包括脂肪酸在甘油分子上的位置分布等结构性信息。油脂的质量与营养价值,不仅与脂肪酸组成有关,还与甘油酯的化学结构有关。脂肪酸在甘油三酯中的位置分布,决定甘油三酯在体内的吸收代谢情况。Sn-2位脂肪酸在人体内吸收利用率比Sn-1(3)位的脂肪酸高[1],即使脂肪酸组成相同,若脂肪酸在甘油三酯中的分布位置不同,在机体内的吸收和利用也不同。
已有报道采用高温气相色谱、高效液相色谱、薄层色谱、超临界流体色谱等技术可分析油脂的甘油酯组成[2-6],其中反相高效液相色谱(reverse- phase high performance liquid chromatography,RP-HPLC)因可实现常温和低温下各种甘油三酯的有效分离,应用最为广泛。蒸发光散射检测器(evaporative light-scattering detector,ELSD)是20世纪90年代出现的一种通用型质量检测器,具有灵敏度高、受温度等实验条件影响小和线性范围宽等优点,是检测甘油三酯等具有紫外吸收缺陷化合物的有力工具[7]。刘涛等[8]采用RP-HPLC-ELSD外标法测定了棕榈油、乌桕脂中9种甘油三酯和1种甘油二酯的含量;耿文飞等[9]采用RP-HPLC-ELSD测定了所合成三油酸甘油酯的含量;安广杰等[10]采用超高效液相色谱(ultra performance liquid chromatography,UPLC)-蒸发光散射检测器(ELSD)面积归一化法测定了双低菜籽油中7种甘油三酯及橄榄油中4种甘油三酯的含量。但对于复杂的甘油三酯,还需借助于色谱-质谱联用技术准确地确认结构。
近年来,反相高效液相色谱-大气压化学电离质谱(reversed-phase-high performance liquid chromatographyatmospheric pressure chemical ionization mass spectrometry,RP-HPLC-APCI MS)已成功地用于油脂的甘油酯分析。向智敏等[11]采用RP-HPLC-APCI MS(三重四极杆质谱仪)从薏苡仁油中分析鉴定出12种甘油三酯;Lisa等[12]采用RP-HPLC-APCI MS(离子阱质谱仪)分析了60种植物油中的甘油三酯组成。APCI MS不仅可提供准分子离子信息推断分子量,还可根据形成的少量碎片离子及其丰度比,判断脂肪酸的结构及脂肪酸在甘油三酯中的位置分布,如傅伟昌等[13]根据准分子离子信息及二酰基甘油离子的丰度比鉴定桐油中主要甘油三酯组成和结构。目前,RP-HPLC-APCI MS应用在分析甘油酯的报道中,多是关于植物油的甘油酯分析[11-16]。本实验采用RPHPLC-APCI MS分析鸡脂的甘油酯结构及脂肪酸在甘油酯中的位置分布,并进而采用RP-HPLC-ELSD面积归一化定量,建立一种分析动物脂肪中复杂甘油酯组成和结构的方法。
1 材料与方法
1.1 材料与试剂
鸡脂 安徽牧洋油脂有限公司;乙腈、二氯甲烷(色谱纯) 北京迪马科技公司。
1.2 仪器与设备
LCQ Deca XP Max液相色谱-离子阱质谱联用仪(配有大气压化学电离源(APCI)) 美国Thermo公司;1200高效液相色谱仪(配有G1379A脱气机、G1312A二元泵、G1313A自动进样器、G1316A柱温箱) 美国Agilent公司;SEDEX 75蒸发光散射检测器 法国Sedere公司;XWK-Ⅲ无油空气泵 天津市华生分析仪器厂。
1.3 方法
1.3.1 样品制备
取10mg鸡脂,加入5mL溶剂(二氯甲烷-乙腈,40:60,V/V)溶解,0.45μm膜过滤,待分析。
1.3.2 HPLC-MS分析
Dikma C18色谱柱(4.6mm×250mm,5μm);流动相:二氯甲烷-乙腈(40:60,V/V),流速1mL/min,柱温25℃,进样10μL。
APCI离子源,正离子模式,喷雾电压3000V,毛细管温度250℃,汽化温度400℃,Corona电流4μA。质量扫描范围300~1000u,扫描时间1s,Q1峰宽0.7,鞘气(氮气)压力75bar,辅助气(氦气)压力20bar。二级碰撞:隔离宽度2.0,碰撞能量30%。
1.3.3 HPLC-ELSD分析
液相色谱柱、进样等操作条件同1.3.2节。ELSD:雾化气空气,压力3.2bar,漂移管温度30℃。将各色谱峰的保留时间与HPLC-APCI MS总离子流色谱中各色谱峰的保留时间比较定性,面积归一化法定量。
2 结果与分析
2.1 RP-HPLC-MS分析
HPLC-MS分析的总离子流色谱图及RP-HPLC-ELSD色谱图见图1,分析鉴定结果见表1。
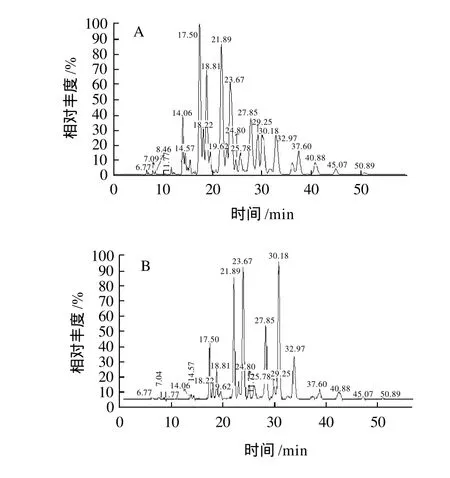
图1 鸡脂的HPLC-APCI-MS 总离子流图(A)和HPLC-ELSD色谱图(B)Fig.1 HPLC-APCI-MS Total ion current chromatogram (A) and HPLC-ELSD (B)chromatogram glycerides in chicken fat
APCI是一种气相离子化软电离过程,适合具有一定挥发性的中等极性和弱极性的分子离子化。APCI质谱图通常具有很好的规律性,一般包括准分子离子峰和一定量的碎片离子峰,准分子离子峰可提供未知物质的分子量信息,碎片离子峰可提供更详细的结构信息[17-18]。本实验甘油三酯在APCI质谱中离子化过程如图2所示。
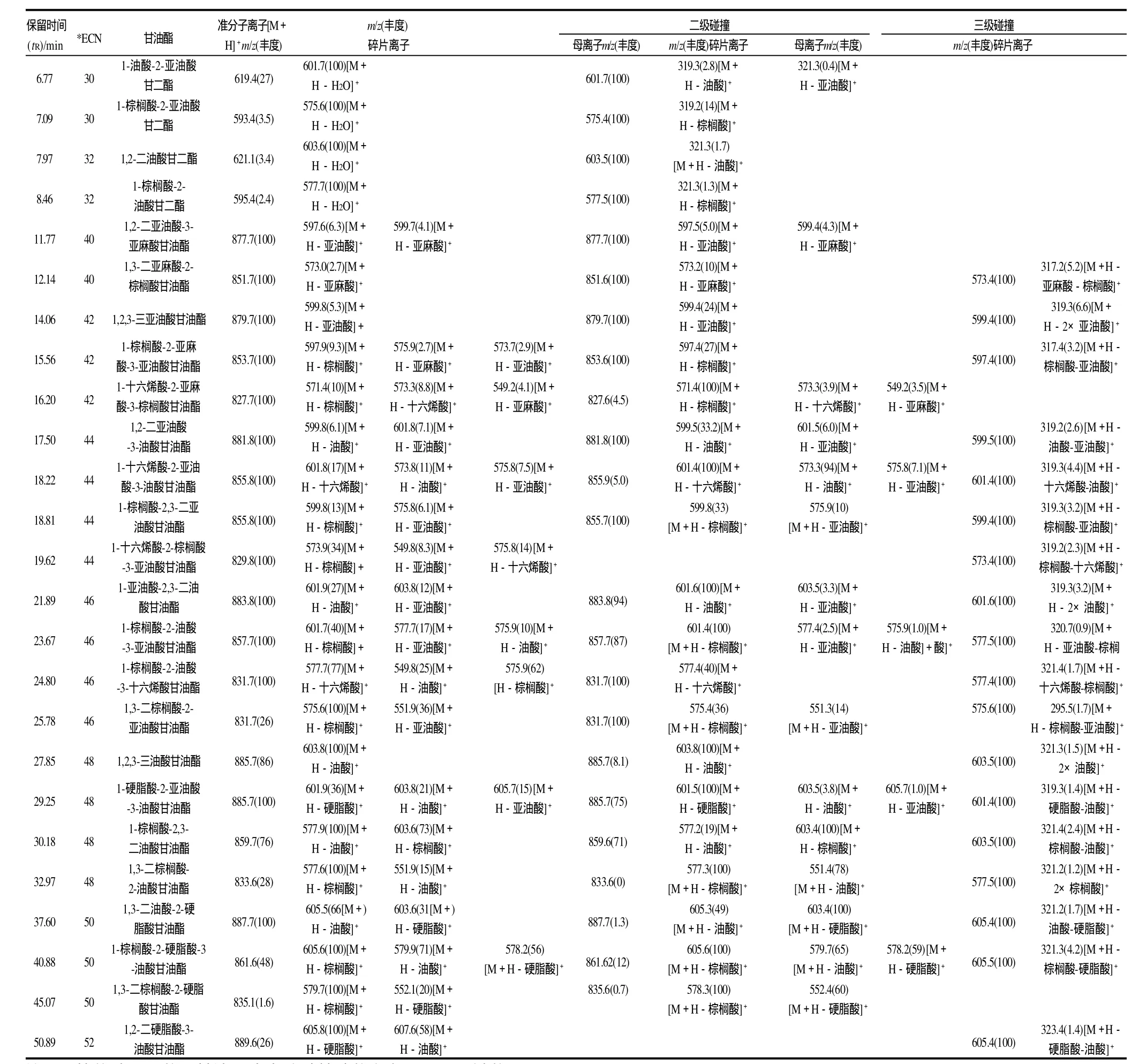
表1 鸡脂的RP-HPLC-APCI MS分析鉴定结果Table 1 Results obtained for analysis of chicken fat by HPLC-APCI MS
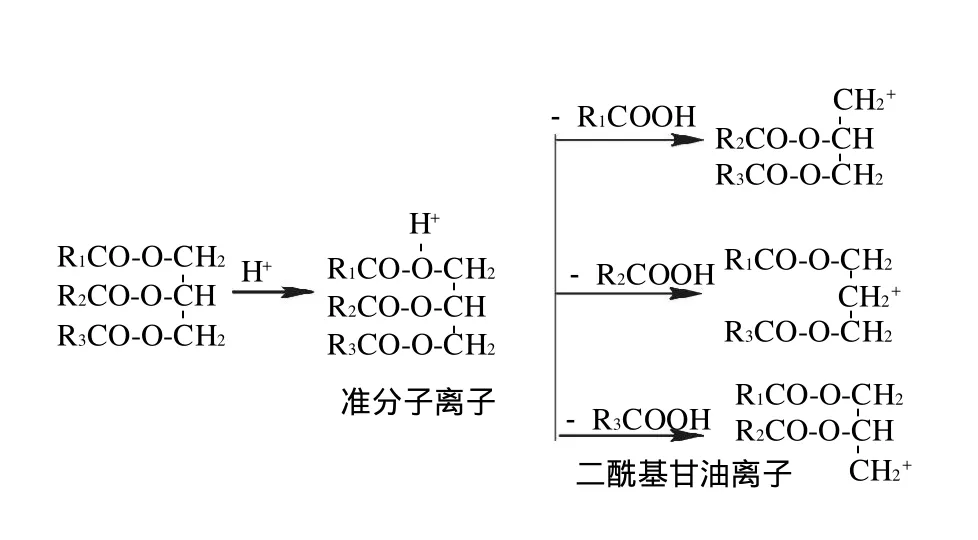
图2 甘油三酯在APCI 质谱中的离子化Fig.2 Ionization of triacylglycerols in APCI analysis
检测到的甘油三酯的一级质谱图中存在信号强度较大的准分子离子峰[M+H]+和准分子离子失去1个脂肪酸的碎片离子峰[M+H-脂肪酸]+(即二酰基甘油离子):[M+H-R1COOH]+或[M+H-R2COOH]+、[M+HR3COOH]+,根据这些可推断甘油酯组成。
例如,表1中tR为14.06min的色谱峰所对应的一级质谱如图3A所示,其准分子离子[M+H]+为m/z879.7,碎片离子只有[M+H-亚油酸]+(m/z599.8),由此推断此谱峰对应的组分为三亚油酸甘油酯。
同样,tR为17.50min的色谱峰所对应的一级质谱如图3B所示,其准分子离子[M+H]+为m/z881.8,碎片离子为[M+H-油酸]+(m/z599.8)和[M+H-亚油酸]+(m/z601.8)。同时含油酸与亚油酸的甘三酯可为二亚油酸油酸甘油酯、或二油酸亚油酸甘油酯,但只是二亚油酸油酸甘油酯的[M+H]+为m/z881.8、[M+H-油酸]+为m/z599.8、[M+H-亚油酸]+为m/z601.8,由此推断此谱峰对应的组分为二亚油酸油酸甘油酯。
tR为23.67min的色谱峰所对应的一级质谱如图3C所示,其准分子离子[M+H]+为m/z857.7,碎片离子为[M+H-棕榈酸]+(m/z601.7)、[M+H-亚油酸]+(m/z577.7)、[M+H-油酸]+(m/z575.9),由此推断此谱峰对应的组分为棕榈酸油酸亚油酸甘油酯。
tR为29.25min的色谱峰所对应的一级质谱如图3D所示,其准分子离子[M+H]+为m/z885.7,碎片离子为[M+H-硬脂酸]+(m/z601.9)、[M+H-油酸]+(m/z603.8)、[M+H-亚油酸]+(m/z605.7),由此推断此谱峰对应的组分为硬脂酸油酸亚油酸甘油酯。
离子阱检测器是灵敏度很高的质量分析器,在分析离子源产生离子的同时还可以把离子阱当成碰撞室,使阱内的离子碰撞诱导解离(collision-induced dissociation,CID)。在一次数据采集中,离子阱检测器可获得一级及多级质谱信息[19]。本实验检测的某些色谱峰对应的一级质谱,除了准分子离子[M+H]+外,二酰基甘油碎片离子[M+H-R1COOH]+、[M+H-R2COOH]+、[M+H-R3COOH]+没有出现或丰度很低,此时可选择准分子离子为母离子,通过碰撞诱导解离使形成二酰基甘油离子或单酰基甘油离子进行推断。此外,对于一级质谱中二酰基甘油离子丰度较高的组分,还可通过碰撞诱导解离再次确认鉴定结果。
表1中tR为14.06min的色谱峰根据一级质谱图推断为三亚油酸甘油酯。设[M+H]+(m/z879.7)为母离子,通过碰撞诱导解离获得二级质谱(图4A),此时碎片离子为[M+H-亚油酸]+(m/z599.4);再设m/z599.4为母离子,通过碰撞诱导解离获得三级质谱(图4B),此时只得到碎片离子[M+H-2×亚油酸]+(m/z319.3),由此可进一步证明其为三亚油酸甘油酯。
同样,tR为21.89min的色谱峰根据一级质谱图推断为二油酸亚油酸甘油酯。设[M+H]+(m/z883.8)为母离子,通过碰撞诱导解离获得二级质谱(图4C),此时碎片离子为[M+H-亚油酸]+(m/z603.5)和[M+H-油酸]+(m/z601.6);再设m/z601.6为母离子,通过碰撞诱导解离获得三级质谱(图4D),此时得到碎片离子[M+H-2×油酸]+(m/z319.3),由此进一步证明其为二油酸亚油酸甘油酯。
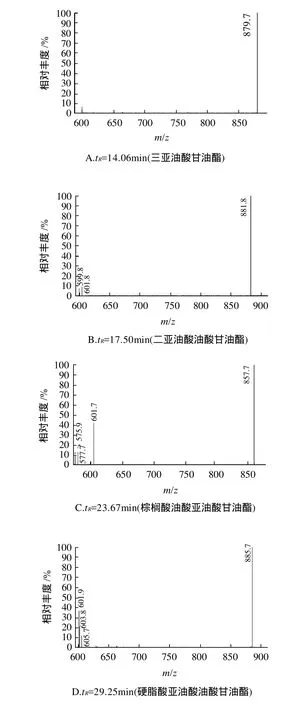
图3 4种甘油三酯的一级质谱图Fig.3 APCI mass spectra of four triacylglycerols
甘油三酯中不同位置的脂肪酸在质谱中断裂所需能量不同,研究[20]表明酯化在Sn-1/3位的脂肪酸要比酯化在Sn-2位的脂肪酸容易断裂,因而从甘油骨架Sn-2位上断裂一个脂肪酸后形成的1,3-二酰基甘油离子的丰度要比从Sn-1/3位上断裂一个脂肪酸后形成1,2-二酰基甘油离子或2,3-二酰基甘油离子丰度低。根据甘油三酯在APCI质谱中形成二酰基甘油离子丰度的高低可判断脂肪酸在甘油骨架上的位置分布。
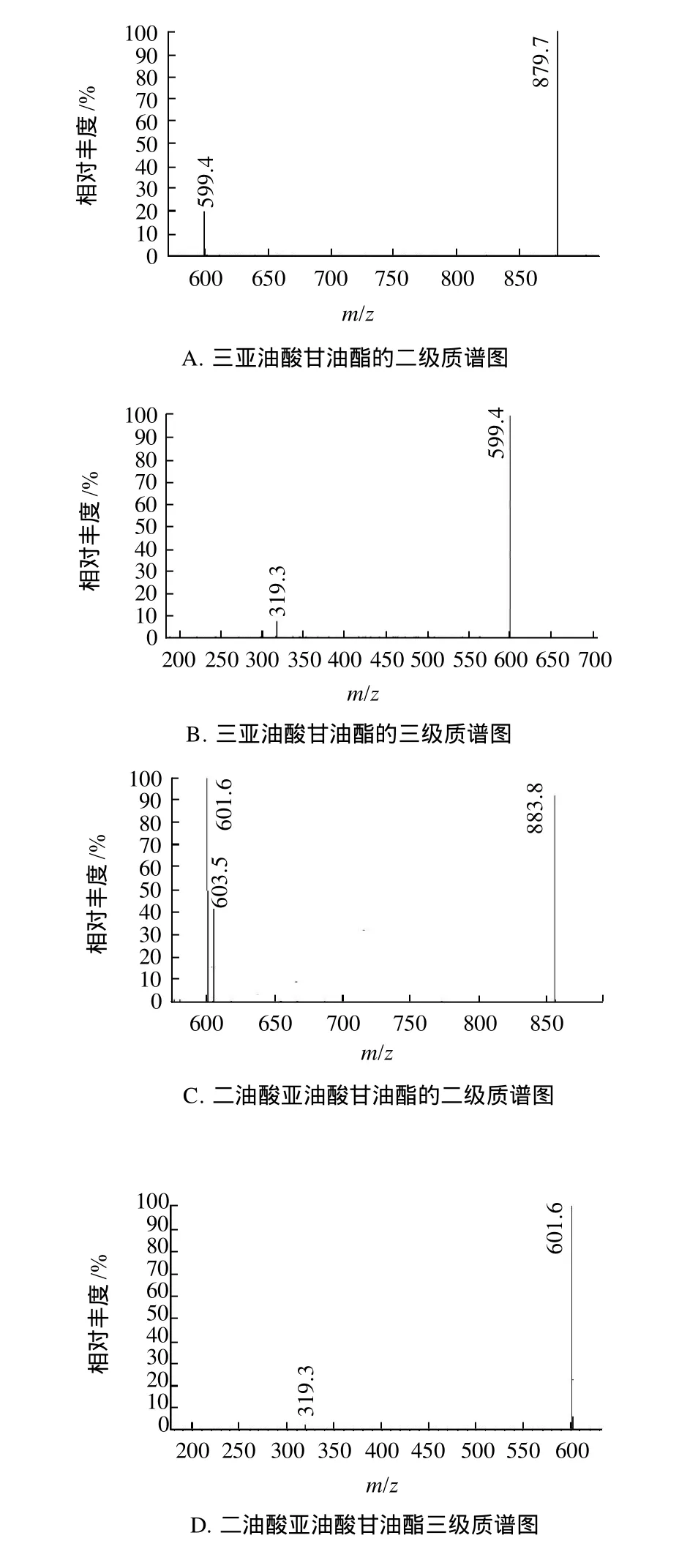
图4 两种甘油三酯的碰撞诱导解离质谱图Fig.4 Mass spectra of two triacylglycerols by collision induced dissociation (CID)
例如,表1中tR为17.50min的色谱峰按照上述方法鉴定为二亚油酸油酸甘油酯,从一级质谱中[M+H-油酸]+(m/z599.8)和[M + H-亚油酸]+(m/z601.8)的两二酰基甘油碎片离子的丰度接近(图3B)可推断出,分布于Sn-2位为亚油酸,分布于Sn-1/3位为油酸,此甘油酯为1-油酸-2,3-二亚油酸甘油酯。
同样,tR为23.67min的色谱峰按照上述方法鉴定为棕榈酸油酸亚油酸甘油酯,一级质谱中二酰基甘油碎片离子为[M+H-棕榈酸]+(m/z601.7)、[M+H-亚油酸]+(m/z577.7)、[M+H-油酸]+(m/z575.9),其中[M+H-油酸]+(m/z575.9)丰度最低(图3C),可推断出油酸分布于Sn-2位,棕榈酸及亚油酸分布于Sn-1/3位。设母离子为[M+H]+(m/z857.7),经过一级碰撞,得到的二酰基甘油碎片离子中仍然是m/z575.9的丰度最低,进一步说明Sn-2位为油酸,此甘油酯为1-棕榈酸-2-油酸-3-亚油酸甘油酯。
tR为29.25min的色谱峰按照上述方法鉴定为硬脂酸亚油酸油酸甘油酯,一级质谱中二酰基甘油碎片离子为[M+H-硬脂酸]+(m/z601.9)、[M+H-油酸]+(m/z603.8),[M+H-亚油酸]+(m/z605.7),其中[M+H-亚油酸]的丰度最低(图3D),可推断出亚油酸分布于Sn-2位,油酸及硬脂酸分布于Sn-1/3位,此甘油酯为1-硬脂酸-2-亚油酸-3-油酸甘油酯。
综上,采用HPLC-MS从鸡脂中共鉴定出26种甘油酯,并给出脂肪酸位置分布(表1)。包括4种甘油二酯和22种甘油三酯,4种甘油二酯为1-油酸-2-亚油酸甘二酯、1-棕榈酸-2-亚油酸甘二酯、1,2-二油酸甘二酯、1-棕榈酸-2-油酸甘二酯;22种甘油三酯为1-亚油酸-2,3-二油酸甘油酯、1,2-二亚油酸-3-油酸甘油酯、1-棕榈酸-2-油酸-3-亚油酸甘油酯、1,2,3-三油酸甘油酯等。从甘油酯的构成可知,本实验所用鸡脂的脂肪酸组成主要为油酸、亚油酸、棕榈酸、硬脂酸等,这与田颖刚等[21]所报道的乌鸡脂的脂肪酸组成分析结果一致。
甘油酯在RP-HPLC中洗脱分离时,其保留时间与碳原子数和双键数有关,各甘油酯按照等价碳原子数(ECN=甘油三酯脂肪酰基碳数之和-2×双键数)从小到大顺序洗脱出来,等价碳原子数相同时,以双键数较高的甘油酯先流出,双键数较少的后流出[22-23]。表1中所列甘油酯的出峰顺序与甘油酯在RP-HPLC上的等价碳原子数原则相一致。
鸡脂的甘油酯组成比较复杂,一些等价碳原子数相同,但脂肪酸不同的甘油三酯,在RP-HPLC上表现为共流出峰,此时可通过选择特征离子,利用提取离子色谱解析,确定共流出甘油酯的准确保留时间及脂肪酸的位置分布状况。
图1中tR14.57min色谱峰对应的质谱存在m/z879.7和m/z853.8两个准分子离子,属于共流出峰。选择离子m/z879.7和m/z853.8获得提取离子色谱图(图5),包括tR为14.49min(m/z879.7)和14.64min (m/z853.8)两个色谱峰。与准分子离子m/z879.7相关联=的碎片离子为[M+H-亚麻酸]+(m/z601.8)、[M+H-亚油酸]+(m/z599.8)、[M+H-油酸]+(m/z597.8),丰度分别为5.0、14、3.8,其中[M+H-油酸]+(m/z597.8)的丰度最低,说明Sn-2位为油酸,据此推断tR=14.49min对应的组分为1-亚麻酸-2-油酸-3-亚油酸甘油酯。与准分子离子m/z853.8相关联的碎片离子为[M+H-十六烯酸]+(m/z599.9)、[M+H-亚油酸]+(m/z573.8),丰度最低的为[M+H-亚油酸]+碎片离子,说明Sn-2位为亚油酸,据此推断tR为14.64min对应的组分为1,2-二亚油酸-3-十六烯酸甘油酯。
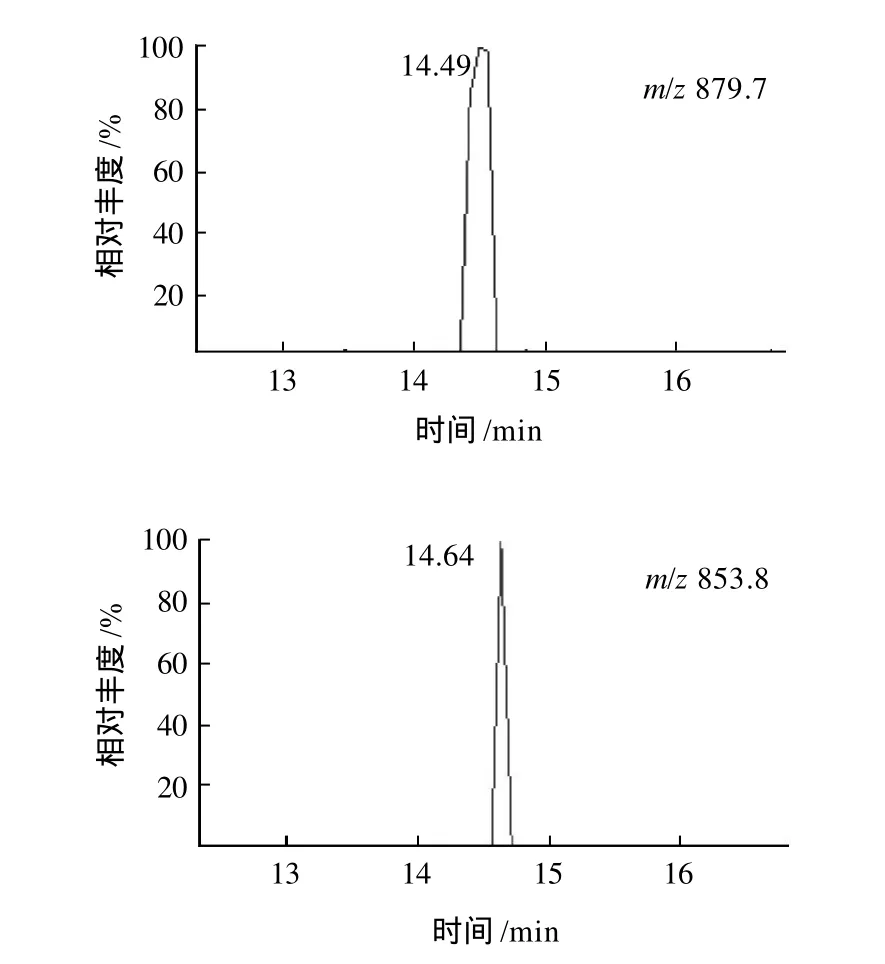
图5 总离子流图中tR=14.57min色谱峰的提取离子色谱图Fig.5 Extraction ion chromatograms for peak tR14.57min in total ion current chromatogram
通过提取离子色谱鉴定tR为14.57min色谱峰所得的两种甘油三酯1-亚麻酸-2-油酸-3-亚油酸甘油酯和1,2-二亚油酸-3-十六烯酸甘油酯的等价碳数(ECN)相同(均为42),这可能是造成它们在RP-HPLC上没有得到分离的主要原因。两种甘油三酯在表1中的出峰顺序与甘油酯在RP-HPLC上的ECN出峰原则相符。
2.2 HPLC-ELSD分析
离子阱质谱的灵敏度很高,由于可以进行多级质谱研究,对于化合物的定性很有帮助。但APCI-MS是选择性检测器,对于离子化程度不同的物质响应不同,因此其不适于定量研究。ELSD是一种可以检测所有非挥发性和半挥发性物质的通用检测技术,它不依赖于被检测物的光学吸收特性,也不受溶剂光学特性的影响,因此在检测过程中,对各物质几乎具有相同的响应因子,适于定量分析。
HPLC-ELSD的色谱图见图1,通过与HPLC-APCI MS总离子流图中各谱峰的保留时间比对定性、面积归一化法定量,分析结果见表2。
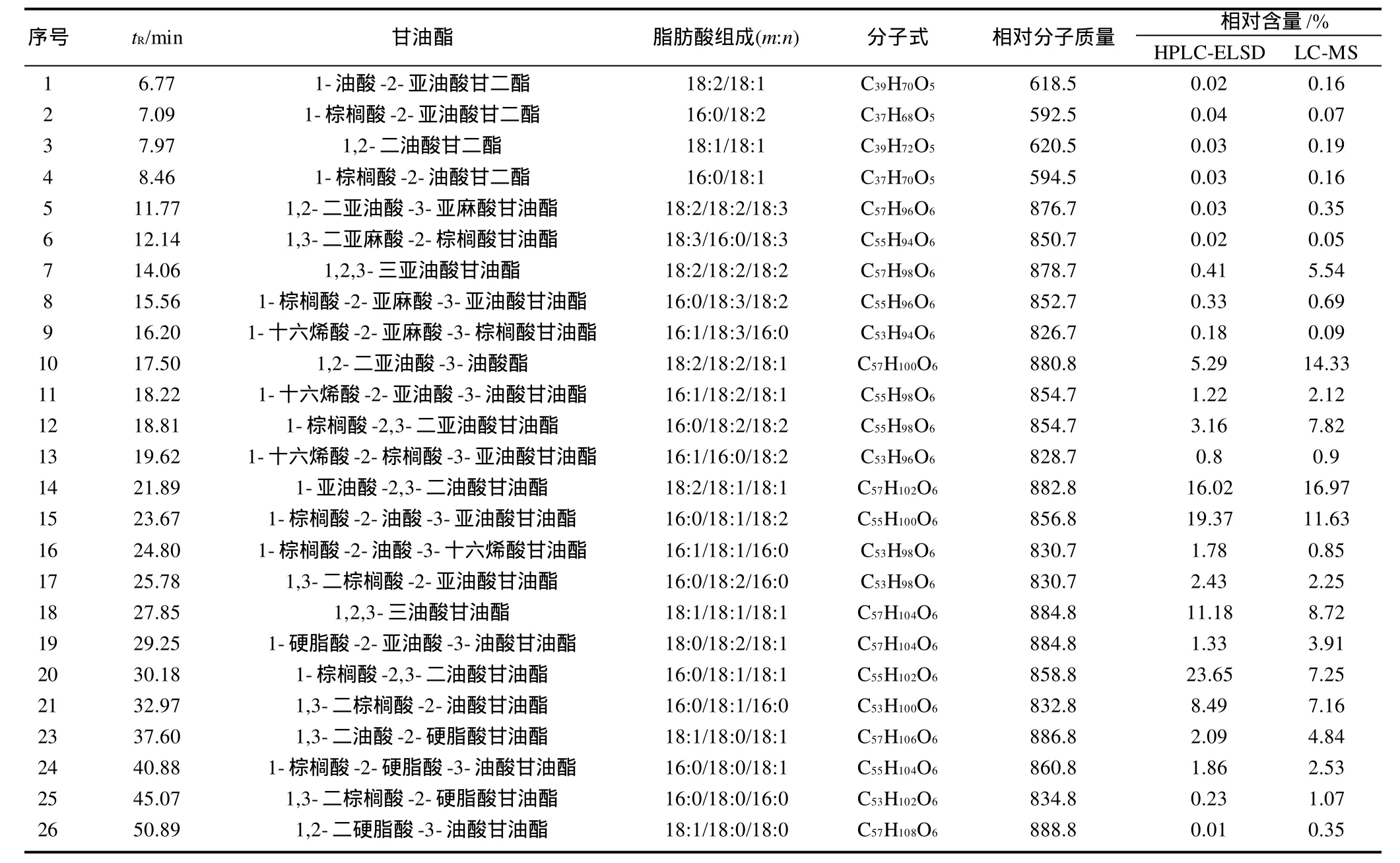
表2 鸡脂中甘油酯的HPLC-ELSD分析结果Table 2 Results of triacylglycerols in chicken fat analyzed by HPLC-ELSD
由表2可知,采用HPLC-APCI-MS分析,面积归一化法,含量较高的为1-亚油酸-2,3-二油酸甘油酯(16.97%)、1,2-二亚油酸-3-油酸甘油酯(14.33%)、1-棕榈酸-2-油酸-3-亚油酸甘油酯(11.63%)、1,2,3-三油酸甘油酯(8.72%)。甘油三酯占总甘油酯的99.42%,含量大于3%的甘油三酯有10种,占总甘油酯的88.17%。
采用HPLC-ELSD,面积归一化法,含量较高甘油酯为1-棕榈酸-2,3-二油酸甘油酯(23.65%)、1-棕榈酸-2-油酸-3-亚油酸甘油酯(19.37%)、1-亚油酸-2,3-二油酸甘油酯(16.02%)。甘油三酯占总甘油酯的99.88%,含量大于3%的甘油三酯有7种,占总甘油酯的87.16%。
APCI-MS与ELSD基于不同检测原理,对甘油酯的响应值不同,因而检测到的各甘油酯的含量不同。例如,HPLC-APCI-MS分析中,1-亚油酸-2,3-二油酸甘油酯、1,2-二亚油酸-3-油酸甘油酯所占比例居于前两位,但在ELSD中,1-棕榈酸-2,3-二油酸甘油酯、1-棕榈酸-2-油酸-3-亚油酸甘油酯所占比例居于前两位。这可能是由于APCI对由油酸、亚油酸等不饱和脂肪酸构成的甘油酯的响应高,它们更易离子化。而ELSD是通用型质量检测器,对任何物质响应基本相同,因而定量结果更为准确。
3 结 论
采用RP-HPLC-APCI MS定性及RP-HPLC-ELSD定量,从鸡脂中分析鉴定出26种甘油酯,并判断了脂肪酸在各甘油酯中的位置分布。包括4种甘油二酯和22种甘油三酯,主要为甘油三酯,占99.88%。含量较高的为1-棕榈酸-2,3-二油酸甘油酯、1-棕榈酸-2-油酸-3-亚油酸甘油酯、1-亚油酸-2,3-二油酸甘油酯。构成鸡脂的甘油酯的脂肪酸主要为棕榈酸、油酸、亚油酸和硬脂酸,其中硬脂酸含量较少。采用RP-HPLC-APCI MS结合RP-HPLC-ELSD有效地分析了鸡脂的甘油酯结构及组成,为动物脂肪甘油酯分析方法的建立提供了参考。
[1]BRACCO U. Effect of triglyceride structure on fat absorption[J]. American Journal of Clinical Nutrition, 1994, 60(6): 1002-1009.
[2]邹建凯. 椰子油甘油三酯的高温气相色谱/质谱分析[J]. 分析化学,2002, 30(4): 428-431.
[3]陈勇, 陈碧莲, 何云珍, 等. 高效液相色谱法测定薏苡仁中甘油三油酸酯的含量[J]. 中国现代应用药学杂志, 2005, 22(3): 246-247.
[4]安广杰, 侯冰冰, 王瑛瑶, 等. 超高效液相色谱法测定油脂中甘油酯组成[J]. 中国油脂, 2011, 36(5): 55-58.
[5]FONTECHA J, RMOS J J, LOZADA L, et al. Composition of goat,s milk fat triglycerides analysed by silver ion adsorption-TLC and GCMS [J]. International Dairy Journal, 2000, 10(1/2): 119-128.
[6]刘书成, 章超桦, 洪鹏志, 等. 超临界流体色谱和质谱联用在油脂分析中的应用[J]. 中国油脂, 2006, 31(9): 48-52.
[7]魏泱, 丁明玉. 蒸发光散射检测技术[J]. 色谱, 2000, 18(5): 398-401.
[8]刘涛, 尹春华, 谭天伟. 高效液相色谱-蒸发光散射检测器测定脂肪酸和甘油酯的含量[J]. 中国油脂, 2005, 30(9): 52-55.
[9]耿文飞, 牛长群. 三油酸甘油酯的ELSD非水反相HPLC测定[J]. 中国医药工业杂志. 2003, 34(12): 621-622.
[10]安广杰, 侯冰冰, 王瑛瑶, 等. 超高效液相色谱法测定油脂中甘油酯组成[J]. 中国油脂, 2011, 36(5): 55-58.
[11]向智敏, 祝明, 陈碧莲, 等. HPLC-MS分析薏苡仁油中的甘油三酯成分[J]. 中国中药杂志, 2005, 30(18): 1436-1437.
[12]LISA M, HOLCAPEK M, BOHAC M. Statistical evaluation of triacylglycerol composition in plant oils based on high performance liquid chromatography-atmospheric pressure chemical ionization mass spectrometry data[J]. Journal of Agriculture and Food Chemistry, 2009,57(15): 6888-6898.
[13]傅伟昌, 顾小红, 陶冠军, 等. 桐油脂肪酸组成分析和甘三酯结构判定[J]. 天然产物研究与开发, 2008, 20(6): 964-968; 982.
[14]唐福伟, 张晨辉, 钱建芳, 等. 高效液相色谱-质谱法分析甘油油酸酯[J]. 理化检验: 化学分册, 2009, 45(11): 1315-1316.
[15]LISA M, HOLCAPEK M. Triacylglycerols profiling in plant oils important in food industry, dietetics and cosmetics using high-performance liquid chromatography-atmospheric pressure chemical ionization mass spectrometry[J]. Journal of Chromatography A, 2008, 1198-1199: 115-130.
[16]PIRAVI-VANAK Z, GHAVAMI M, EZZATPANAH H, et al. Evaluation of authenticity of Iranian olive oil by fatty acid and triacylglycerol profiles[J]. Journal of the American Oil Chemists Society, 2009, 86(9):827-833.
[17]杨树民. 大气压电离液质联机的应用[J]. 质谱学报, 1998, 19(1): 66-79.
[18]HOLCAPEK M, JANDERA P, ZDERADICK A. Characterization of triacylglycerol and diacylglycerol composition of plant oils using high performance liquid chromatography atomospheric pressure chemical ionization mass spectrometry[J]. Journal of Chromatography A, 2003, 1010(2): 195-215.
[19]刘书成, 张超桦, 洪鹏志, 等. 液质联用技术在油脂分析中应用[J].粮油与油脂, 2006(9): 10-13.
[20]BYRDWELL W C. Atmospheric pressure chemical ionization mass spectrometry for analysis of lipids[J]. Lipids, 2001, 36(4): 327-346.
[21]田颖刚, 谢明勇, 付志红, 等. 乌骨鸡脂肪油中脂肪酸组成的气相色谱-质谱分析[J]. 南昌大学学报: 理科版, 2006, 30(3): 264-267.
[22]廖学焜, 郭慧然, 陈文祥. 我国大豆油、花生油、芝麻油的甘油三酯组成研究[J]. 武汉植物学研究, 1988, 6(3): 247-252.
[23]MU H, KALO P, XU X, et al. Chromatographic methods in the monitoring of lipase-catalyzed interesterification[J]. European Journal of Lipid Science and Technology, 2000, 102(3): 202-211.
Composition and Structural Analysis of Glycerides in Chicken Fat by HPLC-MS and HPLC-ELSD
JIN Lin-xi,XIE Jian-chun*,WANG Shi,SUN Bao-guo
(Beijing Key Laboratory of Food Flavor Chemistry, Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients, Beijing Technology and Business University, Beijing 100048, China)
The composition and structure of glycerides in chicken fat were analyzed by reversed-phase high performance liquid chromatography-atmospheric pressure chemical ionization mass spectrometry (RP-HPLC-APCI MS) and reversed-phase high performance liquid chromatography with an evaporative light-scattering detector (RP-HPLC-ELSD). The chromatographic separation was performed on a C18 using a mobile phase of acetonitrile-methylene chloride (60:40,V/V). Glycerides were monitored by APCI MS in positive mode. According to [M+H]+and [M+H- RCOOH]+, 26 glycerides were identified. Based on the abundance of [M+H-RCOOH]+and ion fragments from collision induced dissociation (CID) of ion trap, the distribution of fatty acids in glycerides was deduced. Triacylglycerols represented 99.88% of total glycerides as demonstrated through RP-HPLCELSD analysis and quantification by peak area normalization. Among these triacylglycerols, 1-palmitoyl-2,3-di-oleoyl-glycerol revealed the highest content (23.65%), followed by 1-palmitoyl-2-oleoyl-3-linoleoyl-glycerol (19.37%), and 1-linoleoyl-2,3-dioleoyl-glycerol (16.02%).
chicken fat;glyceride;RP-HPLC;APCI MS;ELSD
TS201.2
A
1002-6630(2012)18-0149-07
2011-11-01
国家自然科学基金面上项目(31171755);北京市自然科学基金面上项目(2122013);
北京市教委科技发展计划重点项目(KZ20101001011);“十二五”国家科技支撑计划项目(2011BAD23B01);
北京市教委科研基地-科技创新平台-香料化学研究开发平台项目(201149);北京工商大学研究生创新基金项目
靳林溪(1986—),女,硕士研究生,研究方向食品香料化学。E-mail:jinlinxi156@163.com
*通信作者:谢建春(1967—),女,教授,博士,研究方向食品香料化学。E-mail:xjchun@th.btbu.edu.cn

