中国不同地区蜂胶水提物的抑菌活性
郝胤博,吴学志,罗丽萍,郭夏丽,张 茜,戴喜末,陈 滨
(南昌大学生命科学与食品工程学院,江西南昌330031)
中国不同地区蜂胶水提物的抑菌活性
郝胤博,吴学志,罗丽萍*,郭夏丽,张 茜,戴喜末,陈 滨
(南昌大学生命科学与食品工程学院,江西南昌330031)
为明确中国蜂胶水提物的抑菌活性,本文采用琼脂扩散法和微量液体稀释法,分别测定了来自中国26个地区的蜂胶水提物(Water Extraction of Propolis,WEP)对金黄色葡萄球菌、大肠杆菌、变形杆菌、产气杆菌和毛霉的抑菌圈和最小抑菌浓度。结果表明:除云南西双版纳WEP外,其余WEP均对受试菌表现出一定的抑菌性。西南地区WEP对金黄色葡萄球菌抑菌性最强,东北地区WEP对毛霉抑菌性最强,华东地区WEP对大肠杆菌、变形杆菌和产气杆菌抑菌性均最强。中国蜂胶水提物具有一定的抑菌活性,对5种受试菌抑制程度由大到小为:金黄色葡萄球菌(6.71± 2.97)mm>变形杆菌(6.48±2.89)mm>产气杆菌(6.3±2.78)mm>毛霉(3.57±3.38)mm>大肠杆菌(2.18±3.36)mm。
蜂胶,水提物,抑菌作用,琼脂扩散法,微量液体稀释法
蜂胶(Propolis)是西方蜜蜂采集植物树芽、树皮等部位的树脂,再混以蜜蜂舌腺、蜡腺等腺体的分泌物,经加工转化而形成的一种胶状物质。蜂胶富含多酚及类黄酮等活性物质[1-3],在西方一直作为民间药物使用。由于蜂胶的多数有效成分容易被醇提取,所以关于蜂胶醇提物的研究报道很多[4]。对中国不同地区蜂胶醇提物的抑菌性研究报道表明,蜂胶醇提物对真菌的抑菌性最强,革兰氏阳性菌次之,对革兰氏阴性菌最弱[5]。与醇提物相比,对蜂胶水提物(Water Extraction of Propolis,WEP)的研究报道较少,且多集中在对巴西蜂胶的研究上。巴西绿蜂胶用水可以得到更充分的提取。WEP中含有大量的酚酸类化合物,中国不同地区WEP中的酚类化合物化学成分差异明显[6]。Matsui研究表明,巴西WEP比醇提物有更好的抗氧化活性,可以更好地抑制一些酶的活性[7]。Arjun发现巴西和中国WEP比醇提物具有更强的DPPH自由基清除能力(但具体中国哪个地区蜂胶未知),与之相反,秘鲁蜂胶和荷兰蜂胶则是醇提物强于WEP[8]。WEP对化学和免疫学肝损伤模型都有保肝作用,并具有抗血小板凝结、抗炎、保护视神经、免疫调节、抗肿瘤和抗菌等活性[9-11]。WEP还可以避免醇提液产生的副作用[12],具有很好的应用前景。但目前尚没有关于中国蜂胶水提物的抑菌活性的报道。课题采集了来自中国26个不同地区的蜂胶样品,经水提分别获得其WEP,以4种细菌和1种真菌为受试菌种,采用琼脂扩散法和微量液体稀释法对比研究了WEP的抑菌圈大小和最小抑菌浓度,为中国蜂胶的开发利用提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
蜂胶原胶 26个蜂胶样品分别来自中国19个省份,以采集省份的拼音缩写作为样品代码[13];蜂胶原胶置于-18℃,变硬变脆后打成小碎块,去除杂质,用药材粉碎机粉碎,过40目筛后放于冰箱中备用;金黄色葡萄球菌(Staphylococcus aureu)、大肠杆菌(Escherichia coli)、变 形 杆 菌 (Proteusbacillus vulgaris)、产气杆菌(Clostridium perfringens)、毛霉(Mucor racemosus) 均由南昌大学微生物学实验室提供;蛋白胨、牛肉膏 北京奥博星生物技术有限责任公司;氯化钠、葡萄糖 分析纯;琼脂。
涂布棒,接种针,酒精灯,超净工作台,恒温培养箱。
1.2 实验方法
1.2.1 WEP的制备 WEP的制备方法[3]:取4.0g蜂胶,在120mL蒸馏水中混匀,在60℃下水浴提取7h。提取液离心30min,收集上清液。残渣在同样条件下再提取1次。合并提取液,于60℃真空旋转蒸发仪浓缩,得到固态WEP。使用时用蒸馏水复溶,配制成所需浓度待用。
1.2.2 抑菌圈的测定[1]采用琼脂扩散法:取直径5mm的圆形滤纸放入培养皿中,121℃高压蒸汽灭菌30min,烘干。将无菌滤纸片分别浸于的15mg/mL的WEP中。配制浓度为1.5×108cfu/mL的菌悬液,用5.0麦氏比浊法校正。将200μL各菌种悬浊液分别加入到固体培养基上,用三角涂棒涂布均匀,细菌使用肉汤培养基,真菌使用真菌培养基。将浸好的滤纸片用镊子轻贴于平板上,37℃恒温培养箱内培养。细菌培养24h,真菌培养48h后,用游标卡尺测量并记录抑菌圈直径。每个实验设置5个平行重复。
1.2.3 最小抑菌浓度的测定[14]采用微量液体稀释法:使用96孔细胞培养板,用无菌吸管吸取普通肉汤培养基和WEP(50mg/mL)各0.2mL,先在第一个孔混匀,再吸出0.1mL混匀液放入第二个孔中,加0.1mL普通肉汤混匀,再从第二个孔吸出0.1mL混匀液放入第三个孔中,加0.1mL普通肉汤混匀,以此类推,得到10个WEP浓度梯度的普通肉汤液体培养基(毛霉使用沙保罗氏液体培养基),然后在每孔中分别加入0.1mL浓度为1.5×108cfu/mL的菌悬液,混合均匀,将培养板放在37℃恒温培养箱内培养,细菌培养24h,真菌培养48h,观察实验菌生长情况,以不长菌的最小WEP浓度(mg/mL)为最小抑菌浓度。
1.2.4 数据统计 对于两组以上的均数比较,使用方差分析的方法最为适合,过程中进行单因素方差分析,所以课题采用SPSS v17.0软件对所得数据进行方差分析,小写字母代表是在0.05水平下比较,差异显著;大写字母代表在0.01水平下比较,差异极显著。
2 结果与讨论
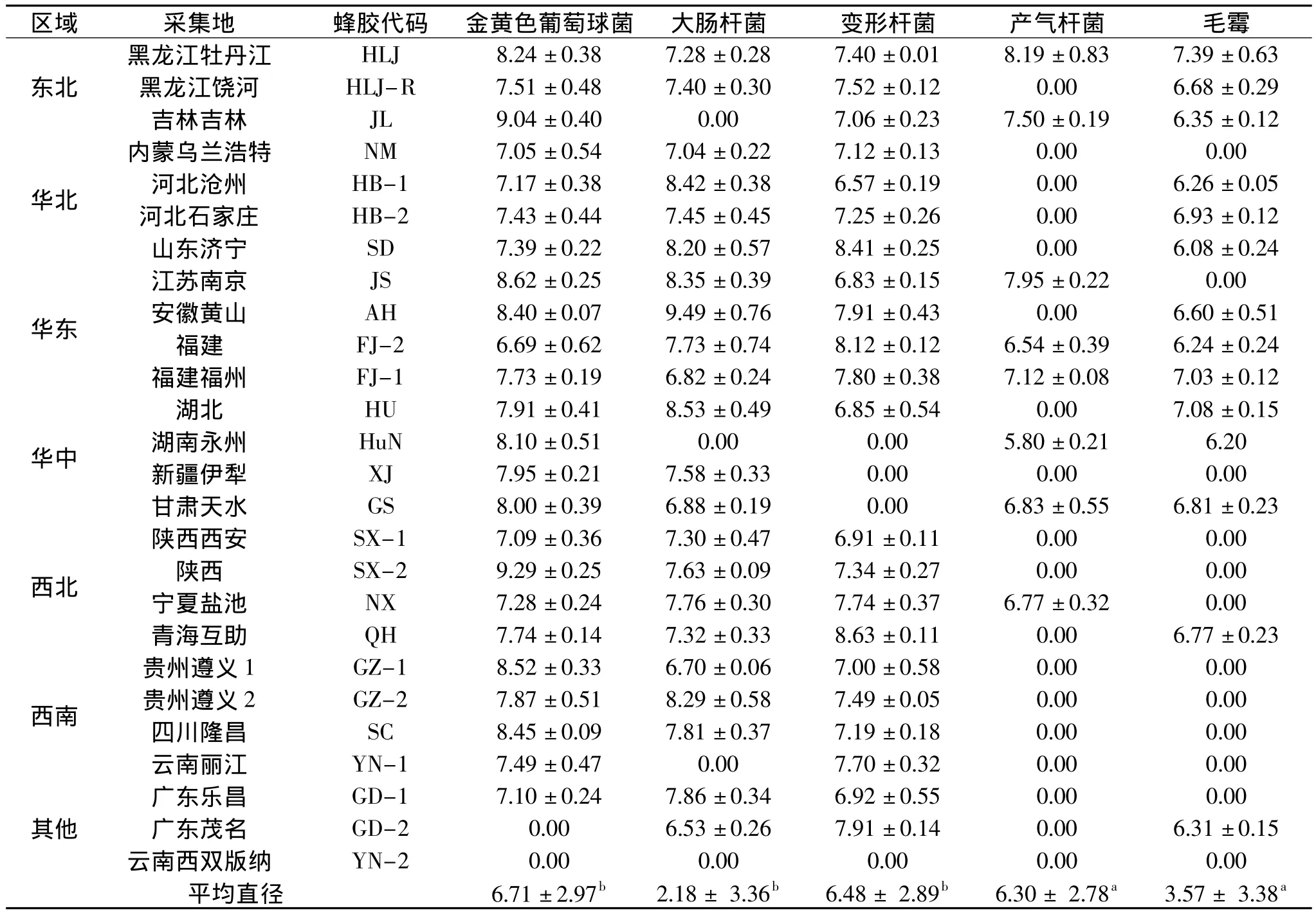
表1 中国不同地区蜂胶水提物对5种受试菌的抑菌圈直径(mm)Table 1 The inhibition zone diameter of the water extract of propolis from different areas of China(mm)
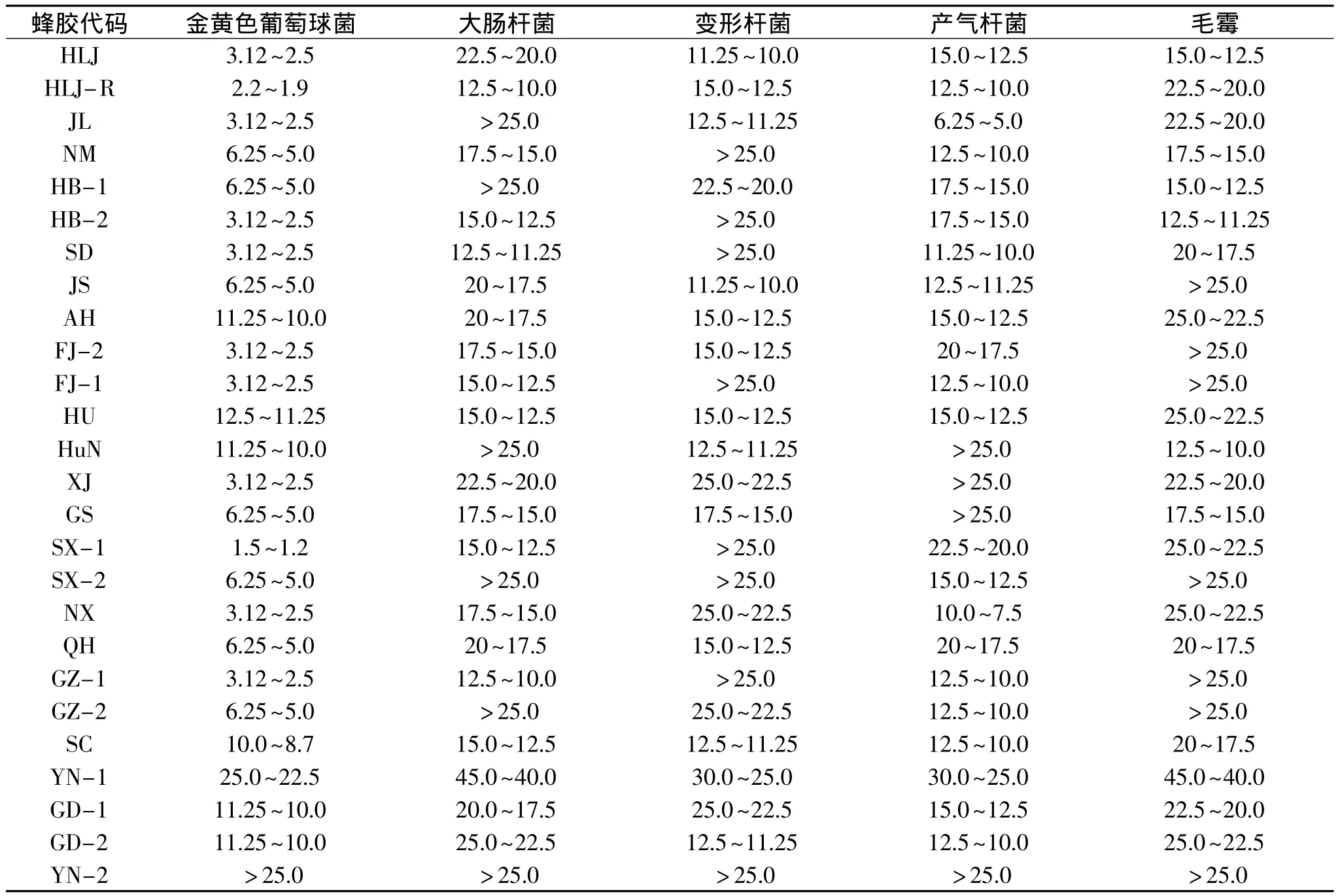
表2 中国不同地区蜂胶水提物对5种受试菌的最小抑菌浓度(mg/g)Table 2 Theminimum inhibitory concentration of water extraction of propolis from different areas of China(mg/g)
由中国不同地区WEP的抑菌圈(表1)和最小抑菌浓度(表2)的测定结果可知,除西双版纳WEP对所有受试菌种均不表现抑菌作用外,其余WEP均具有一定的抑菌作用,不同地区WEP抑菌作用有明显的差异。WEP对金黄色葡萄球菌都有明显的抑菌作用,大部分 WEP对大肠杆菌也有抑制作用,各地WEP对变形杆菌和毛霉的抑菌作用不显著。通过抑菌圈和最小抑菌浓度大小分析可知,抑菌圈越大,抑菌性越强,最小抑菌浓度越小,两者呈负相关性,WEP对5种受试菌种的抑菌程度由大到小是:金黄色葡萄球菌(6.71±2.97)mm>变形杆菌(6.48± 2.89)mm>产气杆菌(6.30±2.78)mm>毛霉(3.57± 3.38)mm>大肠杆菌(2.18±3.36)mm。将蜂胶按地理来源分类,各地区WEP对金黄色葡萄球菌、大肠杆菌、变形杆菌、产气杆菌和毛霉的抑菌性差异均显著(P<0.05),西南地区WEP对金黄色葡萄球菌抑菌性最强,东北地区WEP对毛霉抑菌性最强,华东地区WEP对大肠杆菌、变形杆菌、产气杆菌抑菌性均最强。
Supawadee[15]等研究了台湾WEP的抑菌作用,发现金黄色葡萄球菌比大肠杆菌对WEP更敏感,黑曲霉的敏感性最弱,和本实验结果类似。Kedzia等[16]研究报道:蜂胶抑菌性是由黄酮类、酚酸类和倍半萜类物质协同作用的结果,单一提取物成分的抑菌活性低于总提取物[17]。蜂胶醇提物抑菌作用的研究发现,革兰氏阳性菌对蜂胶醇提物的敏感性高于革兰氏阴性菌[18],Tegos[19]认为革兰氏阴性菌对蜂胶的敏感性较弱有2个原因:一是革兰氏阴性菌的外膜有抑制、延缓低浓度蜂胶提取液渗透的作用;二是革兰氏阴性菌存在可以将蜂胶提取液进行外排的物质。
3 结论
中国WEP有一定的抑菌作用,不同地区WEP抑菌作用有明显的差异。云南西双版纳蜂胶对受试菌种均没有表现出抑菌作用;革兰氏阳性菌对WEP的敏感性高于革兰氏阴性菌;WEP各单种化学成分同抑菌作用没有显著相关性,说明WEP表现出的抑菌作用是WEP中多类物质协同作用的结果中国蜂胶水提物仍然具有一定的利用价值。目前蜂胶的利用方式大多为醇提取,会造成部分有效成分的损失。由于天然优质蜂胶资源在我国非常稀缺,要充分利用这一珍贵资源,提高其利用率,而且可以对其WEP进行提取利用。建议进一步开展WEP其他生物活性的研究,以全面了解中国蜂胶,为进一步合理利用蜂胶提供理论依据。
[1]M C Marcucci.Propolis:chemical composition biological properties and the rapeutical activity[J].Apidologie,1995,26 (2):83-99.
[2]Y J Xu,L P Luo,Y X Fu,et al.Recent development of chemical components in propolis[J].Front Biol China,2009,4 (4):385-391.
[3]Nagai T,Inoue R,Inoueh,et al.Preparation and antioxidant properties of water extract of propolis[J].Food Chemistry,2003,80(1):29-33.
[4]徐元君,罗丽萍,丽艳,等.HPLC测定两种中国蜂胶醇提物化学组成[J].林产化学和工业,2010,30(2):61-66.
[5]龚上佶,郭夏丽,罗丽萍,等.中国不同地区蜂胶抑菌性研究[J].北京工商大学学报:自然科学版,2011,29(2):23-27.[6]陈滨,罗丽萍,徐元君,等.反相高效液相色谱法测定蜂胶水提物中的酚类化合物[J].分析化学,2009,37(12):1786-1790.
[7]Manih C R,Damasceno E L B,Novelli E A M,et al.Propolis: effect of different concentration extract and intake period on seric biochemical variables[J].Journal of Ethnopharmacology,2006,20 (5):496-501.
[8]胡福良.蜂胶的提取方法[J].养蜂科技,2000(5):28-49.
[9]Han S,Sung KH,Yim D,et al.Activation of murine macrophage cell line RAW 264.7 by Korean propolis[J].Archives of Pharmacal Research,2002,25:895-902.
[10]NagaiT,Inoueb R,Inouebh,etal.Preparation and antioxidant properties of water extract of propolis[J].Food Chemistry,2003,80:29-33.
[11]Yildirim Z,Hacievliyagil S,Kutlu N O,et al.Effect of water extract of Turkish propolis on tuberculosis infection in guineapigs[J].Pharmaceutical Research,2004,49:287-292.
[12]Nakajima Y,Shimazawa M,Mishima S,et al.Water extract of propolis and its main constituents,caffeoylquinic acid derivatives, exert neuroprotective effects via antioxidant actions[J].Life Sciences,2007,80:370-377.
[13]Luo L P,Li Y,Xu Y J,et al.Chemical compositions and antioxidant activities of ethanol extract of Chinese propolis[C]. Proceedinegs of International Conference of Natural and Traditonal Medicine,2009(12):435-439.
[14]Murray P R,Baron E.Manual of Clinical Microbiology[M]. 6th ed.Washington,D C:American Society for Microbiology,1995,44:213-218.
[15]Supawadee U,Songchan P,Chanpen C,et al.Propolis from Thailand:antimicrobial,antiproliferative and cytotoxic activities[J].The American Journal of Chinese Medicine,2005,37(9): 855-865.
[16]Kedzia B,Grppert B,Iwaszkiewicz J.Pharmacological investigations of ethanolic extract of propolis[J].Phytotherapie,1990(6):7-10.
[17]Bonvehi S J,Coll V F,Jorda E R.The composition,active components and bacteriostatic activity of propolis on dietetics[J]. Journal of the American Oil Chemists Society,1994,71:529-532.
[18]Garedew A,Schmolza E,Lamprechtb I.Microbiological and calorimetric investigations on the antimicrobial actions of different propolis extracts:an in vitro approach[J].Thermochimica Acta,2004,422:115-124.
[19]Tegos G,Stermitz F R,Lomovskaya O,et al.Multidrug pump inhibitors uncover remarkable activity of plant antimicrobials[J]. Antimicrob Agents Chemother,2002,46(10):3133-3141.
Antimicrobial activity of water extract of propolis from different areas of China
HAO Yin-bo,WU Xue-zhi,LUO Li-ping*,GUO Xia-li,ZHANG Xi,DAI Xi-mo,CHEN Bin
(School of Life Science and Food Engineering,Nanchang University,Nanchang 330031,China)
In order to identify the antimicrobial activity of water extract of propolis from different areas of China,water extract of propolis(WEP)from 26 areas of China were selected and studied in this paper,agar diffusion method and microdilution broth susceptibility assay were employed to measure the zones of inhibition and the minimum inhibitory concentration of WEP on Staphylococcus aureus,Escherichia coli,Proteusbacillus vulgaris,Clostridium perfringens,Mucor racemosus,respectively.The results suggested that WEP had antimicrobial activity,except for the WEP from YN-2.The WEP of southwest exhibited the highest antimicrobial activity against S.aureus,WEP of northeast exhibited the highest antimicrobial activity against M.racemosus,and the WEP of east of China exhibited the highest antimicrobial activity against E.coli,P.vulgaris and C.perfringens.WEP of China had some antibacterial activity,the relative order of sensitivity of the 5 different strains from the most to least were S.aureus(6.71±2.97)mm>P.vulgaris (6.48±2.89)mm>C.perfringens(6.3±2.78)mm>M.racemosus(3.57±3.38)mm>E.coli(2.18±3.36)mm.
propolis;water extract;antimicrobial activity;agar diffusion method;microdilution broth susceptibility assay
TS201.2
A
1002-0306(2012)10-0101-04
2011-07-07 *通讯联系人
郝胤博(1986-),男,硕士研究生,研究方向:植物资源与系统植物学。
国家自然科学基金(31071551);南昌大学食品科学与技术国家重点实验室开放基金(SKLF-KF-201003)。

