灰树花固体发酵茶青的研究
马立青,郭丽琼,2,林俊芳,2,*,邹毓琳
(1.华南农业大学食品学院生物工程系,广东广州510640; 2.华南农业大学生物质能研究所,广东广州510640)
灰树花固体发酵茶青的研究
马立青1,郭丽琼1,2,林俊芳1,2,*,邹毓琳1
(1.华南农业大学食品学院生物工程系,广东广州510640; 2.华南农业大学生物质能研究所,广东广州510640)
以茶青为发酵培养基质,对灰树花固体发酵过程中的各种内含物含量的变化及其品质进行了研究。结果表明,灰树花的最佳发酵培养基成分及培养条件:中叶茶,2%大豆粉,接种量1%,培养温度25℃,培养时间9d。发酵后其菌质的有效成分为:茶多酚1.78%,游离氨基酸0.77%,酚氨比2.3,多糖4.69%。与发酵前比较其多糖含量增加了31.7%,茶多酚降解了77.8%,游离氨基酸降低了26.7%,酚氨比降低了69.9%,茶叶品质得到很大改善。
多糖,茶多酚,氨基酸,茶青
1 材料与方法
1.1 实验材料
灰树花菌株GF2号 本实验室保存;茶青 选用茶树品种金萱的嫩叶(一芽四叶)、中叶(五到七叶)、老叶(七叶以上)为材料,采摘于华南农业大学宁西教学基地,蒸汽杀青、干燥备用;大豆 辅料,华南农业大学农学院赠送;土豆、玉米、麸皮、荞麦、燕麦、大米 辅料,均为市售;土豆用30倍量的沸水煮30min取滤液,玉米等粉碎并过60目筛;驯化培养基3%金萱中叶茶青,97%PDA固体培养基;茶固体培养基 茶青添加量为35%,辅料添加量为2%,自然pH。

表1 不同老嫩度茶青对菌质活性成分及灰树花生长速度的影响Table 1 Effect of old tender degree on the active ingredient of fungal substance and the growth rate of Grifola frondosa
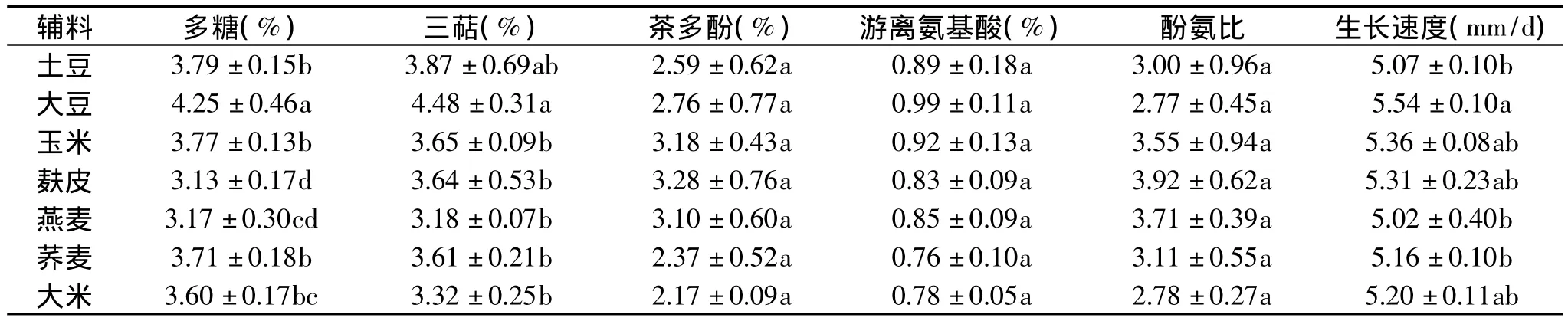
表2 不同辅料对菌质活性成分及灰树花生长速度的影响Table 2 Effect of different excipients on the active ingredient of fungal substance and the growth rate of Grifola frondosa
1.2 实验方法
1.2.1 菌种驯化及固体发酵 从母种斜面上接约0.5cm2大小的菌块到驯化培养基中,25℃恒温培养7d,制得驯化菌种;取1%的驯化菌种接到茶固体培养基中,25℃恒温培养9d,收集菌质置于60℃干燥箱内烘干,磨碎过60目筛。
1.2.2 实验设计
1.2.2.1 灰树花固体发酵不同老嫩度茶青的研究将嫩叶、中叶、老叶分别按35%的量与2%的大豆混匀,含水量为63%,25℃恒温培养9d,收集菌质烘干待测,共3个处理,每个处理3个重复。
1.2.2.2 不同辅料对灰树花固体发酵基质的影响将大豆、土豆、玉米、麸皮、荞麦、燕麦、大米各按2%分别添加到中叶培养基中,其他条件不变,共7个处理,每个处理3个重复。
1.2.2.3 灰树花固体发酵茶青过程的内含物质的变化 35%的中叶与2%的大豆混匀,其他条件不变,以接种时为起点,在之后的0,3,6,9,12,15,18,21,24d取样烘干测定各活性成分,每次3个重复。
1.2.3 茶多酚的测定 Folin试剂比色法(GB/T8313-2008)。
1.2.4 游离氨基酸总量的测定 按参考文献[9]进行测定。
1.2.5 多糖的测定 按参考文献[10]的方法进行测定。
1.2.6 三萜的测定 称取0.25g的茶菌质,加40mL无水乙醇用超声波处理1h,温度控制在8℃左右,然后过滤收集滤液,定容至50mL。测定方法参考文献[11-12]略作修改。
1.2.7 酚氨比的计算 酚氨比=茶多酚总量/游离氨基酸总量。
1.2.8 数据处理 实验数据采用SPSS17.0软件进行方差分析,实验数据以平均值 ±标准误差的形式表示。
2 结果与分析
2.1 灰树花固体发酵不同老嫩度茶青的研究
茶青的老嫩程度不同,其内在化学物质含量不同,对药食用菌固体发酵有一定的影响。如表1所示,发酵后,中叶多糖含量最高,显著高于老叶,与嫩叶无显著性差异;三萜随着茶青老化而显著增加;茶多酚、氨基酸、酚氨比随茶青的老化而降低;中叶的生长速度最快,与嫩叶、老叶呈极显著性差异,可能由于嫩叶中茶多酚含量较多,抑制了灰树花的生长,同时,由于嫩叶基质质地幼嫩,木质素、纤维素等含量相对较低[13],培养基配比不均衡。而老叶也是如此。综合考虑,中叶培养基是灰树花固体发酵的最适培养基。
2.2 不同辅料对灰树花固体发酵基质的影响
不同辅料其含碳量、含氮量各不相同,在培养基中加不同辅料,可优化其碳氮比,有利于食用菌的生长。从表2中可以看出,添加大豆辅料,其多糖、三萜含量显著高于其他辅料,生长速度也是如此,而茶多酚、氨基酸和酚氨比无显著性差异,可能是由于添加大豆而调节培养基的碳氮比,更适宜灰树花的生长和代谢产物多糖的积累。综合考虑,选择大豆为灰树花固体发酵的最佳辅料。
2.3 灰树花固体发酵茶青过程的内含物质的变化
对灰树花固体发酵茶青的过程进行了研究,结果如图1、图2所示,前3d多糖含量呈现降低趋势,第3d多糖降到最低,3~9d多糖的合成处于快速增长期,9d之后增长趋势减缓,直至18d以后多糖的合成才基本稳定并达到最高值 5.14%,多糖增长了44.38%,前3d灰树花处于生长期,利用了茶叶中的一部分多糖,之后灰树花代谢合成多糖并积累;而三萜含量在0~9d之间呈明显的下降趋势,9~15d又有缓慢的上升趋势,到15d三萜增长了5.55%,15d之后三萜含量开始下降,这可能是底物已经耗尽,灰树花利用了三萜,并可能转化为其他有效活性成分;酚氨比6~9d急剧下降,前6d下降趋势较缓和,9d后基本稳定,第12d酚氨比达到最小值 1.56,降低了79.6%左右,12d以后稍微有上升的趋势,但变化不大;茶多酚的变化趋势与酚氨比相一致,一直处于降低的趋势,降低了77.8%左右;氨基酸自始至终变化较小,第9d达到最低0.77%,降低了26.7%,后期缓慢上升。茶多酚和氨基酸的降低可能是由于6~9d是灰树花的对数生长期,代谢活性最强,底物利用率最高。其五个指标在第9d都趋于稳定,并达到最佳状态,因此灰树花固体发酵茶青的最佳发酵时间为9d。
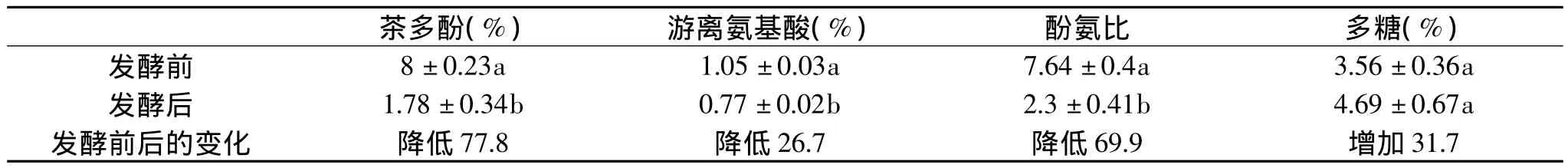
表3 发酵前后菌质主要呈味物质的变化Table 3 Changes of the main components of savor of fungal substance in before and after fermentation
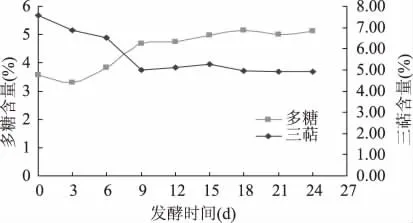
图1 灰树花固体发酵菌质多糖和三萜的动态变化图Fig.1 Dynamic change of the polysaccharide and the triterpene of fungal substance in solid-state fermentation of Grifola frondosa
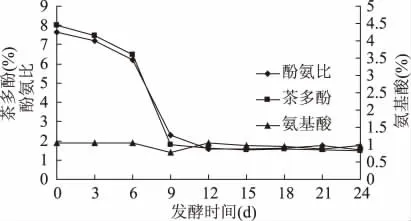
图2 灰树花固体发酵菌质品质的动态变化图Fig.2 Dynamic change of the quality of fungal substance in solid-state fermentation of Grifola frondosa
以灰树花固体发酵的第9d为发酵终点,比较发酵前后菌质呈味物质的变化。如表3所示,发酵后茶多酚从8%降低为1.78%,降低了77.8%,游离氨基酸从最初的1.05%降低为0.77%,降低了26.7%,酚氨比则降低了69.9%,这三者的变化呈显著性差异,而多糖从起初的3.56%增加到4.69%,增加了31.7%,但无显著性差异。
3 结论与讨论
在本研究的前期实验中,我们选用了灵芝的美国灵芝、泰山灵芝、甜芝、鹿角灵芝、京大、韩国灵芝,灰树花的灰树花1号、灰树花2号、灰树花,猴头菇的常山猴头、常山99、猴头王、猴头BJ-5、大猴头、猴头T3、猴头菇、猴头六号共17个菌株在茶叶培养基上进行了驯化及培养实验,结果表明灰树花GF2号菌株的生长速度最快,产多糖量最多,因此选择该菌株作为本次实验的菌株。
通过实验发现茶青的老嫩程度对灰树花的生长速度、多糖的形成及发酵后基质风味的变化影响较大,选择中叶为最佳培养基。林戎斌等人[14]研究发现灵芝发酵茶最适茶培养基为茶青,并未研究茶青的老嫩度。陈济琛等人[15]将低档茶叶作为发酵培养基,使其被灵芝发酵,产生的菌质提取液对提高小鼠腹腔巨噬细胞吞噬功能和血清溶血素水平有显著的效果。
辅料的种类显著影响灰树花的生长速度、多糖和三萜的含量,而茶多酚、氨基酸和酚氨比无显著性差异。辅料的添加优化了培养基的碳氮比,利于灰树花的生长和活性物质的形成,而对培养基原内含物的影响无显著性差异。
茶叶滋味主要是由茶多酚(苦涩味)、氨基酸(鲜爽味)、水溶性糖(回甘味)等物质组成,酚氨比是茶叶主要呈味物质含量协调的综合反映,比值的高低反映了茶叶的滋味,比值越高,苦涩味越浓,滋味越差,酚氨比值越低,则越醇和,滋味越好[13],本研究的酚氨比显著降低了69.9%;据报道水溶性多糖含量越高,茶的回甘性越好,茶叶品质越佳[16]。本研究的发酵茶水溶性多糖含量为4.69%,比林新坚等[17]研制的灵芝发酵茶中的水溶性多糖为1.2%有明显提高。因此,灰树花固体发酵茶青后,其菌质的风味和保健功效有很大提高,对粗老鲜叶的开发与利用有重要的指导意义。
[1]Ohno N,Adachi Y,Suzuki L,et al.Characterization of the antitumor glucan obtained from liquid-cultured Grifola frondosa[J].Chem Pharm Bull,1986,34:1709
[2]Kodama N,Asakawa A,Inui A,et al.Enhancement of cytotoxicity of NK cells by D-fraction[J].A Polysaccharide from Grifola frondosa Oncology Reports,2005(13):497-502.
[3]Mayell M.Maitake extracts and their therapeutic potential[J].Alternative Medicine Review,2001(6):48-60.
[4]Kubo K,Nanba H.Modification of cellular immune responses in experimental autoimmune hepatitis in mice by Maitake(Grifola frondosa)I[J].Mycoscience,1998,39:351-360.
[5]Nanba H,Kodama N,Schar D,et al.Maitake(Grifola frondosa)can maintain the health of people suffering with HIV infection[C]In:Broderick A,Nair N G T.Proceedings of the 3rd International Conference on Mushroom Biology and Mushrooms Products,Sydney,Australia,1999:194-198.
[6]Nanba H,Kodama N,Schar D,et al.Effects of maitake (Grifola frondosa)glucan in HIV-infected patients[J]. Mycoscience,2000,41:293-295.
[7]Hishida I,Nanba H,Kuroda H.Antitumor activity exhibited by oral administered extract from fruit body of Grifola frondosa (Maitake)[J].Chem Pharm Bull,1988,36:1819-1827.
[8]Suzuki Y,Adachi Y,Ohno N,et al.Th1/TH2-balancing immunomodulating activity of gel-forming(1→3)-beta-D-glucans form fungi[J].Biol Pharm Bull,2001,24:811.
[9]刘晓霞,周国兰,何萍,等.茶叶游离氨基酸及其总量的国标法测定探讨[J].贵州茶叶,2008(1):13-17.
[10]徐志祥,李刚,李宝健.硫酸-苯酚法测定灵芝多糖含量的条件研究[J].食用菌,2000(3):6-7.
[11]江绍琳,江绍玫,曾令聪.分光光度法快速测定灵芝中总三萜含量[J].江西农业大报,2006,28(4):634-636.
[12]弓晓峰,谢明勇,陈奕.黑灵芝中三萜及其皂苷类化合物总量的光度测定[J].天然产物研究与开发,2006,18(5): 825-829.
[13]邬龄盛.菌类保健茶研究初报[J].福建茶叶,2001(3): 20-21.
[14]林戎斌,陈济琛,郑永标,等.三种药用菌发酵茶的最适茶培养基[J].食用菌学报,2004,11(3):38-42.
[15]陈济琛,郑永标,林新坚,等.灵芝发酵茶对小鼠溶血素和细胞免疫影响的研究[J].福建农业学报,2003,18(2): 127-128.
[16]邬龄盛,王振康.药用真菌对低档茶叶品质提高的几点认识[J].茶叶科学技术,2000(3):19-20.
[17]林新坚,郑力,陈济琛,等.灵芝发酵茶研制初报[J].食用菌,2000,22(5):41.
Study on solid-state fermentation of Grifola frondosa with tea green as the substrate
MA Li-qing1,GUO Li-qiong1,2,LIN Jun-fang1,2,*,ZOU Yu-lin1
(1.College of Food Science,South China Agricultural University,Guangzhou 510640,China; 2.Institute of Biomass Research South China Agricultural University,Guangzhou 510640,China)
Contents changes of various components and quality of the tea green in fermentation of Grifola frondosa was studied.The optimum medium components and culture conditions were determined as follows:Medium tea green,soybean powder 2%,inoculation amount 1%,temperature 25℃and fermentation time 9d.After fermentation,the effective components of fungal substance were studied as follows:Tea polyphenols 1.78%,free amino acid 0.77%,polyphenols/amino acid value 2.3,polysaccharide 4.69%.Compared with the raw fungal substance,polysaccharides was increased by 31.7%,tea polyphenols were decreased by 77.8%,free amino acids were decreased by 26.7%and the proportion of polyphenol and amino acid was decreased by 69.9%,which revealed that the tea quality was improved greatly.
polysaccharide;tea polyphenols;amino acid;tea green
TS201.3
A
1002-0306(2012)10-0228-04
灰树花(Grifola frondosa)又名贝叶多孔菌、千佛菌、栗子蘑、云蕈、莲花菌等,日本称之舞茸。其子实体中富含氨基酸、多糖以及微量元素等,其中灰树花多糖是主要的生物活性成分[1]。大量的药理药效的研究证明,灰树花多糖具有显著的抗肿瘤[2]、降血糖、抗肝炎[3-4]、抗HIV病毒[5-6]以及改善免疫系统[7-8]等功效。茶叶营养成分丰富,富含多种蛋白质、氨基酸、生物碱、咖啡因、茶多酚、茶多糖、茶色素和多种维生素及矿物质,具有较好的保健功效。随着茶叶生产和茶叶市场的快速发展,在茶叶种植和生产过程中,数量庞大的茶场修整枝叶和茶厂废碎茶末,抛之可惜甚至污染环境,用之无法或者效率低、价值差。我国产茶大省云南、福建、浙江等尤为突出。仅就云南省的调查结果,现有茶叶种植面积280万亩,年产茶叶10万余t,每年自修整、采摘、加工过程中,约有30%即3万余t成为废枝叶、茶末被遗弃。对于价值较低的粗老茶鲜叶(粗老叶、秋冬修剪叶、废碎茶)进行精细加工,实现低档原料的深度开发和综合利用,变废为宝,对提高茶叶生产的经济效益是十分必要的。此研究是用灰树花直接作用于以粗老茶叶、秋冬修剪叶为主要原料的固体培养基,并对其进行固体发酵以达到改善茶品质的目的。
2011-01-10 *通讯联系人
马立青(1983-),女,硕士研究生,研究方向:微生物资源开发与利用。
国家自然科学基金项目(31071837);广东省科技计划(2009B020201012)。

