液相色谱-电喷雾离子阱质谱分析乌头碱及其代谢物
陈学国,赖永权,蔡宗苇
(1. 中国刑事警察学院法医系,辽宁 沈阳 110854; 2. 香港浸会大学化学系,香港特别行政区 999077)
2011-07-15;
2011-10-11
香港浸会大学项目(FRG/08-09/II-01)资助
陈学国(1977~),男(汉),副教授,从事毒物、毒品分析。E-mail:chenxg@dicp.ac.cn
蔡宗苇(1962~),男(汉),教授,从事药物、环境污染物分析。E-mail:zwcai@hkbu.edu.hk
液相色谱-电喷雾离子阱质谱分析乌头碱及其代谢物
陈学国1,2,赖永权2,蔡宗苇2
(1. 中国刑事警察学院法医系,辽宁 沈阳 110854; 2. 香港浸会大学化学系,香港特别行政区 999077)
为了研究乌头碱的生物转化规律,建立了乌头碱及其代谢物分离与鉴定的液相色谱-电喷雾离子阱质谱(LC-ESI-ITMS)方法。首先利用体外代谢法得到大鼠肝微粒体S9组分中乌头碱及代谢产物混合体系,然后利用LC-ESI-ITMS联用技术对各代谢物进行分析,得到乌头碱代谢物的[M+H]+分子质量信息,进一步结合多级串联质谱(LC/MSn)分析结果获得结构信息,对代谢物进行鉴定,从而推测代谢物结构,并结合大鼠尿中乌头碱及其代谢物的分析结果,得到乌头碱的生物转化规律。本方法在大鼠肝微粒体S9组分中鉴定得到8种体外代谢产物。
液相色谱-电喷雾离子阱质谱;肝微粒体;乌头碱;代谢
肝脏是生物体药物代谢的主要器官,研究药物的肝脏代谢对于研究药物体内代谢非常重要[1]。作为研究药物代谢的经典方法,体外肝脏代谢不仅可以排除体内因素的干扰,还可以直接观察酶对底物的选择性代谢,为药物的整体试验提供可靠的理论依据,尤其是对于那些体内代谢转化率低、毒性大、缺乏灵敏检测手段的药物来说,体外肝脏代谢研究已经成为行之有效的研究手段[2]。
作为药物分析领域最强有力的分析检测技术,液相色谱-质谱(LC/MS)联用技术已经在环境分析、生化分析、药物分析等领域得到广泛应用[3],并显示出灵敏度高、专属性好、样品处理简单等优越性。离子阱质谱(ITMS)不仅可以给出样品分子质量的相关信息,而且还可以给出有关样品结构的丰富信息[4]。由于具有灵敏度高、选择性好等特点,液相色谱-电喷雾离子阱质谱(LC-ESI-ITMS)联用已经成为药物代谢研究的有力工具和代谢物结构分析的重要方法[5]。基于LC-ESI-ITMS技术,已经建立了药物及其代谢物快速高通量分析方法,并成功用于多种药物及其代谢产物的分离与鉴定[6-7]。
毛莨科乌头属植物是我国著名的传统中药,具有祛风除湿、镇痛、抗肿瘤等功效,广泛用于治疗风湿麻痹、关节疼痛、心腹冷痛等疾病,乌头碱是该类植物的主要活性成分,也是含量最高、毒性最大的成分[8]。乌头碱为C19双酯二萜类生物碱,具有较强的毒性,人口服0.2 mg即可中毒,临床应用该药物时极其慎重,一旦使用不当即可导致中毒,严重者可能危及生命,由于使用不当而造成中毒甚者致死的情况时有发生[9]。因此,研究乌头碱及其代谢产物,明确生物转化规律,对于该类药物的临床使用和中毒检验等具有重要意义。针对不同检材中的各种乌头生物碱及其代谢物,国内外学者已经建立了多种样品处理方法和检测技术,气相色谱-质谱联用法[10]、液相色谱法[11]、液相色谱-质谱联用法[12]、毛细管电泳[13]等也被广泛用于乌头生物碱分析,并已经成为乌头生物碱及其代谢物检测的主要方法。生物体内代谢后,乌头碱主要通过脱乙酸基、脱苯甲酰基、脱甲基和酯化反应等,得到乌头次碱、乌头原碱、去甲基乌头碱、去双甲基乌头碱、去乙基乌头碱等单酯型、双酯型和脂类代谢产物[14]。另外,结合体外代谢研究方法,在乌头碱代谢产物中也检测到去氢乌头碱、去氧乌头碱等代谢产物[15]。
本研究建立了乌头碱及其代谢物分离与鉴定的LC-ESI-ITMS方法。该方法利用体外代谢方法得到大鼠肝微粒体S9组分中乌头碱及代谢产物混合体系,然后借助LC-ESI-ITMS法对各代谢物进行分析,得到乌头碱代谢物的分子质量信息,进一步结合多级串联质谱(LC/MSn)获得结构信息,对其代谢物进行鉴定。
1 实验部分
1.1仪器与实验条件
1.1.1色谱条件 液相色谱-电喷雾离子阱质谱系统由HP 1100液相色谱仪(Hewlett-Packard,Wilmington,DE,USA)和Esquire 4000离子阱质谱仪(Bruker-Fransen,Bremen,Germany)组成;色谱柱:Waters Symmetry C18柱(150×2.1 mm,3.5 μm);流动相A为0.1 mM乙酸铵-甲酸缓冲溶液(pH 4.5),流动相B为乙腈-0.1 mM乙酸铵-甲酸缓冲溶液)(V(乙腈)∶V(0.1 mM乙酸铵-甲酸缓冲溶液)=90∶10,pH 4.5),流速为0.20 mL/min,起始梯度为5%B,在20 min内线性增加至90%B,维持5 min,进样量为5 μL。
1.1.2质谱条件 电喷雾离子化源(ESI),正离子方式检测,全离子扫描模式,扫描范围为m/z50~1 000;电喷雾气(N2)温度为350 ℃,流量为8.0 L/min;源内碰撞诱导解离气为氦气;MSn通过利用总离子流控制单元(ICC)自动调整积分时间实现。
1.2试剂与动物
乙腈(色谱纯):美国Tedia(Fairfield, OH)公司产品;甲酸、乙酸铵、磷酸二氢钾(分析纯):Mallinckrodt(Paris, KY, USA)公司产品;乌头碱标准品(纯度>99.9%)、二甲亚砜(DMSO,纯度>99.9%)、还原型烟酰胺腺嘌呤二核苷磷酸(NADPH):美国Sigma公司(St. Louis, USA)产品;纯水经Milli-Q水处理系统(Millipore, USA)纯化。雄性SD大鼠购自香港中文大学实验动物中心。
1.3肝微粒体S9组分的制备
SD大鼠断头处死后,放血,以冰冷生理盐水由肝门静脉冲洗肝,去除肝中残余血液,取出肝脏,称重,用预先冷冻的0.10 mol/LKCl-PBS缓冲溶液(pH 7.4)洗净,剪碎,制成肝匀浆(1 g肝/5 mL KCl-PBS缓冲溶液),以9 000 r/min于4 ℃离心10 min,弃去上层脂质和下层沉淀物后的上清液即为大鼠肝微粒体S9组分。大鼠肝微粒体S9组分中蛋白质和细胞色素P450含量分别用Bradford法和Omura法测定,分别为10.34 g/L和0.05 nmol/L。
1.4体外代谢与样品处理过程
“这件事太复杂了,不能简单去理解。S想一劳永逸地解决问题。但这两个女人都给了他共同的感受,那就是压抑、冲突和痛苦。S遇到Y时,对命运感激不已。他羞怯内向,恐惧于跟人打交道,他不是一个爱追逐女人的人,那是迫不得已。世上若有一个女人能使他平静,那就是Y。他终于跟Y在一起了,却依然没法安宁。或者说,Y正在变得枯竭及死寂,S眼前浮现了一句唐诗:千山鸟飞绝,万径人踪灭。Y犹如一颗正在塌缩的星球。当然,他们仍会睡觉,有时还是Y主动邀请。但S知道这是怎么回事。这连跟曲做爱都不如。”
将乌头碱标准品用DMSO配制成浓度为2 mmol/L标准溶液,取5 μL标准溶液置于试管中,加入495 μL 0.1 mol/L KCl-PBS缓冲溶液(pH 7.4),再加入适量NADPH,使NADPH浓度为3 mM,混匀后置于37 ℃水浴中预孵育5 min,然后,加入500 μL蛋白质浓度为2.0 g/L肝微粒体S9组分KCl-PBS缓冲溶液,得到乌头碱孵育体系,其中乌头碱、NADPH和肝微粒体蛋白质浓度分别为10 μmol/L、1.5 mmol/L和1.0 g/L。然后,置于37 ℃水浴中孵育0 min和60 min后,分别取50 μL孵育混合溶液,加入150 μL乙腈,混匀后置于冰浴中5 min,终止反应。最后,以14 000 r/min离心5 min后取上清液,氮气吹干后,加入100 μLV(乙腈)∶V(水)=80∶20的溶液溶解,供LC/MS测定。
1.5尿样收集与处理
将5只雄性SD大鼠,体重为(590±5) g,置于代谢笼中,禁食12 h,收集尿样作为空白对照尿样,然后,将乌头碱标准品按照0.2 mg/kg剂量灌胃给药,收集所有大鼠0~24 h尿样,置于-20 ℃冷冻保存。
取解冻后的1.0 mL尿样,冷冻干燥后,加入0.5 mLV(乙腈)∶V(水)=80∶20的溶液溶解,以14 000 r/min离心5 min后取上清液,供LC/MS测定。
2 结果与讨论
根据文献报道[12],本研究首先以乌头碱为研究对象,考察乌头碱的色谱行为和质谱响应值,优化乌头碱及其代谢物分析的LC-ITMS分析色谱、质谱条件,乌头碱在优化实验条件下分析得到的LC-ITMS谱图,示于图1。
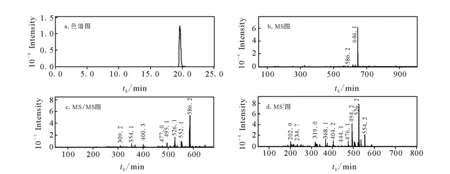
图1 优化实验条件下乌头碱的LC-ITMS谱图Fig.1 LC-ITMS spectra of Aconitine
在优化实验条件下,对乌头碱及其体外代谢产物混合体系进行LC-ITMS全离子扫描模式分析,得到LC-ITMS谱图。根据药物在肝微粒体中的代谢规律[16],结合LC-ITMS谱图,通过比较乌头碱在大鼠肝微粒体S9组分中孵育60 min和0 min后的LC-ITMS谱图,根据[M+H]+分子质量信息,初步鉴定出8种代谢产物。乌头碱及8种体外代谢产物的LC-ITMS谱图示于图2,相应的色谱保留时间和[M+H]+分子质量信息列于表1。
利用LC-ITMS全扫描模式对乌头碱及其代谢产物进行初步鉴定,只能根据所测到的[M+H]+离子质量信息得到,为了进一步确定代谢物的结构,可以借助LC/MSn进行深入分析,结合准分子离子、二级串联质谱和三级串联质谱分子碎片离子峰,最终确定其结构。利用多级串联质谱法分析初步鉴定出的乌头碱及8种代谢产物,结合相关文献报道,进一步确定了乌头碱和8种代谢产物的结构,相应的质谱数据列于表1和图3~10。
保留时间为19.3 min的化合物M0,其准分子离子m/z646.2,与乌头碱的质子化分子[M+H]+一致,如图1所示,二级串联质谱(MS/MS)中基峰离子m/z586.2,三级串联质谱(MS3)基峰离子m/z526.2与乌头碱标准品的色谱保留时间及各级质谱行为相同,鉴定其为乌头碱。
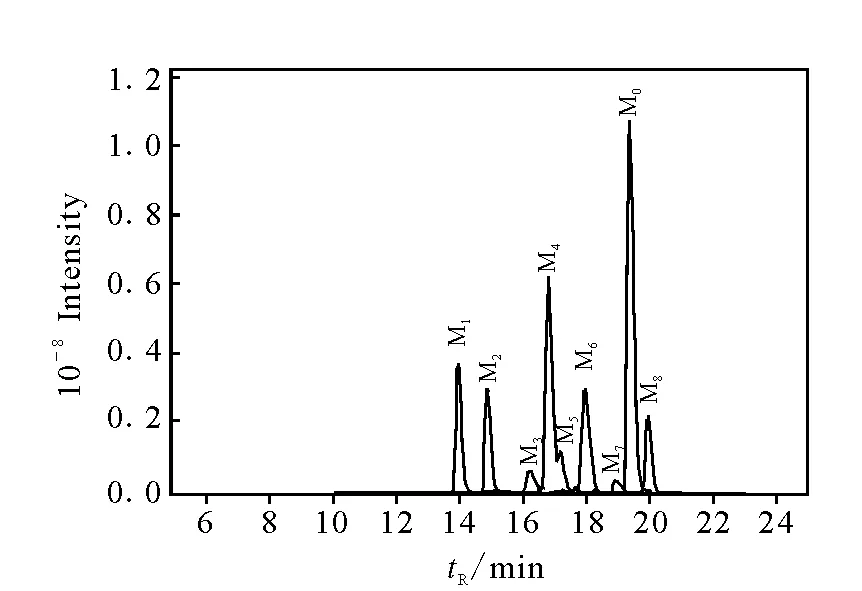
图2 优化条件下乌头碱及其体外代谢产物LC-ITMS谱图Fig.2 LC-ITMS spectrum of Aconitine and its metabolites
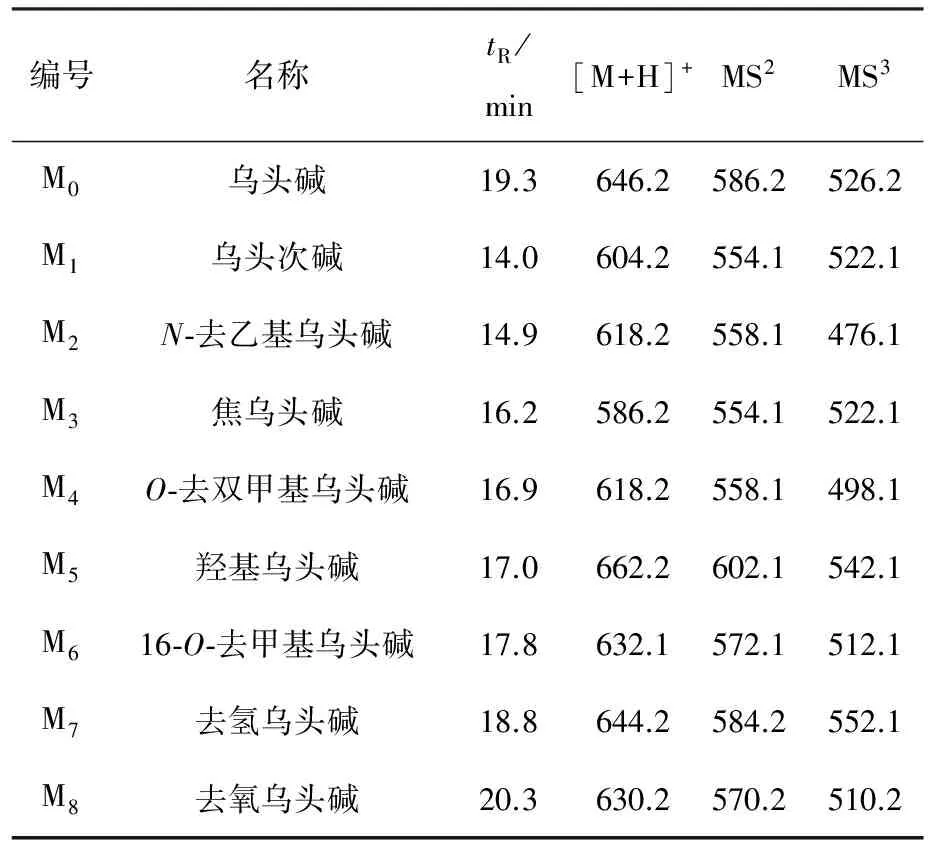
表1 乌头碱及其8种代谢物的保留时间和分子质量信息 Table 1 Retention time and mass spectra of Aconitine and its metabolites
如图3所示,化合物M1的色谱保留时间为14.0 min,准分子离子m/z604.2,相对于乌头碱在相同条件下所得到的基峰离子减少42 u,说明二者具有相同的骨架结构,已有文献报道[17],42 u的中性丢失为脱去乙酰基造成的,在软电离条件下检测到m/z554.1和m/z522.1的碎片离子分别为二级和三级串联质谱的基峰离子,推断该化合物为乌头碱结构中醋酸酯水解形成的乌头次碱,该鉴定结果与文献中报道关于乌头次碱的质谱行为相符。化合物M3色谱保留时间为16.2 min,准分子离子m/z586.2,相对于乌头碱的基峰离子减少了60 u,软电离条件下经过二级串联质谱分析,得到基峰碎片离子[M+H-32]+(m/z554.1),三级串联质谱分析,得到主要碎片离子[M+H-32-32]+(m/z522.1),示于图4,结合魏巍等[18]在乌头碱水解产物中检测到焦乌头碱[M+H]+分子离子峰m/z586.7的报道,推测M3为焦乌头碱。
化合物M2和M4的准分子离子m/z相同,均为618.2,而且在该软电离条件下二级质谱碎片也相同,均为m/z558.1,相对于乌头碱在相同条件下所得的基峰离子分别减少28 u,但是,三级质谱碎片有差别,分别为m/z476.1和m/z498.1,而且色谱保留时间也不同,分别为14.9 min和16.9 min,示于图5和图6。由此可以判断M2和M4为同分异构体,推测为乌头碱脱去N-乙基或者O-双甲基的产物,参考文献报道[17],根据相应的二级和三级质谱碎片,鉴定M2为N-去乙基乌头碱,M4为O-去双甲基乌头碱。
色谱保留时间为17.0 min的M5,准分子离子m/z662.2,二级和三级质谱碎片分别为m/z602.1和m/z542.1,示于图7,均比乌头碱的基峰离子、二级质谱和三级质谱碎片多了16 u,这说明M5和乌头碱具有相似的结构,中性丢失16 u推测为羟基,推断其为乌头碱的羟基化产物,参考文献报道[19],M5鉴定为羟基乌头碱。
化合物M6色谱保留时间为17.8 min,准分子离子m/z632.1,比乌头碱的基峰离子少14 u,14 u的中性丢失可能为亚甲基,另外,二级和三级质谱碎片分别为m/z572.1和m/z512.1,比较乌头碱在同样条件下所得的基峰离子均相差14 u,说明两者具有相同的断裂规律,因此推断M6与乌头碱结构相似,文献[20]中报道了乌头碱在体内代谢过程中可以丢失C-16位甲氧基中的亚甲基而形成C-16位羟基,产生16-O-去甲基乌头碱,化合物M6其各级质谱的数据与文献报道的16-O-去甲基乌头碱裂解规律相同,示于图8,故鉴定其为16-O-去甲基乌头碱。
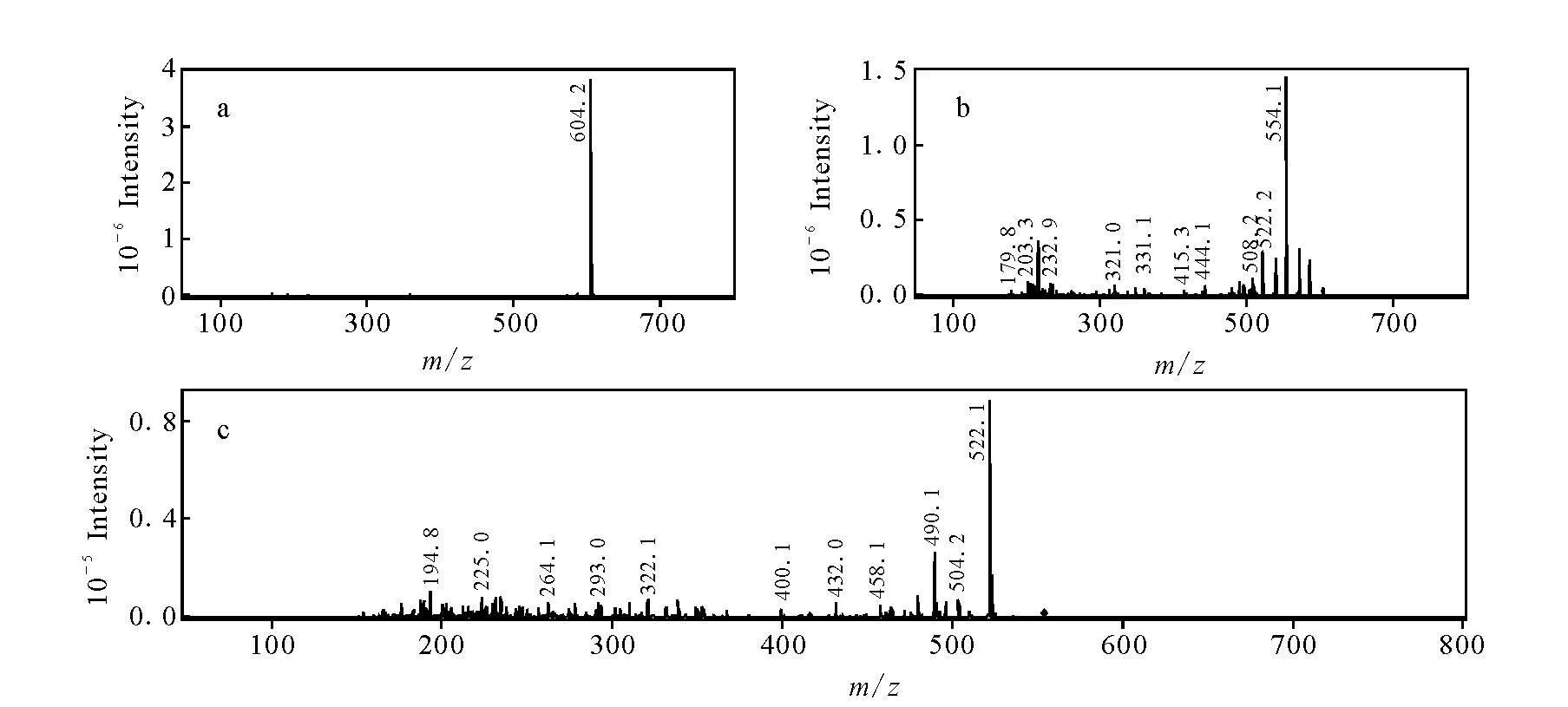
图3 乌头次碱的MSn谱图Fig.3 Mass spectra of M1
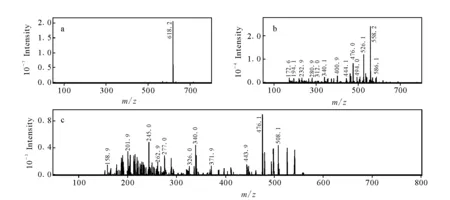
图4 N-去乙基乌头碱的MSn谱图Fig.4 Mass spectra of M2
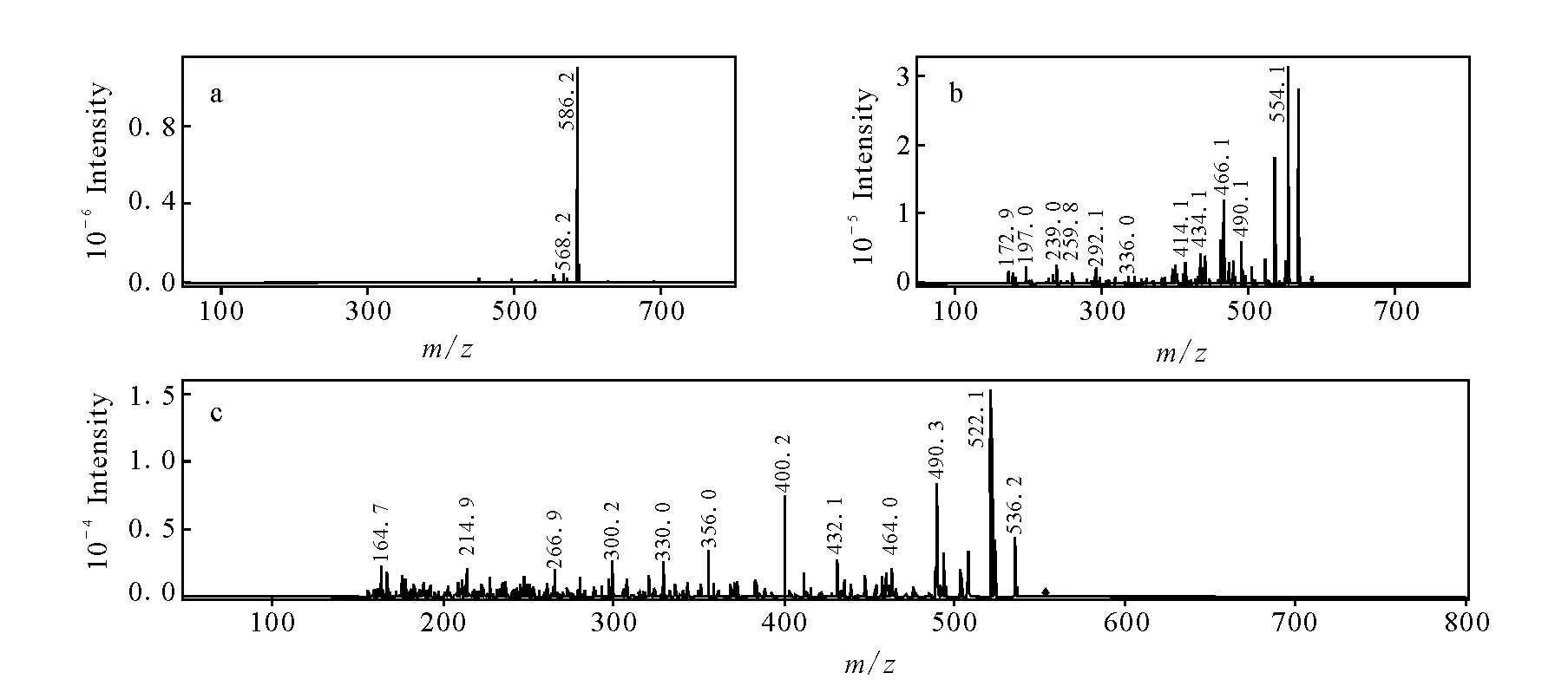
图5 焦乌头碱的MSn谱图Fig.5 Mass spectra of M3
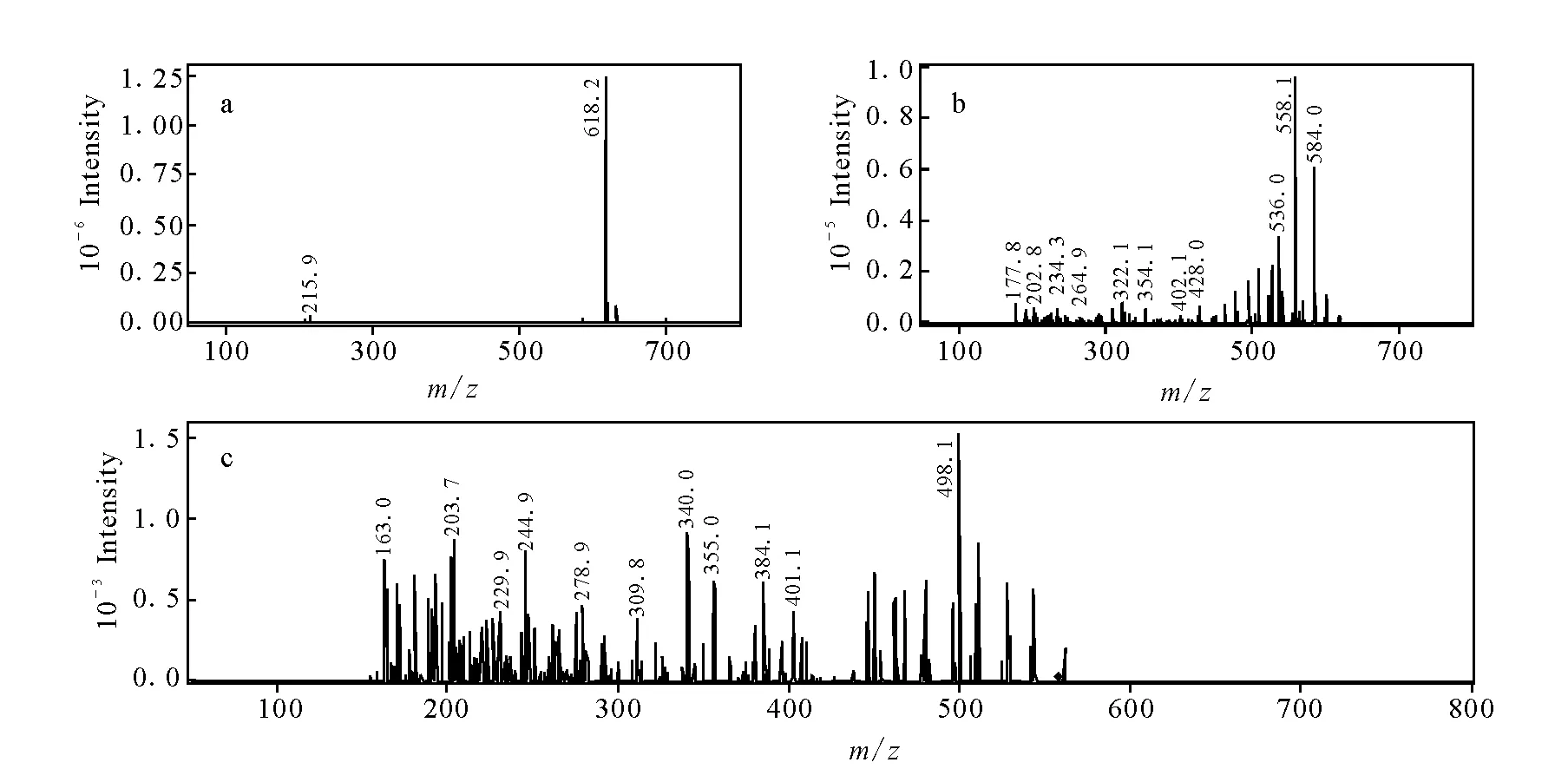
图6 O-去双甲基乌头碱的MSn谱图Fig.6 Mass spectra of M4
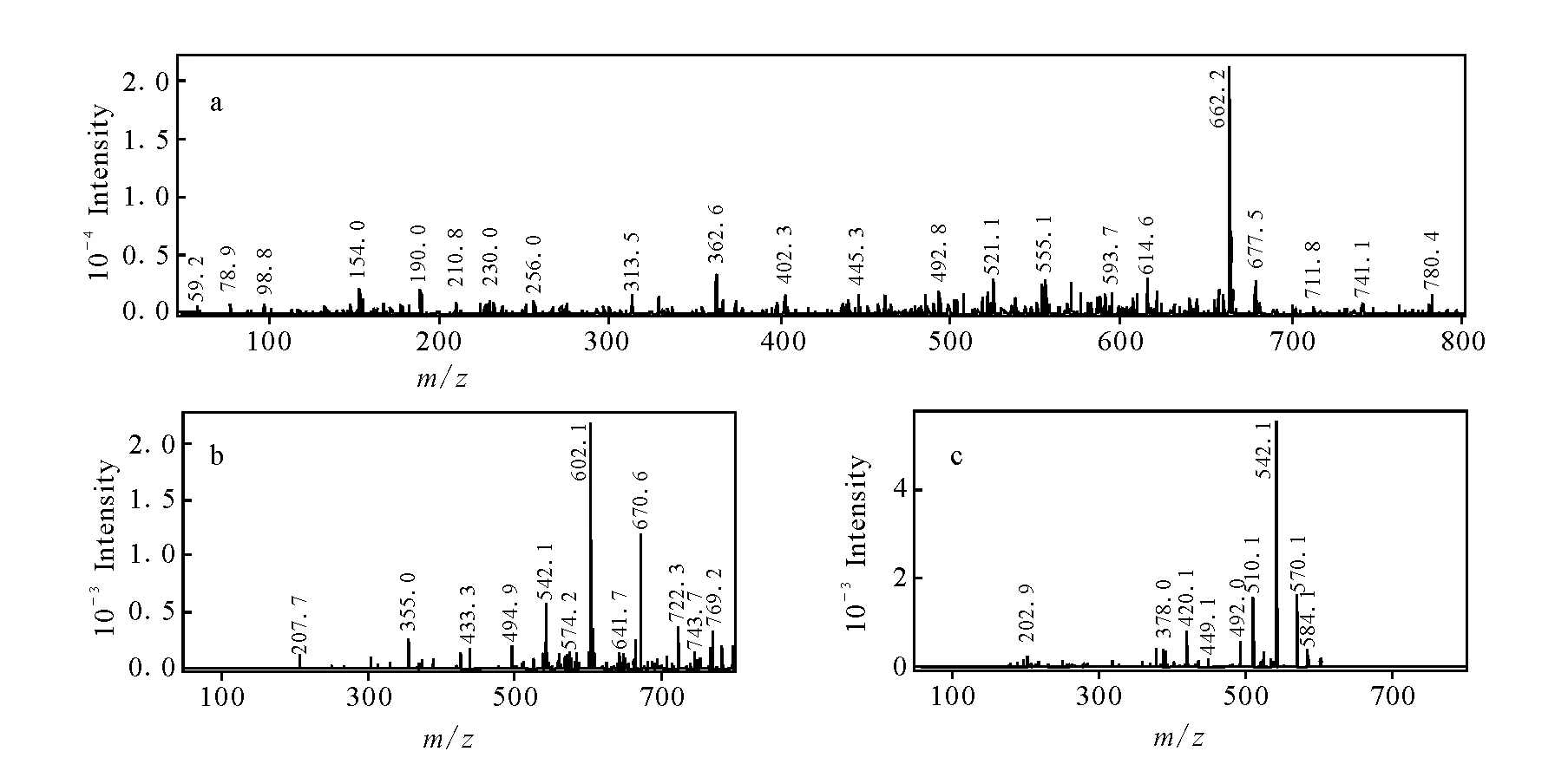
图7 羟基乌头碱的MSn谱图Fig.7 Mass spectra of M5
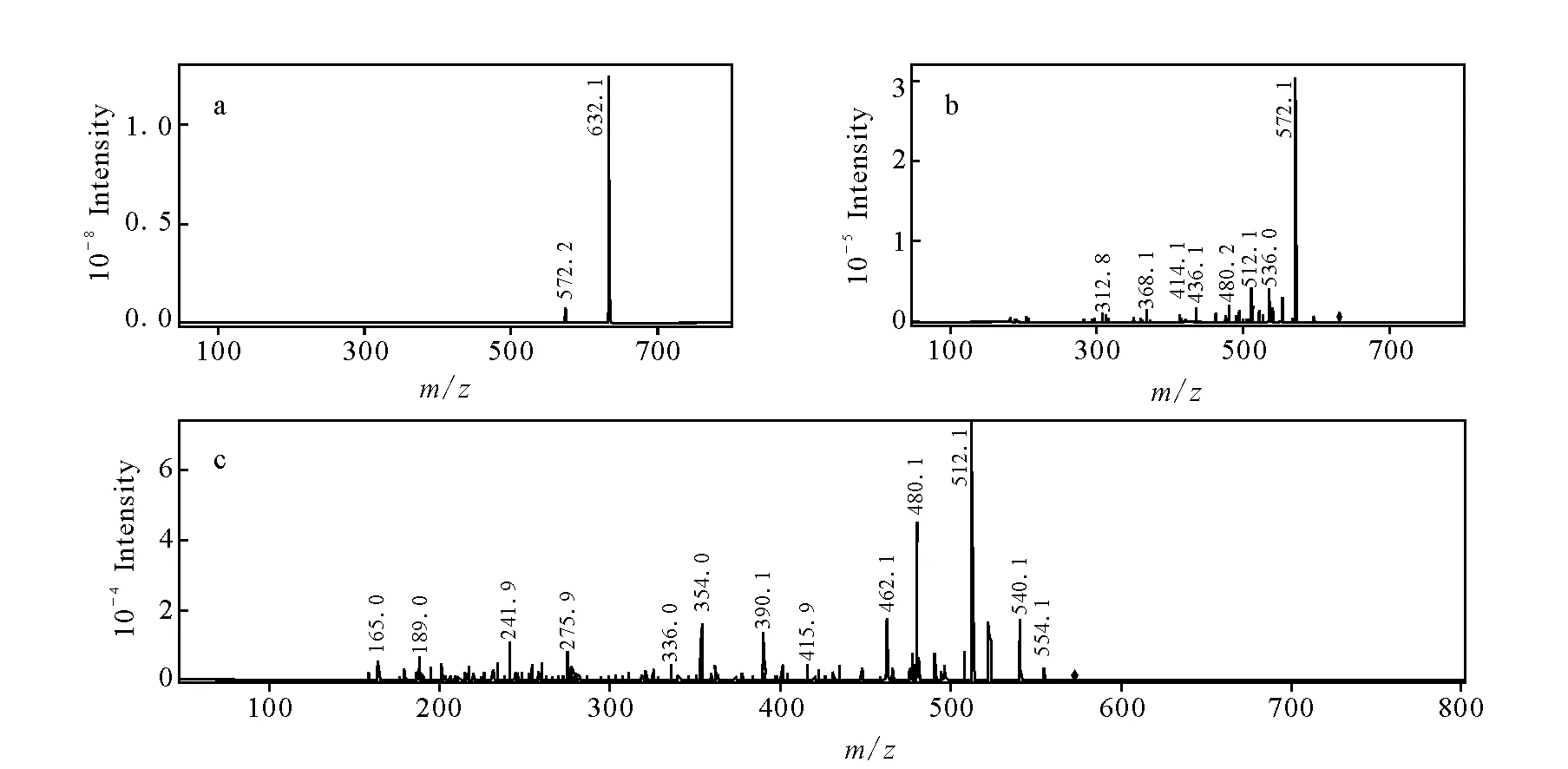
图8 16-O-去甲基乌头碱的MSn谱图Fig.8 Mass spectra of M6
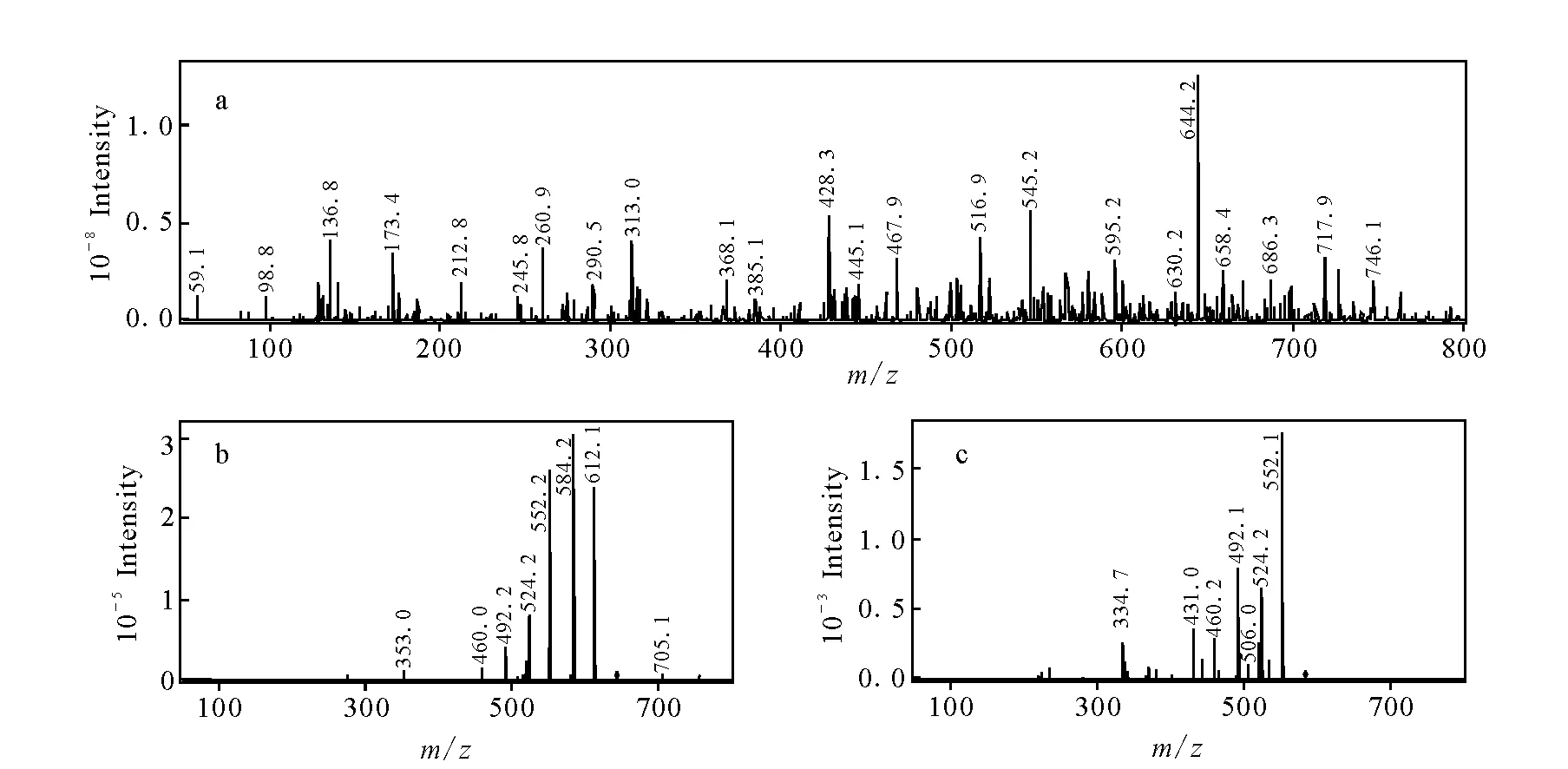
图9 去氢乌头碱的MSn谱图Fig.9 Mass spectra of M7
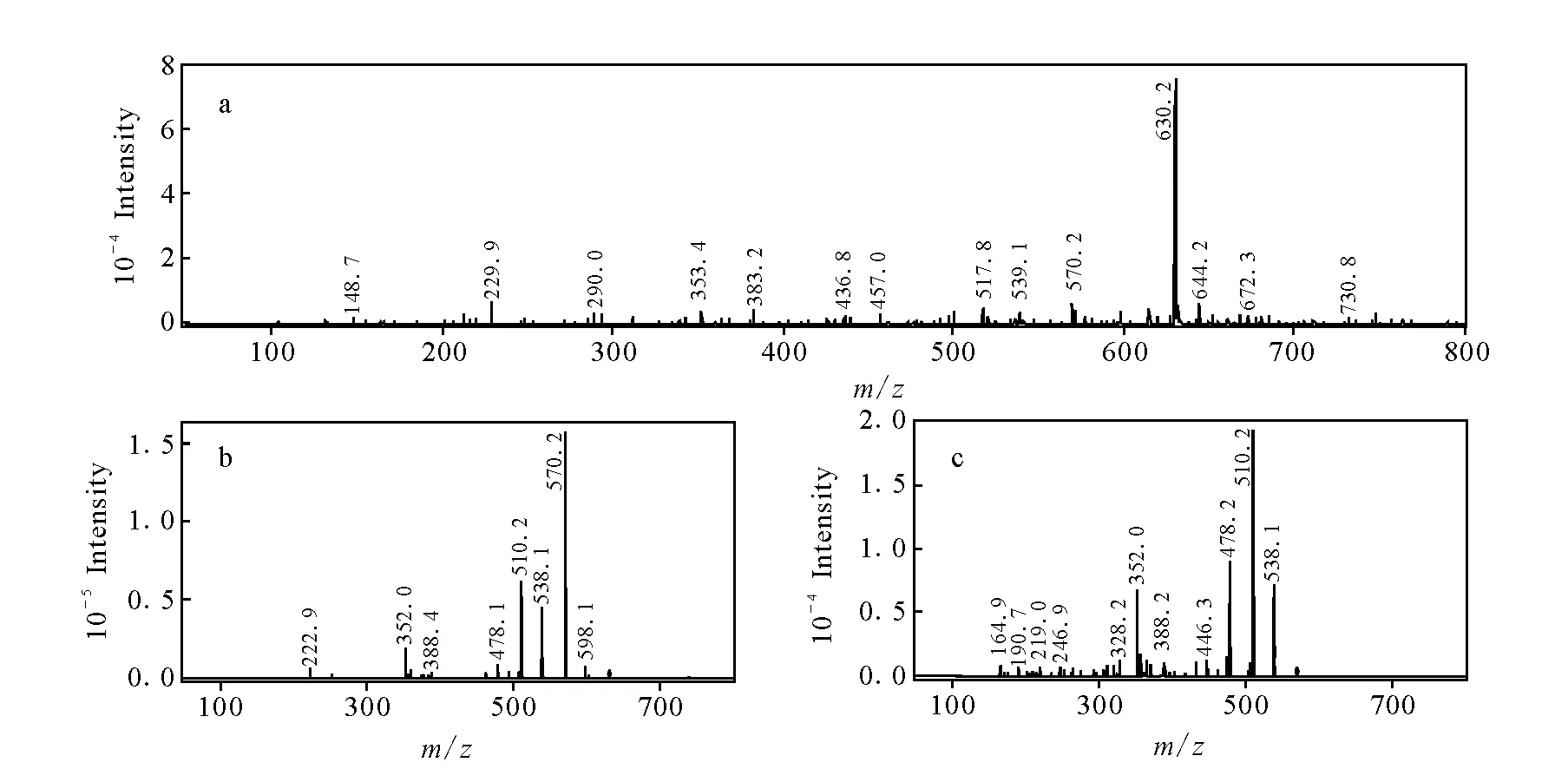
图10 去氧乌头碱的MSn谱图Fig.10 Mass spectra of M8
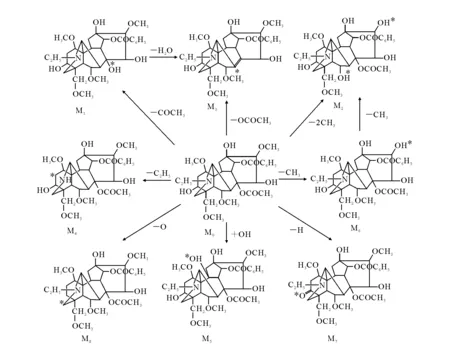
图11 乌头碱及其代谢物生物转化过程Fig.11 Biotransformation of Aconitine and its metabolites
准分子离子m/z为644.2,色谱保留时间为18.8 min的化合物M7,比乌头碱基峰离子仅少2 u,推测为乌头碱脱去两个氢的产物,参考文献报道[17],鉴定为去氢乌头碱,二级和三级串联质谱碎片分别为m/z584.2和m/z552.1,示于图9。
化合物M8的色谱保留时间为20.3 min,分子离子、二级和三级串联质谱碎片分别为m/z630.2、570.2、510.2,示于图10,均比乌头碱相应分子离子少16 u,由此推断16 u的中性丢失为氧,参考文献报道[21],推断M8为去氧乌头碱。
为了更准确的鉴定乌头碱在大鼠肝微粒体S9组分中的体外代谢产物,大鼠给药后尿样处理后经LC-ITMS分析,对照空白尿样实验结果,结合LC/MSn谱图,乌头碱原药及8种体外代谢产物均被检测到,除此以外,还检测到更多的代谢产物。
根据鉴定出来的代谢产物结构,可以推断乌头碱及其代谢产物之间的生物转化规律,对乌头生物碱中毒的法医鉴定、临床诊断以及毒代动力学、毒理学研究等具有一定的指导意义。乌头碱及8种代谢产物之间可能的生物转化过程示于图11。
另外,与体内代谢研究相比,体外代谢具有反应干扰小、操作简单、代谢条件易于控制等优点;同时,体外代谢可以实现在较短时间内得到大量代谢产物,便于对它们进行提取、分离、纯化和表征;还能迅速有效的解决药物代谢中的关键问题,例如代谢物结构鉴定、代谢途径推断等。因此,本研究利用LC-ITMS方法对乌头碱及其代谢物进行分析结果为新药开发、药物毒代动力学、药效学、毒理学等研究提供了一定的参考和借鉴。
3 结论
利用体外代谢方法,结合LC-ITMS联用技术,建立了乌头碱及其体外代谢产物的分析方法。该方法首先利用体外代谢方法得到大鼠肝微粒体S9组分中乌头碱及代谢产物混合体系,然后利用LC-ESI-ITMS联用技术对各代谢物进行分析,得到乌头碱代谢物的[M+H]+分子质量信息,进一步结合多级串联质谱(LC/MSn)分析结果获得结构信息,对代谢物进行鉴定,从而推测代谢物结构,进而结合大鼠尿中乌头碱及其代谢物的分析结果,得到乌头碱的生物转化规律。实验结果表明:采用体外代谢方法,利用LC-ITMS联用技术可以实现乌头碱及主要代谢产物的同时检测和分析,结合文献报道与体内代谢过程,借助LC/MSn方法可以对代谢物的结构进行鉴定,并得到乌头碱的生物转化规律。本实验结果对乌头生物碱的法医鉴定和临床诊断具有一定的指导意义。
[1] 曾 苏. 药物代谢学[M]. 杭州: 浙江大学出版社, 2008.
[2] 陈万平, 孙 翔, 程鹏远. 体外药物肝代谢研究进展[J]. 第四军医大学学报, 2008, 29(9): 861-863.
[3] 向 平, 沈 敏, 卓先义. 液相色谱-质谱联用技术在药物和毒物分析中的应用[M]. 上海:科学技术出版社, 2009.
[4] 赵宇峰, 宋凤瑞, 国新华, 等. 利用软电离质谱技术研究乌头碱在肠内细菌中的生物转化[J]. 高等学校化学学报, 2008, 29(1): 55-59.
[5] ALLWOOD J W, GOODACRE R. An introduction to liquid chromatography-mass spectrometry instrumentation applied in plant metabolomic analyses[J]. Phytochem Anal, 2010, 21(1): 33-47.
[6] 陈学国, 赖永权, 蔡宗苇. 液相色谱-电喷雾离子阱质谱结合“N in 1”模式用于高通量分析药物及其代谢物[J]. 中国科学B辑:化学, 2010(40): 756-761.
[7] LIU J, WU J L, WANG X R, et al. Study of the phase I and phase II metabolism of a mixture containing multiple tanshinones using liquid chromatography/tandem mass spectrometry[J]. Rapid Commun. Mass Spectrom, 2007, 21(18): 2 992-2 998.
[8] 陆惠民, 卢凤荃, 谭家镒. 毒物分析[M]. 北京: 警官教育出版社, 1995.
[9] 刘 艳, 章诗伟,周 兰,等. 乌头类生物碱对心肌的毒性作用及分子毒理学研究进展[J]. 中国法医学杂志, 2009, 24(6): 398-401.
[10] YOSHIOKA N, GONMORI K, TAGASHIRA A, et al. A case of aconitine poisoning with analysis of aconitine alkaloids by GC/SIM[J]. Forensic Sci Int, 1996, 81(2/3): 117-123.
[11] 粟 贵,廖林川,颜有仪,等. HPLC同时测定生物样品中新乌头碱、乌头碱、次乌头碱的含量[J].中国药学杂志, 2009, 44(12): 946-950.
[12] 刘 伟, 沈 敏, 吴何坚, 等. 液相色谱-串联质谱法测定生物检材中乌头生物碱[J]. 药物分析杂志, 2009(29): 2 023-2 028.
[13] QI S D, CUI S Y, CHENG Y Q, et al. Rapid separation and determination of aconitine alkaloids in traditional Chinese herbs by capillary electrophoresis using 1-butyl-3-methylimidazoium-based ionic liquid as running electrolyte[J]. Biomed Chromatogr, 2006, 20(3): 294-300.
[14] 王朝虹,文 静,陈义华, 等. 液相色谱质谱联用测定乌头碱在大鼠体内代谢产物[J].中国法医学杂志,2006,21(2): 88-90.
[15] ZHANG H G, SUN Y, DUAN M Y, et al. Separation and identification of Aconitum alkaloids and their metabolites in human urine[J]. Toxicon, 2005, 46(5): 500-506.
[16] CAI Z W, HAN C, HARRELSON S, et al. High-throughput analysis in drug discovery: Application of liquid chromatography/ion-trap mass spectrometry for simultaneous cassette of 1α-antagonists and their metabolites in mouse plasma[J]. Rapid Commun Mass Spectrom, 2001(15): 546-550.
[17] WANG Y G, WANG S Q, LIU Y X, et al. Ch-aracterization of metabolites and cytochrome P450 isoforms involved in the microsomal metabolism of Aconitine[J]. J Chromatogr B, 2006, 844(2): 292-300.
[18] 魏 巍, 李绪文, 金永日. 乌头碱水解产物的研究[J]. 分析化学, 2009, 37(增刊):D067-D068.
[19] 随志刚. 乌头类双酯型生物碱的体内代谢研究[D].吉林:吉林大学, 2009.
[20] 孙 莹, 张宏桂, 史向国, 等. 兔体内乌头碱代谢产物研究[J]. 药学学报, 2002, 37(10): 781-783.
[21] 随志刚, 姜雅秋, 刘志强, 等. 乌头碱在家兔肠道内代谢产物的LC/ESI-MSn研究[J]. 化学学报, 2009, 67(21): 2 439-2 444.
SimultaneousAnalysisofAconitineandItsMetabolitesbyLiquidChromatography-ElectrosprayIonTrapMassSpectrometry
CHEN Xue-guo1, 2, LAI Yong-quan2, CAI Zong-wei2
(1.DepartmentofForensicMedicine,ChinaCriminalPoliceUniversity,Shenyang110854,China;2.DepartmentofChemistry,HongKongBaptistUniversity,HongKongSAR999077,China)
A method applying liquid chromatography-electrospray ionization-ion trap mass spectrometry (LC-ESI-ITMS) for the simultaneous analysis of Aconitine and its in-vitro metabolites is described. Aconitine was incubated with mouse liver microsome S9fraction firstly, and then the incubation sample was analyzed by LC-ESI-ITMS in full-scan mode. Aconitine and its metabolites were identified from the determination of molecular ions. The metabolites detection were confirmed from tandem mass spectrometry (MSn) analysis. Comparing with the analysis of urine, 8 metabolites were identified in the mouse liver S9fractions by comparing with the analysis of urine of rat oral with Aconitine and referring to the literature reports.
liquid chromatography-electrospray ion trap mass spectrometry; mouse liver S9fractions; Aconitine; in-vitro metabolism
O 657.63
A
1004-2997(2012)03-0065-09

