超高效液相色谱-串联四极杆飞行时间质谱法筛查饲料中11种镇静剂类药物
吴宁鹏,班付国,彭 丽,周红霞,刘占通,刘宏伟
(河南省兽药监察所,河南 郑州 450008)
2011-09-02;
2012-02-23
吴宁鹏(1974~),男(汉族),兽医师,从事兽药饲料检测工作。E-mail:wnppeking2002@163.com
超高效液相色谱-串联四极杆飞行时间质谱法筛查饲料中11种镇静剂类药物
吴宁鹏,班付国,彭 丽,周红霞,刘占通,刘宏伟
(河南省兽药监察所,河南 郑州 450008)
为了快速筛查未知饲料样品中的镇静剂类药物,应用超高效液相色谱-串联四极杆飞行时间质谱建立了筛查饲料中11种镇静剂类药物的方法。在不同添加浓度下获得了精确的分子离子质量,质量偏差的绝对值低于3×10-6。11种镇静剂类药物在0.02~1 mg/L范围内线性关系良好,相关系数r≥0.99,添加浓度为0.5~5 mg/kg时,其添加回收率在50%~120%之间,在饲料基质中的检测限为0.1 mg/kg。该方法简便、高效、准确,适于饲料中11种镇静剂类药物的分析检测需求。
超高效液相色谱-串联四极杆飞行时间质谱; 镇静剂类药物; 筛查; 饲料
镇静剂类药物(sedatives)是指对中枢神经系统有抑制作用,从而减轻或消除动物狂躁不安症状,或令其恢复安静的一类药物,主要用于兴奋不安或具有攻击性行为的动物或患畜,以使其安静,便于工作或治疗[1]。随着镇静剂类药物在兽医临床上的广泛应用,近年来,一些不法饲料生产企业因经济利益的驱使,擅自在畜禽饲养过程中添加此类药物以起到镇静催眠、增重催肥、缩短出栏时间的作用;另外,在动物运输过程中,为减少动物死亡和体重下降,防止肉品质降低,也常使用此类药物以减少应激带来的损失。但非法使用此类药物会使其原形和代谢产物不可避免地残留于动物源食品中,人们食用了这些食品后会对人体中枢神经系统等造成不良影响,因此许多国家都将此类药物列为禁用药物,我国也规定镇静剂类药物不允许在饲料中添加使用。但由于镇静剂类药物品种较多,我国饲料生产企业众多,很难掌握在生产饲料时添加药物情况,因此开发筛查饲料中镇静剂药物的方法尤为重要。
目前,对镇静剂类药物的检测方法有HPLC[2-4]、GC/MS[5]、LC-MS/MS[6-12]法。由于饲料中非法添加药物的复杂性,快速筛查饲料中的违禁药物已经成为研究的热点。随着液相色谱-飞行时间质谱(LC-TOF、LC-QTOF)技术的日趋成熟和推广应用,利用飞行时间质谱测定精确质量,实现对未知饲料样品中的药物筛查检测已经成为可能。质量测定的精确度越高,理论上越可以减少可能的目标化合物数量,从而增强对非法添加药物确认的可信度。本研究利用超高效液相色谱-串联四极杆飞行时间质谱(UPLC-QTOF)技术,建立了饲料中镇静剂类药物的快速筛查检测方法。
1 材料和方法
1.1仪器
超高效液相色谱-串联四级杆飞行时间质谱仪:美国Waters公司产品,配有电喷雾离子源;分析天平(感量0.01 mg): 瑞士Mettle公司产品。
1.2试剂
氯丙嗪、阿扎哌隆、赛拉嗪、地西泮、艾司唑仑、奥沙西泮、硝基安定、奋乃静、氟哌啶、氟哌啶醇、异丙嗪等标准品(含量均大于98%):购自百灵威公司;甲醇、乙腈为色谱纯;其他试剂均为分析纯。
1.3对照溶液的配制
准确称取适量的氯丙嗪、阿扎哌隆、赛拉嗪、地西泮、艾司唑仑、奥沙西泮、硝基安定、奋乃静、氟哌啶、氟哌啶醇、异丙嗪标准品,用甲醇溶解并定容,配制成1 g/L的标准储备液,用乙腈分别将其稀释成相应的标准工作溶液。
1.4试验方法
1.4.1色谱条件 色谱柱:C18(100 mm×2.1 mm×1.7 μm); 流动相A为甲醇,流动相B为0.1%甲酸水溶液;流速:0.3 mL/min;柱温:30 ℃;进样量:5 μL;样度洗脱程序列于表1。
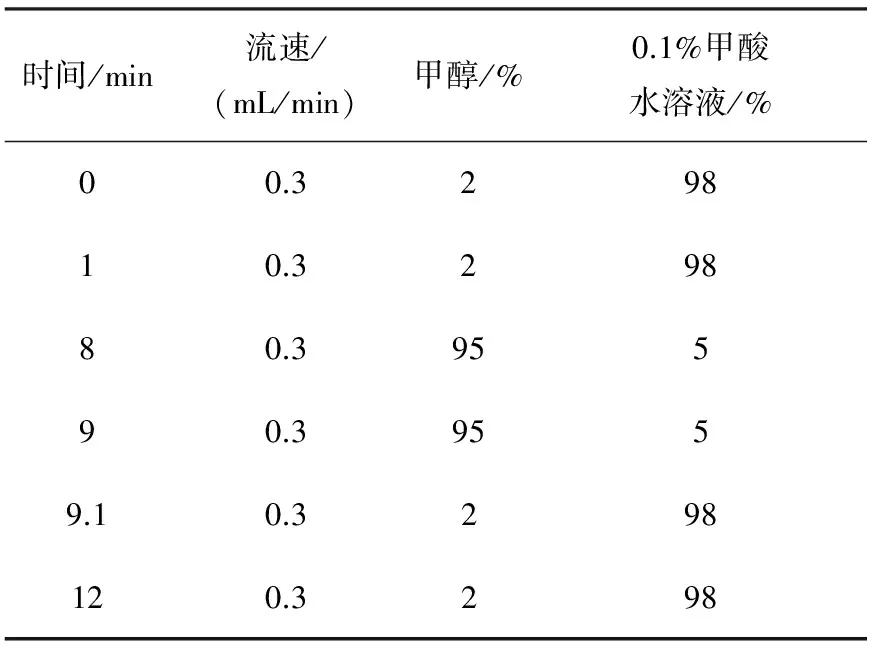
表1 梯度洗脱程序
1.4.2质谱条件 电喷雾离子源,正离子模式;毛细管电压3.00 kV;锥孔电压30 V;离子源温度110 ℃;脱溶剂温度350 ℃;脱溶剂气流速650 L/h;锥孔反吹气流速50 L/h;质量扫描范围m/z80~1 000;亮氨酸脑啡肽实时在线分子质量校正,相对分子质量556.277 1,流速0.2 mL/min。
1.4.3样品前处理 称取2 g饲料,加入1 mL饱和乙酸铅和9 mL 0.1%V(甲酸)∶V(甲醇)=3∶7的溶液,涡旋1 min,超声10 min,以8 000 r/min离心10 min,上清液过0.22 μm滤膜后,上机测定。选取空白饲料,通过添加已知含量的镇静剂类药物制备阳性样品进行添加回收试验。测定数据用Waters公司的药物筛查软件MassLynx V 4.1进行分析。
1.4.4实际样品检测 对从市场上抽检的60份饲料样品进行筛查检测,未检出阳性样品。
2 实验结果
2.1标准曲线及回收率
按照上述方法绘制标准曲线,饲料基质中11种药物的线性方程和相关系数列于表2,回收率及精密度列于表3。从表2、3可以看出,各药物在0.02~1.0 mg/L浓度范围内呈良好线性相关,相关系数均大于0.99。
2.2药物筛查结果
优化锥孔电压,以获得最大的分子离子丰度,测得药物的精确分子质量与实际分子质量的偏差绝对值均小于3×10-6,数据列于表4。
2.3质量准确度的测定
11种镇静剂类药物混合标准溶液的总离子流图示于图1。在本研究选定的条件下,应用高精度的质量提取可以获得良好的提取离子色谱图,示于图2。根据分子离子峰的精确质量数,经Waters公司MassLynx V 4.1软件匹配元素组成示于图3。
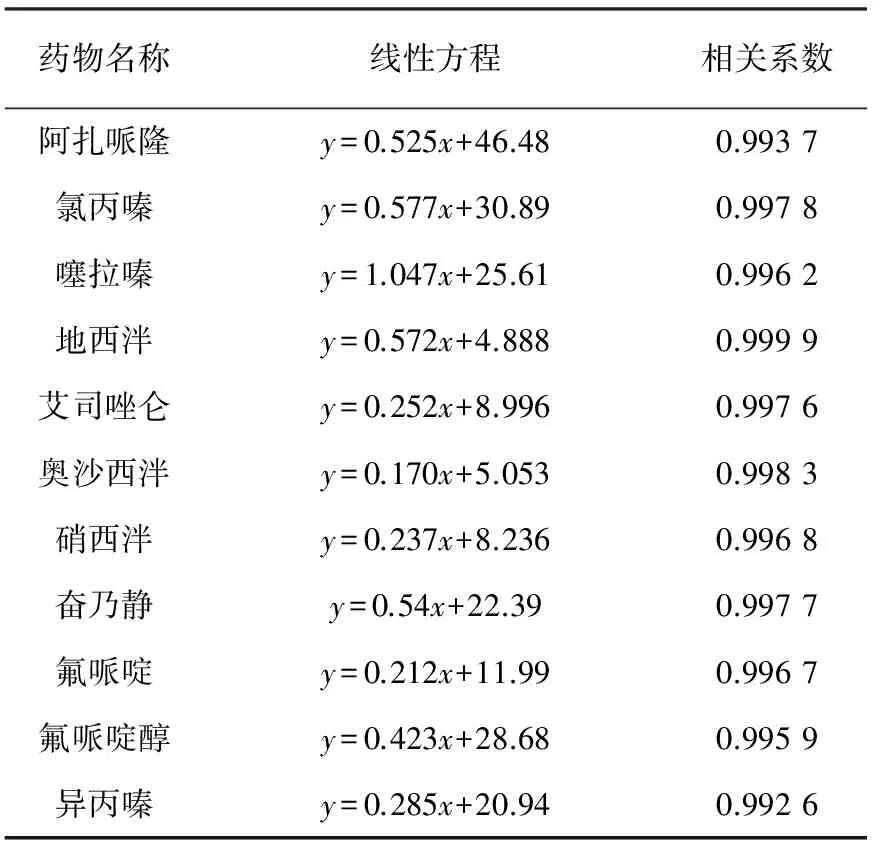
表2 饲料基质溶液中11种镇静剂类药物的线性方程及相关系数Table 2 The linear equation andcorrelation coefficients of 11 sedatives in feedstuff
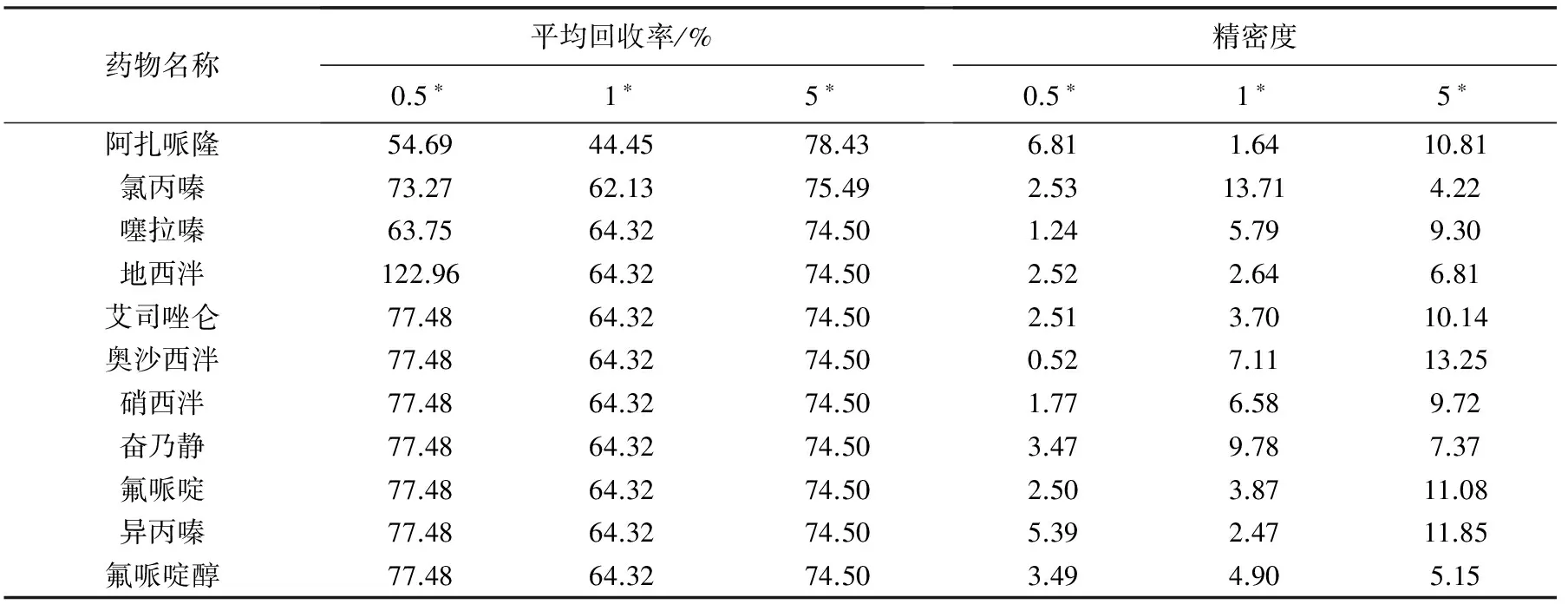
表3 饲料基质溶液中11种镇静剂类药物的回收率及精密度
注:*为添加浓度,单位为mg/kg
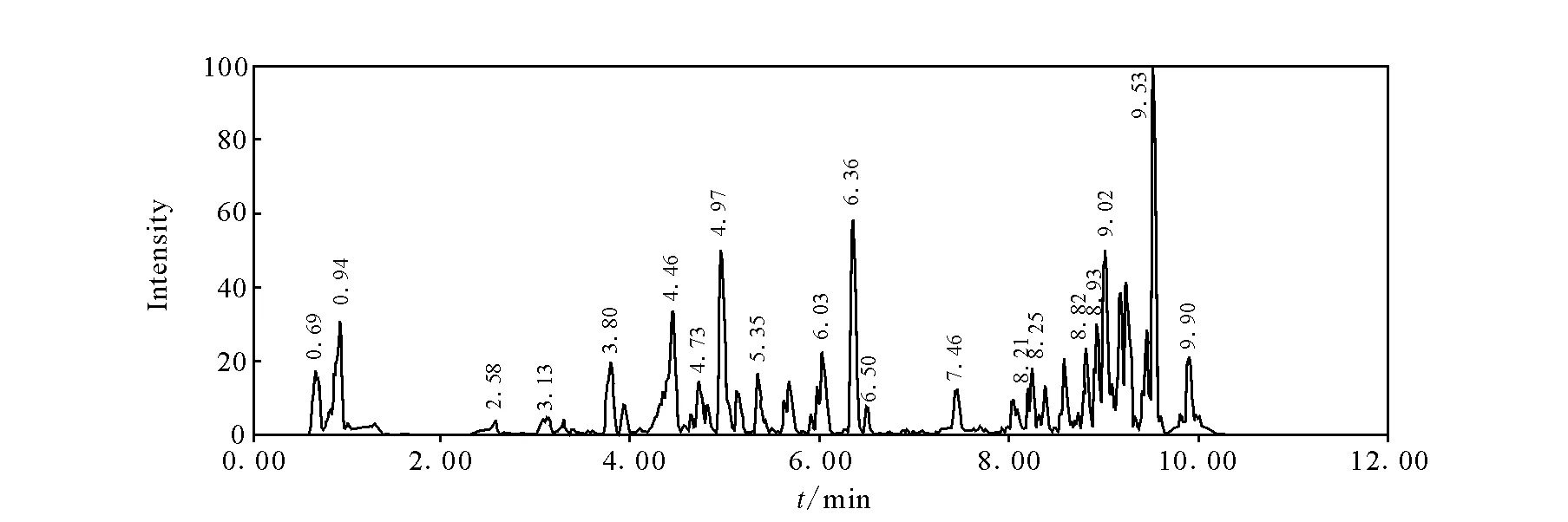
图1 饲料基质中添加0.1 mg/kg镇静剂类药物的总离子流图 Fig.1 Total ion current chromatogram of a feed spiked with standards at 0.1 mg/kg for each sedative
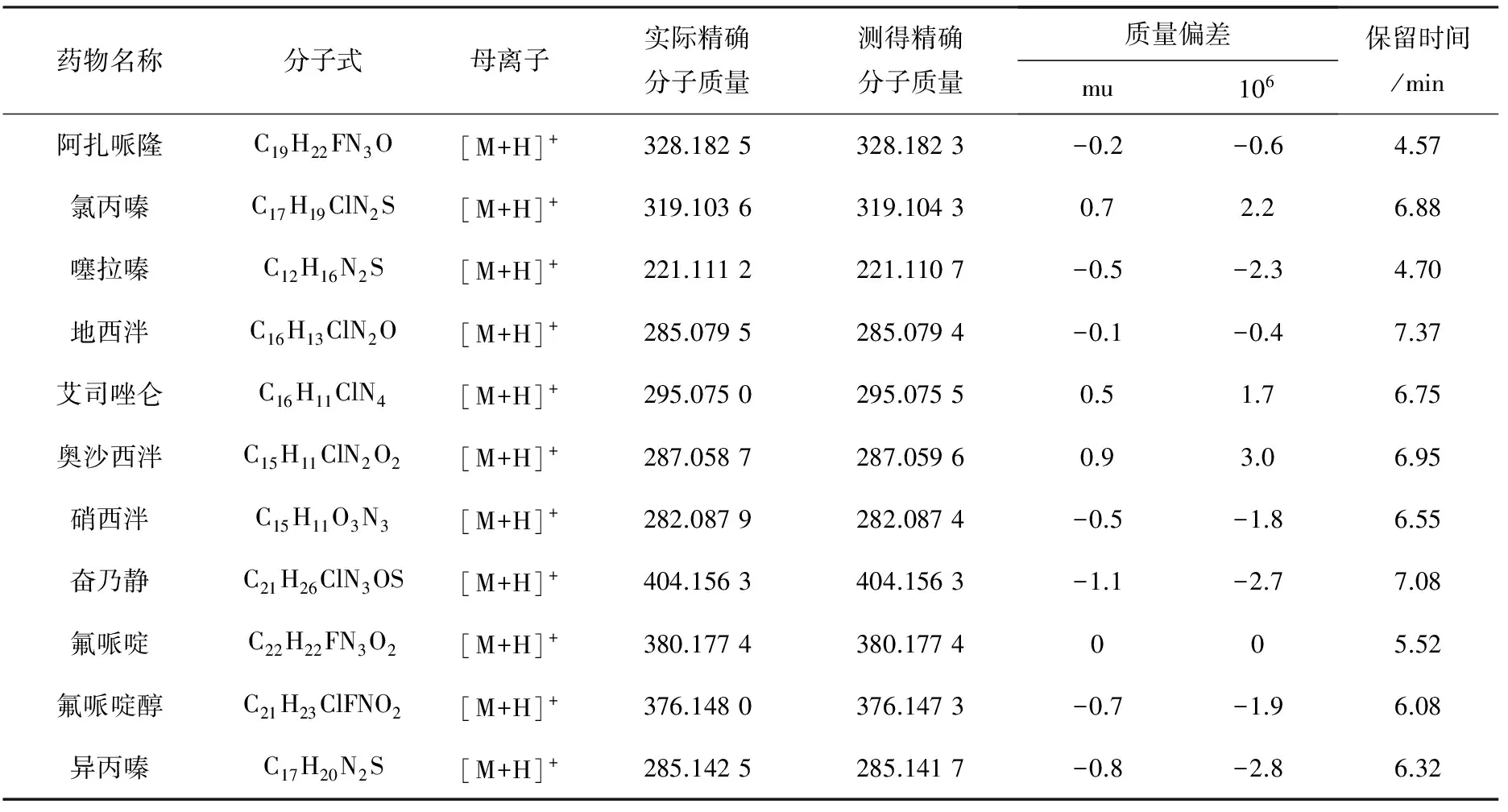
表4 饲料基质中测得的11种镇静剂类药物的精确质量数及相关数据
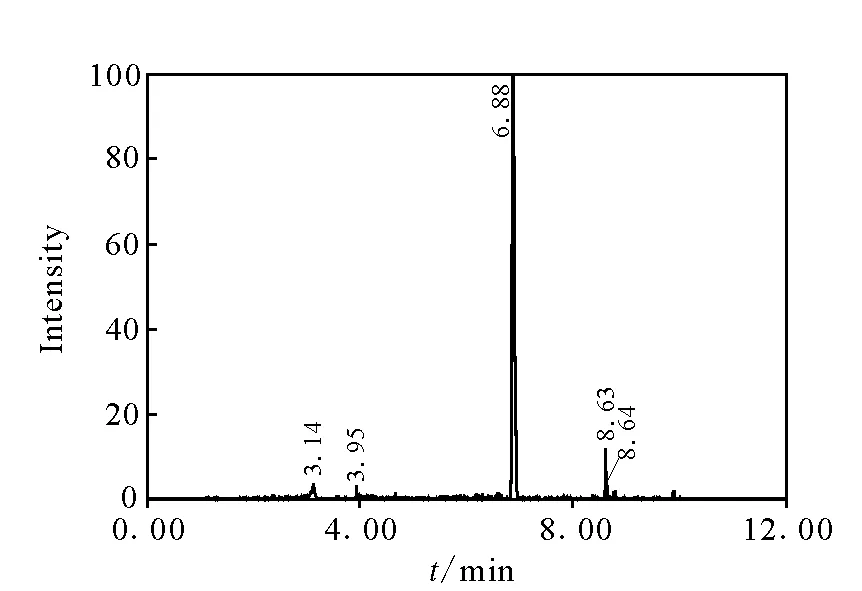
图2 饲料基质中氯丙嗪的提取离子色谱图 Fig.2 Extracted ion current chromatogram of chlorpromazine in feed
2.4实际样品筛查
对从市场上抽检的60份饲料样品进行筛查,其中有两份为可疑阳性样品,经LC-MS/MS确认后,均为阴性样品。
3 讨论
3.1仪器条件的优化
对质谱的各种参数进行优化,以获得最佳的灵敏度。锥孔电压是影响分子离子峰的关键参数,分别对20~40 V锥孔电压进行优化,在固定碰撞电压的条件下,实验得出在30 V的锥孔电压下,各药物的分子离子峰为最高。
3.2质量测定的准确度
在饲料样品中添加0.1 mg/kg浓度下,各药物的提取离子仍能得到一张很干净的图谱,各种药物测得的精确分子质量与实际精确分子质量的差值都小于3×10-6,说明该方法在饲料基质中获得的质量精度仍较高。通过软件设定的质量偏差和元素组成的种类及数量,可以直接获得可能的分子式组成,而分子离子的精确质量可以有效地减少可能的分子式组成数,提高对未知物筛查的效率。
3.3目标化合物的确证
本研究根据保留时间、精确质量数、元素组成和i-FIT值,即可完成对未知镇静剂的确证分析。氯丙嗪的精确分子质量为319.103 6,测定的分子质量为319.104 3,经软件分析后,元素组成与氯丙嗪的元素组成一致,其i-FIT为最小。同位素峰的存在能进一步确证筛查结果,图3中有明显的氯丙嗪同位素峰,其中m/z319.104 3(100%),m/z321.101 1(33.6%)的质量数相差为2,丰度比为3:1,符合化合物中含有1个氯原子的规律。另外,由于本方法是一个开放的体系,可以增加目标化合物的分子式和保留时间的数据库,一次进样,即可完成所有化合物的筛查。筛查出的阳性样品再经LC-MS/MS确证。
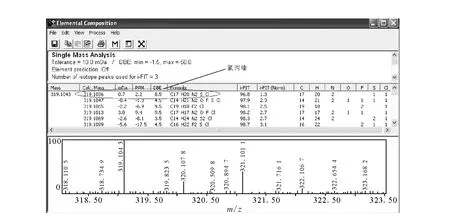
图3 应用Waters公司软件匹配饲料基质中氯丙嗪的元素组成 Fig.3 Elemental composition of chlorpromazine in feed by Waters Company software
4 结论
研究结果表明,UPLC-QTOF是筛查饲料中镇静剂类药物的有效手段,测定质量精确度多数优于3×10-6,因此能够满足筛查的准确性要求。此外,还具有良好的选择性和灵敏性,不仅可以用于饲料的筛查检测,还可以扩展到畜产品中农兽药残留、兽药制剂中非法添加物等的筛查检测。筛查检测中的阳性结果可以通过液相色谱-串联质谱仪进行进一步的确证和定量分析。随着人们对食品安全关注度的增加,对畜产品以及饲料、兽药等投入品中的有毒有害物质筛查也会越来越重视。UPLC-QTOF能够提供精确分子质量,具有广阔的应用前景。
[1] 李俊锁,邱月明,王 超,著.兽药残留分析[M]. 上海:上海科学技术出版社,2002:340-361.
[2] SAMIA M, GIZAWY E. Simultaneous determination of diazepam, oxazepam and temazepam in spiked urine by HPLC [J]. Anal Lett, 2000, 33(4):629-638.
[3] MOHAMMAD N. Validation of SPE-HPLC determination of 1,4-benzodiazepines and metabolites in blood plasma,urine and saliva[J]. J Sep Sci, 2008(31): 3 704-3 717.
[4] MASATOMO M. Determination of estazolam in plasma by high-performance liquid chromatograghy with solid-phase extraction[J]. Anal Sci, 2002(18):525-528.
[5] TEEMU G. Determination of 14 benzodiazepines and hydroxy metabolites, zaleplon and zzolpidem astert-butyldimethylsilyl derivatives compares with other common silylating reagents in whole blood by gas chromatography-mass spectromery[J]. J Chromatogr B, 2005, 828: 175-189.
[6] WANG J Y. Simple and sensitive liquid chromatography/tandem mass spectrometry method for the determination of diazepam and its major metabolites in rat cerebrospinal fluid[J]. Rapid communication in mass sprctrometry, 2003, 17: 519-525.
[7] SKINNER W. Quantitative determination of carisoprodal and its metabolites in equine urine and serm by liquid chromatography tandem mass spectrometry[J]. Chromatogr Suppl, 2004,59: S61-S67.
[8] TOSHIMASA T. Determination of hypnotic ben-zodiazepines(alprozalam, estazolam, and midazolam) and their metabolites in rat hair and plasma by reverse-phase liquid-chromatography with electrospray ionization mass spectrometry [J].Journal of Pharmaceutical and Biomedical Analysis, 2003, 30: 1 773-1 787.
[9] LIU Z. The simultaneous determination of diazepam and its three metabolites in dog plasma by high-performance liquid chromatograohy with mass spectroscopy detection [J].Journal of Pharmaceutical and Biomedical Analysis, 2001, 26: 321-330.
[10] STEPHANE P. Liquid chromatographic-electrospray ionization mass spectromrtric quantitative analysis of buprenorphine, norbuprenorphine, nordiazepam and oxazepam in rat plasma[J]. Journal of Pharmaceutical and Biomedical Analysis, 2006, 41: 1 135-1 145.
[11] HEGSTAD S. Determination of benzodiazepines in human urine using solid-phase extraction and high-performance liquid chromatography-electrospray ionization tandem mass spectrometry[J]. Journal of Analytical Toxicology, 2006, 30: 31-37.
[12] FENG J.Simultaneous determination of multiple drugs of abuse and relevant metabolites in urine by LC-MS-MS[J].Journal of Analytical Toxicology. 2007, 31: 359-368.
ScreeningMethodfor11SedativesinFeedstuffbyUltraPerformanceLiquidChromatography-QuadrupoleTime-of-FlightMassSpectrometry
WU Ning-peng, BAN Fu-guo, PENG Li, ZHOU Hong-xia, LIU Zhan-tong, LIU Hong-wei
(He’nanInstituteofVeterinaryDrugControl,Zhengzhou450008,China)
A method based on ultra performance liquid chromatography-quadrupole time-of-flight mass spectrometry (UPLC-QTOF) was developed for quantitative analysis of 11 sedatives in feedstuff. The accurate mass was obtained in different spiking levels (from 0.5 to 5 mg/kg)and the accuracy error was lower than 3×10-6, which was well within the accepted limits for target confirmation. The linearity of response ranges from 0.02 to 1.0 mg/L, and the correlation coefficient is greater than 0.99. The average recoveries range from 50% to 120% of the fortified 11 sedatives in feedstuff at 0.5—5 mg/kg levels. and the limits of detection are 0.1 mg/kg. The results indicate that the method is easy, fasty, and sensitive. This method can meet the requirements for simultaneous determination of 11 sedatives in feedstuff.
ultra performance liquid chromatography-quadrupole time-of-flight mass spectrometry (UPLC-QTOF); sedatives; screening; feedstuff
O 657.63
A
1004-2997(2012)03-0094-05

