一次过柱法快速分离纯化驴心肌中高铁肌红蛋白
李沛军,孔保华,郑冬梅,陈 倩
(东北农业大学食品学院,黑龙江哈尔滨150030)
一次过柱法快速分离纯化驴心肌中高铁肌红蛋白
李沛军,孔保华*,郑冬梅,陈 倩
(东北农业大学食品学院,黑龙江哈尔滨150030)
肌红蛋白及其存在形式是决定肉和肉制品色泽的重要因素,高铁肌红蛋白为其重要存在形式之一。以马科动物-驴的心肌为原料,采用70%~100%饱和硫酸铵分段盐析法粗提肌红蛋白,加入铁氰化钾氧化后透析,经CMSephadex Fast Flow阳离子交换柱层析进行一步纯化。SDS-PAGE电泳和紫外/可见光光谱扫描结果表明,仅通过一次柱交换,即可得到电泳纯的高铁肌红蛋白,为快速提取、纯化高铁肌红蛋白提供了一条途径。
驴心肌,高铁肌红蛋白,纯化,电泳纯
肉的色泽是影响消费者购买肉制品的重要因素[1-2]。肉的颜色主要取决于肌肉中的两种色素蛋白质,即血红蛋白和肌红蛋白的含量,以及血色素存在的形式。肌红蛋白为肉自身的色素蛋白,肉色的深浅与其含量多少有关;血红蛋白存在于血液中,对肉颜色的影响要视放血情况而定。放血良好的肉,肌肉中肌红蛋白色素占80%~90%,比血红蛋白丰富的多[3],是决定肉颜色的主要因素。肌红蛋白是一种球状的血红素蛋白,分子量约为17000[4],在动物的需氧器官和心室中含量丰富。在通常条件下,肌红蛋白(Myoglobin,Mb)有三种存在形式:还原型肌红蛋白(DMb)、氧合肌红蛋白(MbO2)、高铁肌红蛋白(Met-Mb)[5]。纯品肌红蛋白主要用于肌肉基础[6]和医学领域研究[7-8]。目前我国的纯品肌红蛋白主要依靠进口,价格昂贵,国内企业尚无肌红蛋白商品生产。在肉品科学研究中,很多研究都需要应用到纯品肌红蛋白,用于研究肉制品的颜色变化[9],以及相关酶的作用[10]。关于对肌红蛋白的分离纯化有一些报道。汤祥明、Chaijan和Enoki分别采用两次柱层析法,对猪心肌[11]、鸟骨骼肌[12]和沙丁鱼肌肉[13]中肌红蛋白的提取纯化进行了研究,方法繁琐,提取效率不高;Joseph从野牛心肌中提取、纯化了肌红蛋白[14],方法耗时多,需要较高的成本[11]。很多报道中用到的肌红蛋白均为马心肌红蛋白的氧化态-高铁肌红蛋白[15-19],高铁肌红蛋白较还原型肌红蛋白更为稳定,提取时不需要苛刻的外界条件;而驴(Equus asinus)属马科、马属[20],且原料较马心易得。因此,选用肌红蛋白含量高的驴心肌作为原料,进行提取、纯化高铁肌红蛋白的研究。本文采用硫酸铵分段盐析法粗提驴心肌中的高铁肌红蛋白,然后通过一次阳离子交换柱层析进行纯化,以期在较短的时间内得到电泳纯的高铁肌红蛋白。
1 材料与方法
1.1 材料与仪器
新鲜驴心 购自哈尔滨横道街市场,4℃冷藏运输;羧甲基纤维素琼脂糖凝胶(CM-Sepharose Fast Flow) 美国GE healthcare公司;聚乙二醇(PEG)-20000 德国merck公司;牛血清白蛋白(BSA) 美国Sigma Aldrich公司;考马斯亮蓝试剂盒 南京建成生物工程研究所;肌红蛋白萃取缓冲液 1mmol/L乙二胺四乙酸二钠(EDTA),0.05mol/L Na2HPO4-NaH2PO4,pH6.0;层析缓冲液A 1mmol/L EDTA,0.02mol/L Na2HPO4-NaH2PO4,pH6.0;层析液B 0.5mol/L NaCl;其它化学试剂 均为分析纯。
Bio Logic LP低压层析系统,垂直电泳设备Mini-PROTEAN Tetra Cell,0.45μm滤膜 美国BIO-RAD公司;透析袋(截留分子量为8000~14000) 深圳晶美公司;组织捣碎机 荷兰Philips公司;高速分散均质机 德国IKA公司;台式高速冷冻离心机Allegra 64R,紫外/可见分光光度计DU-800 美国Beckman Coulter公司;Delta320 pH计 上海METTLER-TOLEDO仪器设备有限公司;真空抽滤系统 上海亚荣生化仪器厂;低压层析柱(1.5cm×20cm) 上海华美实验仪器厂;凝胶成像仪 上海天能科技有限公司。
1.2 实验方法
1.2.1 组织匀浆液的制备 屠宰后新鲜驴心,冰袋低温保存,运输到实验室,样品处理按照Joseph方法[14],并进行适当的修改,在4℃冷库中进行。取驴心150g,去除脂肪、结缔组织后切成1cm3小块,生理盐水漂洗;加入400mL肌红蛋白萃取缓冲液,移入组织捣碎机,加入少许冰块,分多次绞碎,再用高速分散均质机以转速15000r/min,分5次间歇均质50s,静置萃取过夜。次日取匀浆液于4℃下6000×g离心30min,除去沉淀。取上清液,经中速定性滤纸进行真空过滤,除去残留脂肪。加入过量铁氰化钾(大约1kg心肌组织加入1g铁氰化钾)[21],充分反应后测定溶液总蛋白和高铁肌红蛋白含量。
1.2.2 分段盐析制备高铁肌红蛋白粗提液 向上述制备的组织匀浆液中缓慢加入固体硫酸铵,同时使用磁力搅拌器搅拌,至70%硫酸铵饱和度,4℃萃取30min。在4℃下18000×g离心20min后,弃去沉淀,再向上清液缓慢加入固体硫酸铵至饱和,同时使用磁力搅拌器搅拌。静置萃取30min后,于4℃下20000×g离心60min,弃上清液。沉淀用肌红蛋白萃取缓冲液重新溶解,将溶解液于4℃,18000×g离心10min,除去不溶性物质。最后将滤液通过0.45μm滤膜过滤,在层析缓冲液A中,4℃透析24h,期间多次换液。透析液用PEG-20000浓缩。
1.2.3 高铁肌红蛋白的阳离子交换层析 取1.5cm× 20cm层析柱,洁净并安装好。将经过溶胀,并经过层析缓冲液A漂洗的CM-Sephadex Fast Flow柱料搅动倒入层析柱,并用上述缓冲溶液平衡。将经PEG-20000浓缩后的粗提液上样至层析柱,先用层析缓冲液A洗去未结合的蛋白,再使用层析缓冲液A(100%~40%),层析液B(0%~60%)进行连续梯度洗脱。洗脱速度为0.4mL/min。280nm下自动检测吸光值并记录,自动收集器以每管2mL的体积自动收集洗脱液。
1.2.4 肌红蛋白鉴定 根据肌红蛋白已知特性,其分子量为17000左右[4],而高铁肌红蛋白溶液在350~700nm范围内有特征吸收峰[22],故采用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)和紫外-可见光谱扫描两种方法对所得样品进行鉴定。
1.2.4.1 蛋白的SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)SDS-PAGE按照Laemml方法进行,并做适当修改[23],对肌红蛋白粗提液、层析后各组分中蛋白质进行凝胶电泳。分离胶浓度是10%,浓缩胶浓度是5%。电泳胶片置于凝胶成像仪中进行摄像,结合Tanon软件进行分析和处理。
1.2.4.2 紫外-可见吸收光谱分析 通过紫外-可见分光光度计对CM-Sephadex Fast Flow层析柱所洗脱下的目标峰进行光谱扫描,扫描范围为350~700nm,扫描间隔为1nm。
1.2.5 总蛋白浓度测定和高铁肌红蛋白浓度测定
1.2.5.1 总蛋白浓度测定 总蛋白质浓度测定采用Bradford法[24],按照说明书使用考马斯亮蓝试剂盒进行测定,以牛血清白蛋白(BSA)作为标准蛋白,使用紫外/可见分光光度计,于595nm波长处比色。做出标准曲线后,通过测定样品吸光值,计算出其总蛋白浓度。
1.2.5.2 高铁肌红蛋白浓度测定 高铁肌红蛋白浓度采用Krzywicki的方法进行测定[25],高铁肌红蛋白百分含量计算公式如下:

其中,R1、R2和R3分别代表A572/A525、A565/A525和A545/ A525,而A572、A565、A545和A525则分别表示测定溶液在对应不同波长下的吸光值。
2 结果与分析
2.1 CM-Sephadex阳离子交换层析
将含有肌红蛋白的粗提液用平衡缓冲液A透析24h,上样到CM-Sephadex Fast Flow阳离子层析柱,可见层析柱内的柱料由白色逐渐变成红褐色。先用平衡缓冲液A洗去未结合的蛋白,结合的蛋白再用含0.5mol/L NaCl的同一缓冲液进行梯度洗脱,洗脱速度0.4mL/min。约30min记录仪上出现第一个洗脱峰B,对应液体为无色;约140min记录仪上出现第三个洗脱峰D,对应液体为红褐色,250min对应的洗脱峰E液体为深红色,见图1。与经一次葡聚糖Sephadex G-75凝胶过滤层析得到的洗脱图[12-13]相比,CM-Sephadex Fast Flow柱料可将肌红蛋白粗提液充分洗脱分开,这可能与提取方法、不同层析方式,以及柱料有关[11]。

图1 高铁肌红蛋白阳离子层析图谱Fig.1 Metmyoglobin ion chromatogram
2.2 SDS-PAGE电泳
把经硫酸铵粗提后得到的高铁肌红蛋白粗提液及图1中五个洗脱峰对应的洗脱样品,进行SDSPAGE电泳实验,结果见图2。由图2可知,粗提液A中不同分子量的蛋白,在经过CM-Sephadex阳离子交换柱层析后,得到很好的分离,其中层析图中D峰对应的蛋白质分子量大约为17000。而马心肌红蛋白[26]、野牛心肌红蛋白[14]、山羊心肌红蛋白[27]等多种哺乳动物肌红蛋白分子量均为17000左右[4]。据此初步判定层析图中D峰即为目标肌红蛋白峰。
此前对沙丁鱼肌红蛋白提取纯化的报道中,虽然经过了两次柱层析,仍可在电泳图中清晰的看到杂蛋白条带[12],而本实验尽管仅通过一次柱层析,却未发现任何明显杂蛋白条带存在。这为更加快速精确地提取、纯化电泳纯高铁肌红蛋白提供了一条解决途径。

图2 电泳实验图Fig.2 SDS-PAGE pattern
2.3 分光光度计扫描
先前对肌红蛋白分离、纯化的报道中,几乎都只采用一种方法,主要是SDS-PAGE电泳,对得到的样品进行鉴定[4,27]。本实验采用两种方法对经过一次柱层析得到的目标样品进行鉴定。经SDS-PAGE电泳初步鉴定后,将洗脱峰D对应洗脱液在350~700nm处进行光谱扫描。图3的扫描图谱显示,该溶液在410、505、630nm处附近有特征吸收峰,这与Millar等的报道一致[22,28]。据此可进一步判定该蛋白即为高铁肌红蛋白。
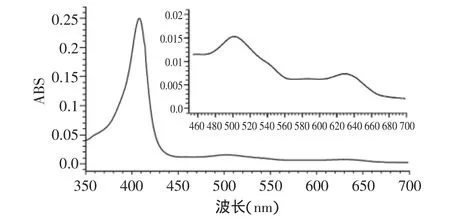
图3 D峰对应光谱扫描图Fig.3 Absorption spectrum of D peak elution
2.4 高铁肌红蛋白得率研究
组织匀浆在加入过量铁氰化钾,硫酸铵盐析和CM-Sephadex Fast Flow柱层析后,分别测定提取液总蛋白和高铁肌红蛋白含量,如表1所示。由于仅通过一次柱层析,最终得率高达23.8%,显著高于经过两次柱层析,进行猪心肌高铁肌红蛋白提取的得率(14.1%)[11]。

表1 高铁肌红蛋白纯化过程Table 1 Purification process of metmyoglobin
3 结论
新鲜驴心肌经磷酸盐缓冲液萃取后,采用70%~100%饱和硫酸铵进行分段盐析,加入铁氰化钾氧化后透析,经CM-Sephadex Fast Flow阳离子交换进行一次柱层析。结果表明,层析过程中第三个洗脱峰洗脱出的蛋白质对应SDS-PAGE电泳结果为单一条带,其分子量在17000左右;紫外/可见光光谱扫描分析表明其在410、505、630nm处有特征吸收峰,鉴定其为高铁肌红蛋白。这样,仅通过一次柱交换,即可得到电泳纯的高铁肌红蛋白,得率高达23.8%,为快速、高效提取纯化高铁肌红蛋白提供了一条途径。
[1]Zhang X,Kong B H,Xiong Y L.Production of cured meat color in nitrite-free Harbin red sausage by Lactobacillus fermentum fermentation[J].Meat Science,2007,77(4):593-598.
[2]李沛军,孔保华,郑冬梅.微生物发酵法替代肉制品中亚硝酸盐呈色作用的研究进展[J].食品科学,2010,31(17):388-391.
[3]孔保华,马丽珍.肉品科学与技术[M].北京:中国轻工业出版社,2003:71-72.
[4]Joseph P,Suman S P,Li S,et al.Mass spectrometric characterization and thermostability of turkey myoglobin[J].LWTFood Science and Technology,2010,43:273-278.
[5]Mancini R A,Hunt M C.Current research in meat color[J]. Meat Science,2005,71(1):100-121.
[6]Chaijan M,Benjakul S,Visessanguan W,et al.Interaction betweenfishmyoglobinandmyosininvitro[J].FoodChemistry,2007,103(4):1168-1175.
[7]Hendgen-Cotta UB,Kelm M,Rassaf T.A highlight of myoglobin diversity:The nitrite reductase activity during myocardial ischemia-reperfusion[J].Nitric Oxide,2010,22(2):75-82.
[8]Kasaoka S,Todani M,Kaneko T,et al.Peak value of blood myoglobin predicts acute renal failure induced by rhabdomyolysis [J].Journal of Critical Care,2010,25(4):601-604.
[9]Morita H,Sakata R,Nagata Y.Nitric oxide complex of iron(II)myoglobin converted from metmyoglobin by staphylococcus xylosus[J].Journal of Food Science,1998,63(2):352-355.
[10]王永林,赵建生.高铁肌红蛋白还原酶活力与肉色稳定性关系的研究[J].肉类研究,2010(3):21-25.
[11]汤祥明,金邦荃,曹鹏,等.猪心肌中高铁肌红蛋白的提取和纯化[J].畜牧与兽医,2006,38(7):34-36.
[12]Chaijan M,Benjakul S,Visessanguan W,et al.Characterisation of myoglobin from sardine(Sardinella gibbosa)dark muscle[J]. Food Chemistry,2007,100(1):156-164.
[13]Enoki Y,Ohga Y,Ishidate H,et al.Primary structure of myoglobins from 31 species of birds[J].Comparative Biochemistry and Physiology,2008,149:11-21.
[14]Joseph P,Suman S P,Li S,et al.Characterization of bison(Bison bison)myoglobin[J].Meat Science,2010,84(1):71-78.
[15]孙京新,周光宏,罗欣.不同质量猪肉冷藏期间高铁肌红蛋白还原酶活性及相关特性变化研究[J].食品科学,2009,30(18):389-393.
[16]王玮,汤宇,金邦荃.猪心肌高铁肌红蛋白还原酶米氏方程建立与动力学研究[J].食品科学,2009,30(17):176-180.
[17]Møller J K S,Jensen J S,Skibsted L H,et al.Microbial formation of nitrite-cured pigment,nitrosylmyoglobin,from metmyoglobin in model systems and smoked fermented sausages by Lactobacillus fermentum strains and a commercial starter culture[J].European Food Research and Technology,2003,216(6):463-469.
[19]Gøtterup J,Olsen K,Knöchel S,et al.Relationship between nitrate/nitrite reductase activities in meat associated staphylococci and nitrosylmyoglobin formation in a cured meat model system [J].International Journal of Food Microbiology,2007,120(1):303-310.
[20]Polidori P,Cavallucci C,Beghelli D,et al.Physical and chemical characteristics of donkey meat from Martina Franca breed[J].Meat Science,2009,82(4):469-471.
[21]James T Wu,Robert K Pleper,Lily H Wu,et al.Isolation and characterization of myoglobin and its two major isoforms from sheep heart[J].Clinical Chemistry,1989,35(5):778-782.
[22]Millar S J,Moss B W,Stevensona M H.Some observations on the absorption spectra of various myoglobin derivatives found in meat[J].Meat Science,1996,42(3):277-288.
[23]Laemmil U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227:680-685.
[24]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principleofprotein-dye binding[J].Analytical Biochemistry,1976,72:248-254.
[25]Krzywicki k.The determination of haem pigments in meat [J].Meat Science,1982,7(1):29-36.
[26]Boardman N K,Adair G S.Isolation of two myoglobins from horse-heart extracts and the determination of the molecular weight of the main component[J].Nature,1956,177(4519):1078-1079.
[27]Suman S P,Joseph P,Li S,et al.Primary structure of goat myoglobin[J].Meat Science,2009,82(4):456-460.
[28]Motoyama M,Kobayashi M,Sasaki K,et al.Pseudomonas spp convert metmyoglobin into deoxymyoglobin[J].Meat Science,2010,84(1):202-207.
Extraction and purification of metmyoglobin from donkey(Equus asinus)heart muscle by single-step chromatography
LI Pei-jun,KONG Bao-hua*,ZHENG Dong-mei,CHEN Qian
(College of Food Science,Northeast Agricultural University,Harbin 150030,China)
Myoglobin and its existing states are responsible for the color of meat and meat products,of which metmyoglobin is an important one.Myoglobin was extracted from donkey(Equus asinus)heart muscle by ammonium sulfate fractionation(70%~100%).After oxidized by potassium ferricyanide and dialyzed,the sample solution was further purified by CM-Sephadex Fast Flow ion exchange column chromatography.The results of SDS-PAGE electrophoresis and absorption spectra analysis showed that metmyoglobin in electrophoresis pure was obtained by single column chromatography.This provided a fast and efficient way for extraction and purification of metmyoglobin.
donkey heart muscle;metmyoglobin;purification;electrophoresis pure
TS201.2+1
B
1002-0306(2012)01-0200-04
2011-01-17 *通讯联系人
李沛军(1986-),男,博士研究生,研究方向:畜产品加工与贮藏。
国家公益性行业(农业)科研专项经费项目(200903012-02);东北农业大学创新专项基金(CXZ011)。

