菊芋多糖提取过程中的pH控制策略研究
梁 磊,李 平,朱明军,*
(1.广州甘蔗糖业研究所,广东广州510316;2.华南理工大学生物科学与工程学院,广东广州510006)
菊芋多糖提取过程中的pH控制策略研究
梁 磊1,李 平2,朱明军2,*
(1.广州甘蔗糖业研究所,广东广州510316;2.华南理工大学生物科学与工程学院,广东广州510006)
采用未漂洗和漂洗过的菊芋做原料,在pH5.0~9.0,85℃、固液比1∶10下提取,并在60~120min每隔10min取样分析,得出如下结论:pH越低,提取液中的还原糖含量越高;pH越高,提取液中的蛋白质的含量越高;菊糖含量在100min左右达到最高值。考虑还原糖及蛋白质等杂质、脱色及菊糖的含量,未漂洗的原料最佳提取条件为pH7.0,提取110min,其菊糖含量为88.43g/L,菊糖提取率为76.46%;漂洗过的原料最佳提取条件则是pH7.0,提取100min,其菊糖含量为86.10g/L,菊糖提取率为72.65%。
pH控制策略,菊糖,提取率
菊芋(Helianthus tuberosus)俗称洋姜、姜不辣,是菊科向日葵属多年生草本植物[1-3]。菊芋具有耐寒、耐旱、耐盐碱、抗风沙、适应性广、繁殖性强等优点,亩产块茎达2000~4000kg,且菊粉含量高,占其块茎干重的60%~80%[4]。菊糖是由D果糖经(1-2)糖苷键聚合成的聚合度为2~60左右的线性多糖。菊粉可作为保健食品防治糖尿病、高血压、高血脂等,并可作为脂肪替代物用于食品生产中[5-8]。目前菊糖提取大多采用热水浸提法,工艺简单,但其中存在单糖、蛋白质等杂质,而提取液的pH对这些杂质的含量及提取率的高低影响较大。本文研究了pH对提取液中杂质含量及提取率的影响,旨在为菊糖提取产业化提供技术支持。
1 材料与方法
1.1 材料与仪器
菊芋 1号原料在切片加工过程中未经过漂洗,2号原料在切片加工过程中经过漂洗(自来水直接冲洗),二者均为经过切片烘干后的成品,来自湖北仙桃;3,5-二硝基水杨酸、蒽酮 购自国药集团化学试剂有限公司;苯酚、硫酸、磷酸 购自广东光华化学厂有限公司;葡萄糖、果糖 购自天津市大茂化学试剂厂;考马斯亮蓝G250 购自上海伯奥生物科技有限公司;以上试剂 均为分析纯。
FW100型粉碎机 天津泰斯特有限公司;MA35水分测定仪 德国赛多利斯集团;HH-6型恒温水浴锅 金坛市宏华仪器厂;5804R冷冻离心机 德国Eppendorf;尤尼柯2802SH型紫外可见分光光度计 上海仪器有限公司。
1.2 实验方法
1.2.1 粗菊粉的制备及水分测定 将原料1和原料2用粉碎机粉碎,过40目筛,立即装入聚乙烯袋中,放入冰箱中备用。取少量样品,放入水分测定仪中,设定参数120℃、30min,测得1号原料水分含量为8.05%,2号原料水分含量为6.84%。
1.2.2 菊糖的提取 取500mL三角瓶5个,每个加入预先加热到85℃的去离子水200mL,再加入20g(按干重计)的粗菊粉,分别调节pH到5.0、6.0、7.0、8.0、9.0,在85℃恒温水浴锅中提取120min。在60、70、80、90、100、110、120min分别取样10mL,立即放入冰箱,备用。将样品于4℃,3000×g离心15min即可用于各项指标的测定。
1.2.3 测定方法
1.2.3.1 菊芋提取液中还原糖的测定 采用DNS比色法[9]。
1.2.3.2 菊芋提取液中总糖的检测 采用蒽酮比色法[9]。
1.2.3.3 菊芋提取液中蛋白质含量的检测 采用考马斯亮蓝法(Bradford)测定可溶性蛋白的含量[10]。
1.2.4 计算 菊糖浓度=总糖浓度-还原糖浓度
菊糖得率=(提取液总糖质量-提取液还原糖质量)/粗菊粉中菊糖质量
粗菊粉中的菊糖质量=原料1菊粉干重×74.54%或原料2菊粉干重×72.98%(74.54%、72.98%均为多次提取测得的菊糖含量)
2 结果与分析
2.1 pH对提取液中还原糖含量的影响
按1.2.3.1中所述,对提取液中还原糖的含量进行了测定,结果如图1所示。从a、b两图可以看出两种原料在pH越低的情况下,提取液中的还原糖含量越高,这是因为在酸性条件下低聚果糖更容易降解成单糖,因此还原糖含量会越高。在提取过程中,菊芋多糖的水解为可逆过程,还原糖的量从60min开始到120min结束均变化不大。pH5.0条件下还原糖的量持续升高,可能是因为酸性较强,解聚作用占主要地位。
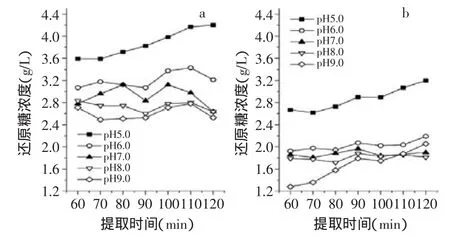
图1 不同pH对提取液中还原糖含量的影响注:a为原料1;b为原料2,图2、图3同。Fig.1 Effect of different pH on the concentration of reducing sugars of the extract
pH5.0条件下提取120min原料1,提取液的还原糖含量为4.20g/L,而pH9.0条件下还原糖含量为2.53g/L;pH5.0条件下提取120min原料2,提取液的还原糖含量为3.20g/L,而pH9.0条件下还原糖含量为2.05g/L。原料2的还原糖量较原料1低,可能是因为漂洗的过程使得一部分小分子的单糖流失。总体说来,还原糖的量从60min开始到120min结束,还原糖的量变化不大,所以在考虑最佳提取条件时,还原糖与时间的变化情况可以作为次要因素。
2.2 pH对提取液中蛋白质含量的影响
按1.2.3.3中所述,对提取液中蛋白质的含量进行了测定,结果如图2所示。从图2可以看出提取液中蛋白质的含量随pH的升高而升高。可能是因为大多数蛋白质的等电点都为低pH条件,故提取条件的pH越低,越接近蛋白质的等电点而使其沉淀下来。蛋白质沉降的作用力主要是热变性以及接近等电点时的疏水作用力。多种作用力相互作用导致蛋白质含量随时间呈现升高、降低交替变化的情况。总体来讲,蛋白质含量在80min左右达到最低值。同时两种原料的蛋白质含量并没有明显的区别,说明漂洗作用对提取液中蛋白质的含量影响不大。
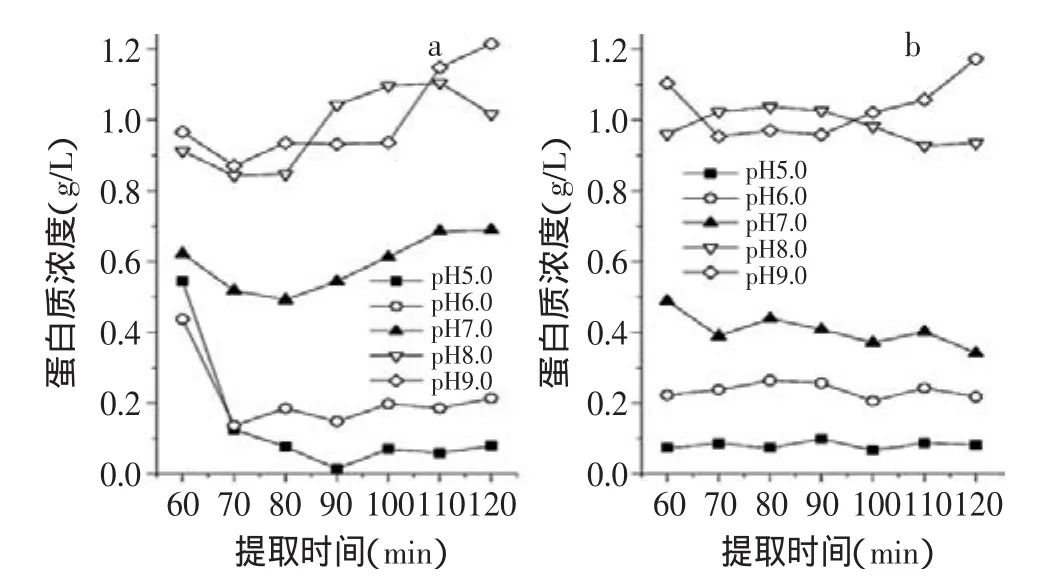
图2 不同pH对提取液中蛋白质含量的影响Fig.2 Effect of different pH on the concentration of the protein of the extract
2.3 pH对提取液中菊糖含量的影响
按1.2.3.2中所述,对提取液中总糖的含量进行了测定,按1.2.4进行计算,结果如图3所示。总的来说菊糖的量是随着提取时间的延长而增加的。说明提取时间越长,提取效果越好,但是提取时间延长会增加提取液中的杂多糖,同时提取能耗也相应增大。低pH(5.0~6.0)下菊糖浓度的高峰出现在90~100min;高pH(7.0~9.0)下菊糖浓度的高峰出现在100~110min。pH越高,总体上来讲菊糖的含量会稍高一些。
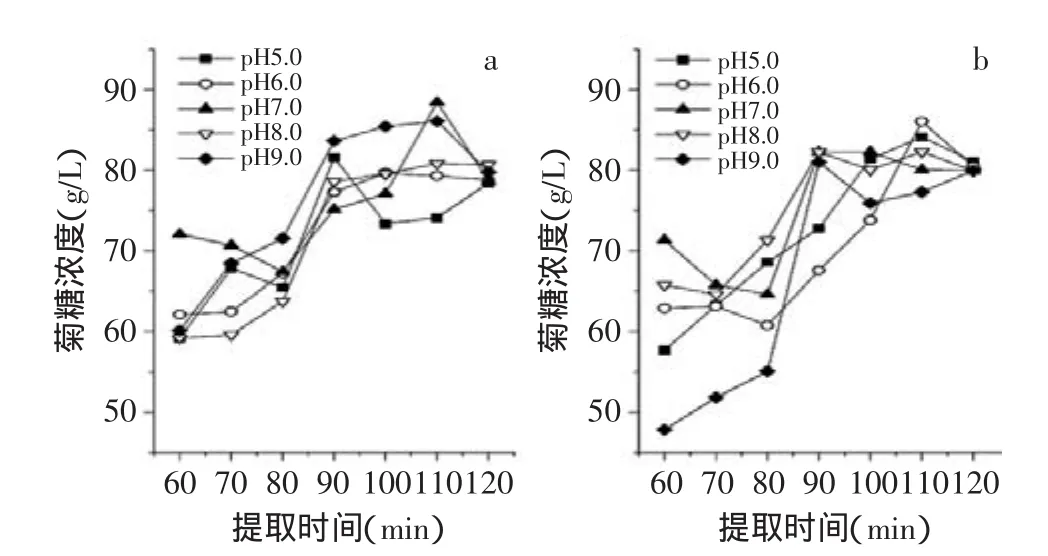
图3 不同pH对提取液中菊糖含量的影响Fig.3 Effect of different pH on the concentration of the inulin of the extract
110min,pH7.0条件下时原料1提取液的菊糖含量达到最高值为88.43g/L;100min,pH7.0条件下时原料2提取液的菊糖含量达到最高值为86.10g/L。
2.4 最佳提取条件的确定
原料1在不同pH条件下,提取液中的还原糖含量从pH7.0~9.0差异并不明显,同时在所研究的60min到120min内也变化不明显;在pH7.0,提取110min时菊糖含量最高,达到88.43g/L,而此时蛋白质的含量处于居中水平,同时我们在研究中还发现提取液的颜色随着提取液pH的升高而明显变深,这会对后续的脱色等工艺造成较大的困难。若降低提取液的pH,提取液中的菊糖含量明显下降,还原糖含量明显升高,且还原糖的脱除较困难;若升高提取液的pH,提取液中的蛋白质含量也有较大的提高,蛋白质这样的大分子物质对产品质量影响较大,且菊糖含量也有下降,故选定pH7.0,提取110min作为原料1的最佳提取条件。同理可确定pH7.0,提取100min作为原料2的最佳提取条件。
按固液比1∶10,提取温度85℃及以上最佳pH及时间分别对原料1和原料2进行提取并收集提取液,按1.2.4进行计算,得到原料1的提取率为76.46%,原料2的提取率为72.65%(具体数据未呈现)。这一提取率较杨振等[8]提取的结果高,可能是提取温度的提高及提取时间的延长所致;但较何新华等[11]的结果低,可能是因为本文所用的固液比值较高的原因。采用较高的固液比也是考虑到工业应用,若采用较低的固液比,工业用水会较大,进而增加成本。固液比与提取pH及提取时间的相互关系尚需进一步研究。
3 结论
通过对两种原料的菊芋进行提取及还原糖、蛋白质及总糖的测定发现,pH对提取效果的影响较大。pH越低,提取液中还原糖含量越高;pH越高,提取液中蛋白质的含量越高,但二者随提取时间的延长变化都不大。较低pH条件下,菊糖含量在90~100min达到高峰;在较高pH条件下,菊糖含量在100~110min达到高峰。综合考虑菊糖含量、还原糖含量、蛋白质含量及提取液色度等条件,原料1的最佳提取条件为pH7.0,提取110min;原料2则为pH7.0,提取100min。
通过进一步的研究表明,超滤系统对蛋白质的脱除作用较明显;而超滤系统对还原糖的脱除能达到100%,这对于产品的品质有较大的提升,但损失较严重。今后的研究应着重关注怎样采用安全、低成本的方法对提取液进行蛋白质等杂质的脱除以及脱色问题。
[1]何新华,郑表松,刘玲,等.菊芋菊粉纯化中的脱蛋白和脱色工艺条件研究[J].南京农业大学学报,2009,32(3):83-87.
[2]孔涛,吴祥云,刘璇,等.菊芋菊糖最佳提取工艺[J].辽宁工程技术大学学报:自然科学版,2009,28(2):229-231.
[3]高健,彭斌,徐虹.菊芋中菊糖的提取分离研究[J].安徽农业科学,2009,37(1):184-185.
[4]董全,丁红梅.菊芋低聚果糖生产及前景展望[J].中国食物与营养,2009(4):16-18.
[5]吴洪新,呼天明,张存莉,等.菊苣菊粉提取与纯化研究[J].西北农林科技大学学报:自然科学版,2006,34(6):91-95.
[6]李雪雁,张维,张秀兰,等.菊芋可溶性蛋白的提取及分子质量的测定[J].食品与发酵工业,2010,36(3):184-186.
[7]张泽生,张建平,王浩,等.菊芋菊糖的超声波提取、纯化及HPLC法纯度检测[J].食品工业科技,2009,30(6):260-262.
[8]杨振,杨富民,王雪燕.菊芋中菊粉提取工艺优化研究[J].甘肃农业大学学报,2009(5):147-151.
[9]大连轻工业学院,华南理工大学,郑州轻工业学院,等.食品分析[M].北京:中国轻工业出版社,1994:18-180.
[10]王福荣.生物工程分析与检验[M].北京:中国轻工业出版社,2006:118-125.
[11]何新华,刘玲,张静,等.菊芋总糖和菊粉提取工艺条件优化[J].食品工艺,2009,30(8):76-79.
Study on strategy of pH control on the inulin extraction from Jerusalem artichoke
LIANG Lei1,LI Ping2,ZHU Ming-jun2,*
(1.Guangzhou Sugarcane Industry Research Institute,Guangzhou 510316,China;2.School of Bioscience and Bioengineering,South China University of Technology,Guangzhou 510006,China)
Two kinds of Jerusalem artichoke(rinsed and unrinsed)were used for inulin extraction at the condition of 85℃,solid/liquid ratio of 1∶10,and the pH of 5.0~9.0.The reducing sugars concentration of the extraction increased with lower pH;while the protein concentration of the extraction increased with higher pH.The highest inulin concentration was reached at 100min.Considering the inulin concentration,the impurities(reducing sugars and protein)and the color of the extraction,the optimum extraction conditions for the unrinsed material and rinsed material were pH7.0,110min and pH7.0,100min,respectively.The inulin concentration and extraction rate for unrinsed material and rinsed material were 88.43g/L,76.46%and 86.10g/L,72.65%,respectively.
strategy of pH control;inulin;extraction rate
TS201.1
B
1002-0306(2012)01-0220-03
2010-12-03 *通讯联系人
梁磊(1980-),男,博士,研究方向:食品生物技术、生物基材料。
国家自然科学基金(51078147);广东省科技计划项目(2010B031700022,2010A010500005)。

