蛹拟青霉发酵菌丝体中虫草酸的提取与测定
邵 颖,李 文,王 陶
(徐州工程学院食品生物工程学院,江苏徐州221008)
蛹拟青霉发酵菌丝体中虫草酸的提取与测定
邵 颖,李 文,王 陶
(徐州工程学院食品生物工程学院,江苏徐州221008)
虫草酸,即D-甘露醇,是虫草类真菌中的主要有效成分之一。为更好开发蛹虫草资源,研究了蛹拟青霉发酵菌丝体中虫草酸的提取工艺。依据大量单因素实验以及正交实验得出最佳提取条件为:微波时间80s,微波功率200W,料液比1∶100,乙醇浓度70%。在此条件下,对实验室20株蛹拟青霉进行了虫草酸的测定,结果表明22号菌株虫草酸含量高达160.39mg/g,有一定的生产应用价值。
蛹拟青霉,虫草酸,微波提取
蛹虫草又名北冬虫夏草、北虫草等,含有多种氨基酸,其药理作用与冬虫夏草相似,对神经系统及心血管等疾病具有治疗效果,并有抗肿瘤和抗衰老等作用[1]。虫草酸,即D-甘露醇,化学分子式C7H12O6,为1,3,4,5-四羟基环已酸[2]。虫草酸含量的高低是衡量虫草质量的主要标准之一,一般认为虫草酸含量高的虫草的药用价值高[3]。虫草酸能抑制各种病菌的成长,具有利尿脱水、提高血浆渗透压、镇喘祛痰、抗自由基等药理作用,虫草酸能保肺益肾、止血化痰,明显增强支气管纤毛活动能力,调节支气管平滑肌,虫草酸能降低血液中胆固醇、甘油三脂的含量,预防血栓的形成,并且对多种疾病有一定的疗效。甘露醇现已被认为是发酵虫草菌丝体中活成分的重要测试指标[4-9]。本文以实验室多株蛹拟青霉菌株为研究对象,通过单因素及正交实验来确定蛹拟青霉菌丝体虫草酸的最优微波提取工艺条件,利用紫外分光光度法对不同菌株的菌丝体中虫草酸含量比较来确定高产菌株,为蛹虫草资源的进一步开发、应用提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
蛹拟青霉(Cordyceps militaris)菌株(13号为原始菌株,其余菌株为13号菌株经低能离子束诱变后获得的生长性状较好的正变株) 由徐州工程学院食品工程学院实验室保存;D-甘露醇 分析纯,国药集团化学试剂有限公司;高碘酸钾 分析纯,天津市北方天医化学试剂厂;其他试剂 均为分析纯;斜面培养基 SDAY培养基(葡萄糖4%,蛋白胨1%,酵母浸膏1%,琼脂2%);液体培养基 SDY培养基(葡萄糖4%,蛋白胨1%,酵母浸膏1%);发酵培养基 SDY培养基(葡萄糖4%,蛋白胨1%,酵母浸膏1%)。
CW-2000超声波微波协同萃取仪 新拓微波溶洋测试技术有限公司;TU-1810紫外分光光度计 北京普析通用仪器有限责任公司;HH.B11.600-S-Ⅱ型电热恒温培养箱 上海跃进医疗器械厂;HYG摇瓶柜 上海欣蕊自动化设备有限公司。
1.2 实验方法
1.2.1 菌株的培养及样品的制备
1.2.1.1 发酵菌丝体的制备 将于液体培养基培养7d的蛹拟青霉液体种子以10%的接种量接种于装有发酵培养基的500mL三角瓶中,装液量为200mL,发酵培养温度为25℃,摇床转速200r/min,发酵5d后收集发酵醪液。对发酵醪液进行固液分离,湿菌丝体用蒸馏水反复冲洗3次,收集菌体,冷冻干燥后,粉碎过100目筛备用。
1.2.1.2 测定样品的制备 精密称取菌丝体干粉0.5g,采用实验所得最优提取方法提取虫草酸,过滤,用蒸馏水洗残渣;将滤液、洗液合并于100mL容量瓶中,加蒸馏水定容至刻度。再从中精密量取溶液1.0mL置于100mL容量瓶中,加蒸馏水定容至刻度作为待测样品。
1.2.2 分析检测方法
1.2.2.1 虫草酸提取方法的优化 通过料液中乙醇的浓度、料液比、微波提取功率、微波提取时间来确定单因素最佳条件。再根据单因素水平实验结果,设计L9(34)正交实验方案进行正交实验以确定最优提取条件组合。正交实验表见表1。

表1 正交实验设计Table 1 Design of orthogonal test
1.2.2.2 标准曲线的制作 取浓度为10、20、30、40、50μg/mL标准品虫草酸溶液各1mL,分置5个10mL试管中,分别加入1mL高锰酸钾溶液混匀,室温放置10min,加2mL 0.1%L-鼠李糖溶液以除去过多的高锰酸盐,混匀后加4mL新鲜配制的nash试剂,53℃水浴加热15min使其呈色,冷却,用紫外分光光度计在412nm波长处,以蒸馏水(1mL)代替虫草酸标准溶液,用同样方法操作做为空白,分别测定其吸光度。以浓度c为横坐标,吸光度A为纵坐标制得标准曲线[10]。1.2.2.3 样品中虫草酸含量的检测 将20株蛹拟青霉菌株的发酵菌丝体配制成待测样品,测定其吸光度,根据标准曲线方程计算虫草酸含量。
2 结果与分析
2.1 D-甘露醇标准曲线
以浓度c为横坐标,吸光度A为纵坐标制得D-甘露醇的标准曲线,如图1所示。可以看出吸光度测定值与质量浓度之间有良好的线性关系,其回归方程为:A=0.011c+0.0025,R=0.9998。将提取好的样品测定其吸光度,根据标准曲线,计算虫草酸的含量。
2.2 单因素最佳提取条件的确定
2.2.1 乙醇浓度的确定 固定其他三个因素不变(微波时间80s,微波功率300W,料液比(w/v)1∶60),只改变乙醇的浓度(0%、10%、30%、50%、70%、90%乙醇),如图2所示。可以看出随着料液比中乙醇的浓度的递增,虫草酸含量也随着增加,而当料液比中乙醇的浓度为50%时,虫草酸含量最大;当料液比中乙醇的浓度为70%、90%时,虫草酸含量呈现下降趋势,由此看出,当料液比中乙醇的浓度50%时,虫草酸含量最大,所以最佳料液比中乙醇的浓度为50%,即单因素最佳。
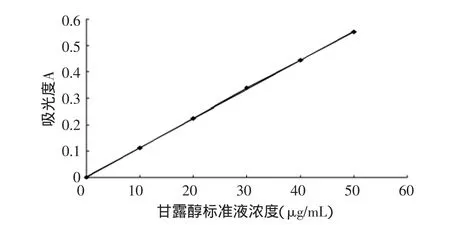
图1 甘露醇标准曲线Fig.1 Standard curve of D-mannitol

图2 乙醇浓度对虫草酸含量的影响Fig.2 Effect of ethyl alcohol concertration on cordycepic acid content
2.2.2 最佳料液比的确定 固定其他三个因素不变(微波时间80s,微波功率300W,乙醇浓度为50%),只改变料液比(w/v)(1∶20、1∶40、1∶60、1∶80、1∶120),如图3所示,可以看出随着提取溶液的增加,更有利于虫草酸的溶出。当料液比增加到1∶80时,提取率最高。随后随着料液比的增加,虫草酸的含量反而降低。故选择最佳提取料液比为1∶80。
图3 料液比对虫草酸含量的影响Fig.3 Effect of material-liquid ratio on cordycepic acid content
2.2.3 最佳微波功率的确定 固定其他三个因素不变(微波时间80s,料液比(w/v)1∶80,乙醇浓度50%),只改变功率(100、150、200、250、300W),结果如图4所示,可以看出随着微波功率的增加,物质的加热程度也随着增加,有利于虫草酸的提取。在微波功率达到200W时,虫草酸含量最高。之后,虫草酸含量开始减小。这可能是因为微波功率太大,产热更快,使部分虫草酸含量有所损失的原因。故选择最佳微波提取功率为200W。
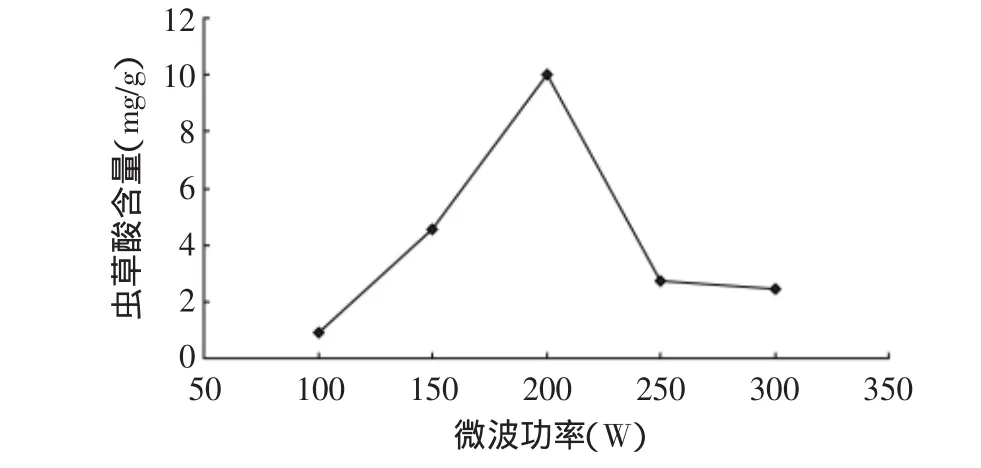
图4 微波功率对虫草酸含量的影响Fig.4 Effect of microwave power on cordycepic acid content
2.2.4 最佳微波提取时间的确定 固定其他三个因素不变(微波功率200W,料液比(w/v)1∶80,乙醇浓度50%),只改变提取时间(20、40、60、80、100、120s),结果如图5所示。由图看出,微波作用时间为20s时,虫草酸不能充分的转移到溶液中,随着时间的增加,虫草酸含量逐渐增加。在40s时达到一个小峰值,之后继续增加时间,虫草酸含量就继续增幅,这就是微波的作用效果。在80s时达到最大,其后又下降,这是因为随着微波时间的增加,温度急剧升高,导致提取液部分挥发而使虫草酸的含量有所损失,故以微波时间80s作为后续实验依据。

图5 微波时间对虫草酸含量的影响Fig.5 Effect of microwave time on cordycepic acid content
2.3 正交实验确定最优条件
正交实验结果如表2所示。由表2可知,四因子作用的大小顺序为乙醇浓度(D)gt;料液比(C)gt;微波功率(B)gt;微波时间(A),其最优方案为A1B2C3D3,即蛹拟青霉菌丝体以70%乙醇溶液为提取溶剂、料液比1∶100(w/v)、微波功率200W的条件下提取80s。但是由于最佳组合不在实验设计中,需做验证实验。
按照正交实验优选工艺A1B2C3D3和实验设计中的最优组合A1B3C3D3,平行3次,进行验证,A1B2C3D3工艺的虫草素含量平均达58.298mg/g,而A1B3C3D3工艺才53.182mg/g。通过差异显著分析,T=3.586>t0.05/2(4)= 2.776,表明在α=0.05水平两种提取工艺有显著性差异,因此,最优提取工艺为A1B2C3D3。
2.4 不同菌株的虫草酸含量
用优化得到的最佳提取条件即70%乙醇溶液为提取溶剂、料液比1∶100(w/v)、微波功率200W、提取时间80s提取蛹拟青霉液体发酵菌丝体中的虫草酸,并测定含量。测定结果如表3所示。
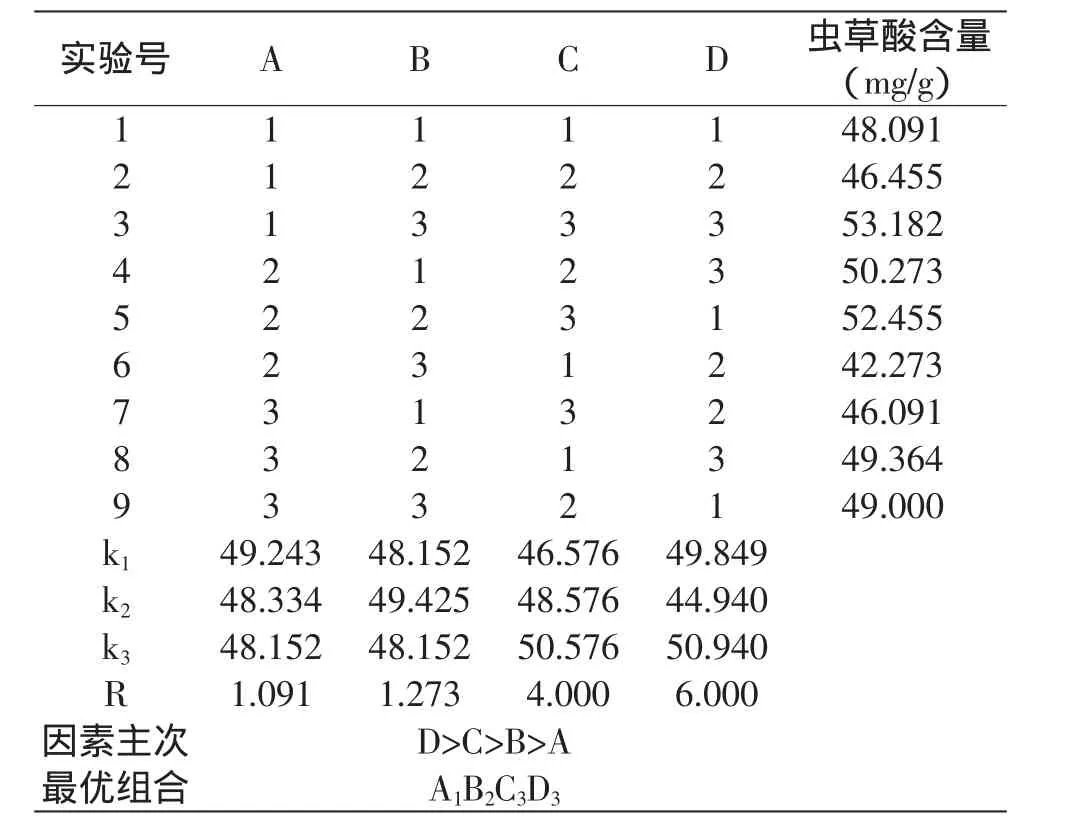
表2 正交实验结果Table 2 Results of orthogonal test
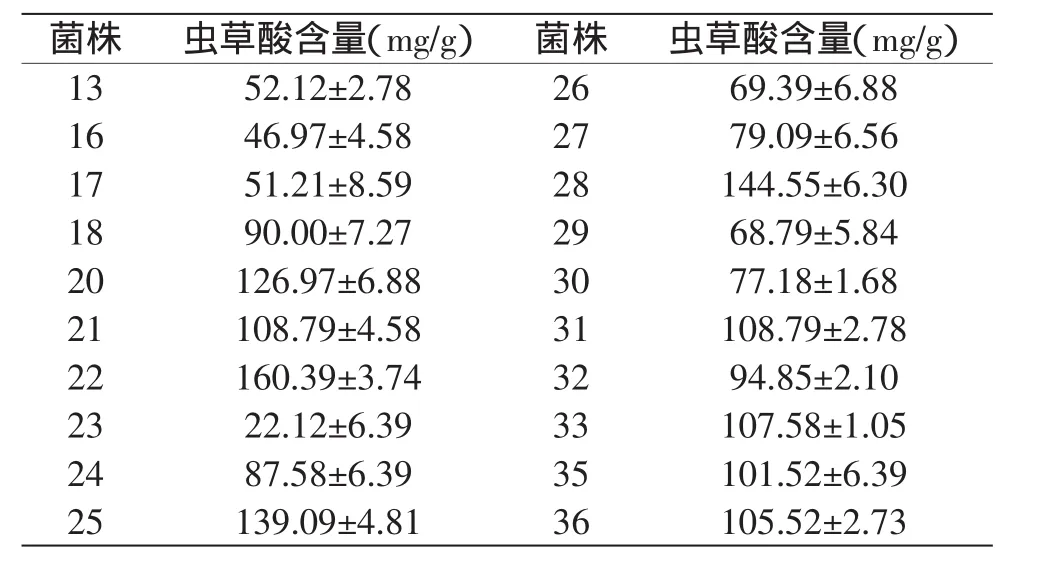
表3 不同菌株的虫草酸含量Table 3 Cordycepic acid content of different strains
由表3的实验结果可以看出,测定的20株菌株中22、25、28号菌株的发酵菌丝体中虫草酸含量较大,22号菌株的虫草酸含量最高,高达160.39mg/g。
2.5 样品显色后稳定性实验
精密量取1mL浓度为0.05mg/mL(按原料计)的13号蛹拟青霉菌丝体提取液,使其呈色,每间隔20min测定其吸光度值,连续测定了3h,并计算虫草酸含量,以考察其稳定性。结果如表4所示。根据表中数据,经过计算得出RSD为2.66%。
结果表明:随着时间的推移,样品在412nm处的虫草酸含量变小,稳定性降低。待测样品在前20min表现出比较稳定,40min之后比较有规律地等差降低,但是降低幅度很小,由此,可以认为样品显色后在180min之内表现较稳定[11]。
3 结论与讨论

表4 呈色物质的稳定性Table 4 Stability of chromogenic reagent
本实验通过大量实验得出蛹拟青霉发酵菌丝体中虫草酸含量的最佳提取方案,最佳提取条件为:乙醇浓度70%,料液比为1∶100,微波功率为200W,微波时间80s。比较分析原始蛹拟青霉菌株(13号菌株)及其低能离子束诱变菌株的液体发酵菌丝体中的虫草酸含量后发现诱变菌株22、25、28号菌株的虫草酸含量较高,其中22号菌株的含量最高,在以后的研究中可以作为参考。实验过程中,菌株发酵菌丝体中虫草酸含量测定方法利用比色法进行,该方法操作简便、准确,精密度较好,可以作为虫草类产品生产中虫草酸检测的一种通用方法。
[1]韦会平,肖波,胡开治.蛹虫草药用价值[J].中药材,2004,27(3):215-216.
[2]蔡友华,范文霞,刘学铭,等.比色法测定巴西虫草菌丝体中虫草酸的含量[J].现代食品科技,2008,24(1):76-79.
[3]顾振宇,吴雪美,张虹.高效液相色谱法测定冬虫夏草中虫草素和虫草酸的含量[J].中国食品学报,2007,7(3):144-148.
[4]王英娟,李多伟,王义潮,等.蛹虫草中虫草素虫草多糖综合提取工艺研究[J].西北植物学报,2005,25(9):1863-1867.
[5]刘东泽,陈伟,高新华,等.虫草菌素(3’-脱氧腺苷)研究进展[J].上海农业学报,2004,20(2):89-93.
[6]夏敏,温鲁.微波法提取虫草素研究[J].食品科学,2006,27(10):248-251.
[7]汪宇,于荣敏,汪晓宁.利用虫草属药用真菌提取分离核苷类物质的研究进展[J].中国药房,2004(1):53-54.
[8]戴贺桥,唐建兵,洪继东,等.冬虫夏草防治肿瘤放化疗毒副作用及调节细胞免疫作用的临床研究[J].中国现代医学杂志,1996,6(4):28-29.
[9]朱明伟,温鲁,魏鹏.不同培养液对蛹虫草多糖及虫草酸含量的影响[J].安徽农业科学,2008,36(2):573-574.
[10]李婧.虫草素的体内代谢特点及药理作用[J].国外医学中医中药分册,2005,27(5):283-286.
[11]李颜,史薇娜,唐庆九.比色法测定冬虫夏草和蛹虫草中多糖和甘露醇的含量[J].食用菌学报,2007,14(3):53-57.
Extraction and determination of cordyceps acid in submerged fermentation mycelium of Cordyceps Militaris strains
SHAO Ying,LI Wen,WANG Tao
(Food Engineering Department,Xuzhou Insititute of Technology,Xuzhou 221008,China)
Cordyceps acid,that is,D-mannitol,is one of the main active ingredients in the type of fungus cordyceps.To explore Cordyceps militaris better,the extracting technology of cordyceps acid in several strains of Cordyceps militaris was determined.According to a large number of single-factor experiments and orthogonal design,the best extraction conditions were drawn:microwave time 80s,microwave power 200W,material-liquid ratio 1∶100,ethanol solvent concertration 70%.The strain with the highest acid content among 20 kinds of Cordyceps militaris strains was No.22 strain,whose cordyceps acid content was 160.39mg/g,which had value in production and application.
Cordyceps militaris;cordyceps acid;microwave assisted extraction
TS201.2
B
1002-0306(2012)01-0262-04
2011-01-07
邵颖(1979-),女,微生物学博士,讲师,主要从事微生物资源的开发和应用研究。
徐州工程学院校级课题(XKY2007224和XKY2009122)。

