缺血后处理对SH-SY5Y 细胞缺血再灌注模型的保护作用
李 燕 毛善平 翁小东 邢变枝 刘 军
随着介入技术的逐渐成熟,脑血管病介入治疗渐趋普遍,然而介入治疗后的再灌注损伤不容忽视,因此寻找有效的神经细胞保护方法是临床上亟待解决的问题。缺血后处理(Ischemic postconditioning,Postcond)指在缺血发生后长时间再灌注之前对脏器进行数次短暂的再灌注/缺血循环处理方法[1]。它与缺血预处理一样,能够减轻再灌注后脏器损伤,由于缺血后处理可在脏器缺血后应用,故比缺血预处理具有更大的临床应用前景。
Postcond发生机制尚未完全阐明,目前研究者多采用动物[2]或体外培养神经元[3]来模拟Postcond的发生,研究显示Postcond可以减小脑梗死的面积,提高动物的神经功能及行为评分,减少神经元死亡。但在体模型受多种条件的限制,结果也容易受很多因素的干扰。体外培养原代神经元可以使实验结果避免很多因素的干扰,提高可信度,但原代培养成功率低,神经元自然老化等原因致无法保证持续传代。SH-SY5Y 细胞系来源于人神经母细胞瘤(human neuroblastoma)株,具有类似神经元的形态和生理生化特性,增值迅速,可以连续稳定传代,是进行体外神经系统研究的理想选择。本研究应用SH-SY5Y 细胞建立缺血再灌注损伤模型,并予以后处理,通过光镜、荧光显微镜以及细胞计数(Cell Counting Kit-8)法、流式细胞术、SOD 活力检测细胞从形态到功能的改变。
1 材料与方法
1.1 细胞、试剂及仪器
SH-SY5Y 细胞购于中国科学院典型培养物保藏委员会细胞库;DMEM/F12培养基、胎牛血清购于Gibco公司;Cell Counting Kit-8(CCK-8)试剂盒购于日本同仁化学研究所;Annexin V-FITC 细胞凋亡检测试剂盒购于上海BestBio贝博生物;超氧化物歧化酶(SOD)WST-1法测定试剂盒购于南京建成有限公司;Bradford蛋白浓度测定试剂盒、RIPA 裂解液(强)、Hoechst33342试剂购于碧云天生物技术研究所。
三气培养箱(长沙华曦电子科技有限公司),酶标仪(Perkin Elmer),倒置荧光显微镜(日本奥林巴斯),流式细胞仪(Beckman Counter)。
1.2 方法
1.2.1 细胞培养
SH-SY5Y 细胞用DMEM/F12培养基、10%胎牛血清、100 U/ml青霉素及100 mg/ml链霉素于37 ℃、5%CO2、饱和湿度培养箱中培养;2 d换液1次,3~4 d传代1次,传代时用0.25%胰酶室温消化1 min。
1.2.2 缺血后处理模型构建
取对数生长期的SH-SY5Y 细胞以1.5×105/孔接种于直径为35 mm 的培养皿中,待细胞完全贴壁后弃培养基,PBS 洗2 次,分为3 组分别为正常组、缺血再灌注组、缺血后处理组,如图1a所示,缺血再灌注组和缺血后处理组于37 ℃、0.5%O2、5%CO2培养箱中进行糖氧剥夺12 h,参照Pignataro G等的做法[4]并加以改进,如图1b所示缺血后处理组予以3个循环正常培养10 min/糖氧剥夺10 min,再正常培养12 h,分别于倒置显微镜下观察细胞的形态、CCK-8试剂盒测定细胞的活力、hoechst染色于倒置荧光显微镜下观察细胞的凋亡、Annexin-FITC和PI双染于流式细胞仪定量分析细胞凋亡并测定细胞内SOD 活力的改变。

图1 缺血后处理模型建立流程图
1.2.3 CCK-8法检测细胞的活性
经过处理的SH-SY5Y 细胞弃培养基后加入提前配制的CCK-8稀释液(CCK-8 液:DMEM/F12完全培养为1∶9)0.5 ml,37 ℃避光培养4 h用酶标仪在450 nm 测定各组细胞的吸光度(OD 值),细胞存活率%=(实验组吸光度-空白对照组吸光度)/(阴性对照组吸光度-空白对照组吸光度)×100%。
1.2.4 Hoechst染色观察细胞凋亡
向处理过的SH-SY5Y 细胞培养基中加入Hoechst染液,混匀后37 ℃孵育20 min,在倒置荧光显微镜下观察细胞的凋亡。
1.2.5 Annexin V-FITC和PI双染凋亡检测
经过处理的SH-SY5Y 细胞收集培养基,PBS洗涤2次,胰酶消化细胞,与之前收集的培养基及PBS一起离心12000 r/m×5 min,再用PBS 洗2次,加入400μl Annexin V 结合液悬浮细胞。向细胞悬浮液中加入5μl Annexin V-FITC 染色液,混匀于4 ℃避光孵育15 min;再加入10μl PI染色液混匀于4 ℃避光孵育5 min,用流式细胞仪检测各组SH-SY5Y 细胞的凋亡率。
1.2.6 细胞内SOD 活力的测定
各组SH-SY5Y 细胞处理后弃培养基,预冷的PBS洗涤2次,加入RIPA 裂解液和蛋白酶抑制剂提取蛋白,按照超氧化物歧化酶(SOD)WST-1法测定试剂盒说明书测定各组SH-SY5Y 细胞SOD 的活力,用Bradford 法测定蛋白浓度。SOD 抑制率(%)=[(A 对照-A 对照空白)-(A 测定-A 测定空白)]/(A 对照-A 对照空白)×100% ;SOD活力(U/mgprot)=SOD 抑制率÷50%×反应体系稀释倍数÷待测样本浓度(mgprot/ml)。
1.2.7 统计学分析
2 结 果
2.1 SH-SY5Y 细胞形态学观察
如图2所示,倒置显微镜下观察可见正常组细胞密集,细胞间连接紧密,轴突细长均匀;缺血再灌注组活细胞数量减少,细胞皱缩变圆,细胞间连接稀疏;缺血后处理组的活细胞较缺血再灌注组明显增加,细胞间连接较紧密,形态较规则。

图2 光学显微镜下各组SH-SY5Y 细胞形态的改变
2.2 CCK-8法测定SH-SY5Y 细胞活性
经缺血再灌注的细胞存活率较正常组明显下降,为(69.669±2.467)%,与缺血再灌注组相比,缺血后处理组细胞存活率有所增加,为(78.66±7.038)%。任意两组相比均有明显差异(P<0.01)(图3)。
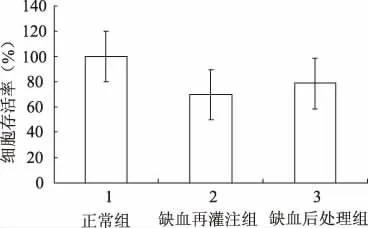
图3 CCK-8试剂盒测定各组SH-SY5Y 细胞存活率
2.3 Hoechst染色观察细胞凋亡
如图4所示,经Hoechst染色后在倒置荧光显微镜下观察可见,正常组胞核染成淡蓝色,缺血再灌注组较多的胞核致密浓染呈亮蓝色,或呈碎块状致密浓染;缺血后处理组浓染的胞核较缺血再灌注组明显减少。
2.4 Annexin V-FITC和PI双染凋亡检测
如图4所示,与正常组相比,缺血再灌注组活细胞明显减少,早期凋亡细胞和坏死细胞增加;经缺血后处理的细胞,较缺血再灌注组的活细胞增加,早期凋亡细胞和坏死细胞减少。在流式细胞仪的散点图上,左下象限显示活细胞,为FITC-/PI-;右上象限是非活细胞,即坏死细胞,为FITC+/PI+;而右下象限为早期凋亡细胞,FITC+/PI-(图5)。

图4 荧光显微镜下观察各组SH-SY5Y 细胞Hoechst染色情况
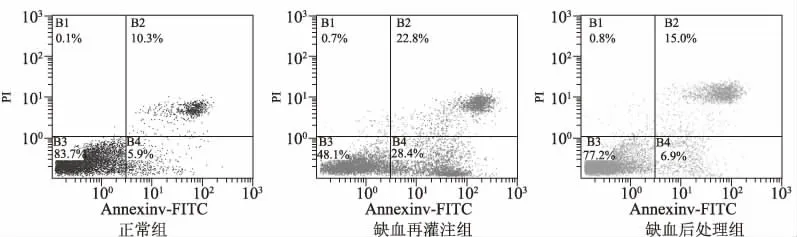
图5 Annexin V-FITC和PI双染检测细胞凋亡率
2.5 SH-SY5Y 细胞内SOD 活力的测定
与正常组相比,缺血再灌注组SH-SY5Y 细胞内SOD 活力由(22.318±1.340)U/mgprot下降至(11.991±2.128)U/mgprot,下 降46.27% (P<0.01);与缺血再灌注相比,缺血后处理组SH-SY5Y细胞内SOD 活力由(11.991±2.128)U/mgprot上升至(15.892±4.690)U/mgprot,上升32.53%(P<0.05)(表1)。
表1 各组SH-SY5Y 细胞SOD 活力的变化(±s,U/mgprot)

表1 各组SH-SY5Y 细胞SOD 活力的变化(±s,U/mgprot)
注:与正常组比较,△P<0.005;与缺血再灌注组比较,*P<0.05
组别 SOD 活力正常组 22.318±1.340缺血再灌注组 11.991±2.128△缺血后处理组 15.892±4.690△*
3 讨 论
在缺血性脑卒中的治疗中,无论是溶栓还是动脉介入治疗,目的都是使闭塞的脑动脉再通,恢复梗死区的血液供应。然而,再灌注过程往往加重组织细胞功能代谢障碍及结构破坏,即再灌注损伤。缺血后处理(Ischemic postconditioning,Postcond)是新发现的一种机体内源性抗再灌注损伤的保护现象,能够减轻再灌注后脏器损伤,与预处理相比,后处理的临床操作简便易行,在再灌注之前实施,时机易于掌握,可控性强,故可能具有更直接的临床应用价值。
Zhao等通过实验首次证实:缺血后处理组心肌梗死范围较对照组减小44%[1]。邢变枝等通过阻塞SD 大鼠大脑中动脉60 min建立脑梗塞模型,之后给予5个循环的30 s缺血/30 s再灌注后处理,结果显示Postcond可以减少脑梗塞面积,降低氧化应激水平,改善神经功能评分[4,5]。Jing-ye Wang等通过阻塞大鼠颈内动脉造成全脑缺血,并给与类似的后处理,结果与局部脑缺血模型一致[6]。Pignataro等对体外培养神经元实施120 min的糖氧剥夺(Oxygenglucose deprivation,OGD),制作体外缺血缺氧模型,再灌注10 min后实施10 min的OGD作为后处理措施明显降低了细胞死亡[3]。缺血后处理对脑缺血再灌注损伤的保护效果,其机制可能与减轻再灌注后细胞凋亡、减少氧自由基的生成、刺激内源性NO 释放、抑制炎症有关,并参与PI3K/AKT、MAPK 等信号通路[7],然而没有现成的较合理的理论来解释这一现象。
上述体内研究受多种条件的限制,结果也容易受很多因素的干扰。体外培养原代神经元可以使实验结果避免很多因素的干扰,提高可信度,但原代培养成功率低,神经元自然老化等原因致无法保证持续传代。本研究通过建立SH-SY5Y 细胞缺血再灌注损伤来研究Postcond的保护作用,不仅可以控制很多因素的干扰,而且SH-SY5Y 细胞易于培养,增值迅速,保证研究顺利进行。
本研究通过对SH-SY5Y 细胞进行糖氧剥夺后正常培养来模拟缺血再灌注现象,倒置显微镜下缺血再灌注组的细胞较正常组细胞生长密度明显减少,细胞皱缩变圆,细胞间连接稀疏,经CCK-8计数显示存活率显著下降(P<0.01),Hoechst染色及流式细胞术均表明缺血再灌注组的细胞早期凋亡及坏死的比例较正常组增加,这与刘守跃[8]的研究结果一致。缺血后处理组SH-SY5Y 细胞的形态较缺血再灌注组规则,细胞生长密度有所增加,细胞间连接较紧密,CCK-8 计数显示细胞存活率由(69.669±2.467)%上升至(78.66±7.038)%。如图4 所示,缺血后处理组SH-SY5Y 亮蓝色的胞核较缺血再灌注组少。同样,Annexin V-FITC 和PI双染流式细胞术分析表明缺血后处理组SH-SY5Y 早期凋亡及坏死的比例较缺血再灌注组下降。超氧化物歧化酶(superoxide dismutase,SOD)作为清除氧自由基的酶,比较稳定,可间接反应氧自由基对细胞的损害程度。与缺血再灌注组相比,缺血后处理组SHSY5Y 细胞内SOD 的活力有所增加(P<0.05)。
根据我们的实验结果,我们认为缺血后处理对SH-SY5Y 细胞缺血再灌注损伤有一定的保护作用,细胞从形态到功能均得到不同程度的改善,这可能与抑制细胞凋亡及降低氧自由基的损伤有关。该体外模型的建立,为今后更好地研究缺血后处理的机制奠定了基础。然而,Postcond究竟是一种“开或关”的现象,还是存在“量效关系”,仍需要进一步深入研究,例如增加或减少缺血/再灌注时间、循环次数研究[9]。
1 Zhao Z-Q,Corvera JS,Halkos ME,et al.Inhibition of myocardial injury by ischemic postconditioning during reperfusion:comparison with ischemic preconditioning.Am J Physiol Heart Circ Physiol,2003,285(2):H579–88.
2 Skyschally A,Caster PV,liodromitis EK,et al.Ischemic postconditioning:experimental models and protocol algorithms.Basic Res Cardiol,2009,104(5):469-483.
3 Pignataro G,Meller R,Inoue K,et al.In vivo and in vitro characterization of a novel neuroprotective strategy for stroke:ischemic postconditioning.J Cereb Blood Flow Metab,2008,28(2):232-241.
4 Xing B,Chen H,Zhang M,et al.Ischemic postconditioning protects brain and reduces inflammation in a rat model of focal cerebral ischemia/reperfusion.Journal of Neurochemistry,2008,105(5):1737-1745.
5 Xing B,Chen H,Zhang M,et al.Ischemic postconditioning inhibits apoptosis after focal cerebral ischemia/reperfusion injury in the rat.Stroke,2008,39(8),2362-2369.
6 Jing-ye Wang,Jia Shen,Qin Gao,et al.Ischemic Postconditioning Protects Against Global Cerebral Ischemia/Reperfusion-Induced Injury in Rats,Stroke,2008,39(3):983-990.
7 Heng Zhao.Ischemic postconditioning as a novel avenue to protect against brain injury after stroke,J Cereb Blood Flow Metab,2009,29(5):873-885.
8 刘守跃.OGD/R 模型诱导SH-SY5Y 细胞凋亡的蛋白组学研究,吉林大学博士学位论文,2008.
9 Zhi-Qing Zhao.Postconditioning in reperfusion injury:A status report.Cardiovasc Drugs Ther,2010,24(3):265-279.

