广西壳菜果遗传多样性的ISSR研究
彭继庆,曹福祥 许若娴
(中南林业科技大学生命科学与技术学院,中国 长沙 410004)
壳菜果(MytilarialaosensisLecomte),别名米老排、三角枫、山桐油、米显灵、马蹄荷、朔潘[1],属金缕梅科(Hamamelidaceae)壳菜果属(Mytilaria)常绿阔叶树种.天然林分布于广东的封开、信阳、阳春,广西西南部的十万大山、龙川、那坡、德保、靖西和云南南部,老挝和越南也有分布,垂直分布在广东海拔250~1 000 m,广西和云南在海拔1 100~1 800 m之间的山谷、丘陵的中下部和沟谷两旁[2],是优良速生用材树种.其树干通直,枝条较细,材质较好,色泽美观,经久耐用,适于制作家具、胶合板等,在水土保持、土壤改良、混交造林、生物防火等方面作用明显[3-4].壳菜果叶子肥大嫩绿,营养成分含量较高,是一种很好的饲料资源[5];所分泌的树脂的化学成分主要是脂类物质[6],其种仁含油质量分数高达36.8%,是重要的油脂资源[7].目前对壳菜果的研究多集中在引种[8]、育苗造林[9]和材质利用等方面[2-3],而壳菜果种群遗传多样性方面的文章迄今未见报道.
ISSR(inter simple sequence repeat)即简单重复序列区间扩增多态性,由Zietkiewiez等[10]在 PCR反应基础上发展起来的一种新的分子生物学技术,ISSR标记技术与RAPD相比具有检测位点多、稳定可靠、重复性更好等优点[11];与AFLP相比具有操作简单、技术性低、花费低等优点,适合一般的实验室使用.因此ISSR分子标记技术已在生物种质鉴定、遗传多样性检测、基因定位及遗传图谱等方面得到广泛应用[12].利用ISSR分子标记技术对壳菜果种群多样性进行研究有助于从DNA分子水平上揭示壳菜果种群的遗传结构和遗传多样性水平,了解壳菜果的生存状况和对环境的适应能力,了解壳菜果种群间的亲缘关系,为壳菜果的合理开发和利用提供参考依据.
1 材料与方法
1.1 样品采集与处理
壳菜果样品分别采自广西凭祥、广西德保、广西靖西、广西那坡4个壳菜果天然分布区,采样过程中要防止采到同一棵树的后代;每一样品为同一株的新鲜叶片,选取没有病虫害的比较干净的叶片,用纱布擦洗干净后放入自封袋中,加入一定量的硅胶,摇动袋子使硅胶与叶子充分接触.将样品放入保温箱中,加入冰袋带回实验室,置于-70℃超低温冰箱中保存备用.样品采集情况见表1.

表1 壳菜果种群分布地的基本情况
1.2 壳菜果基因组DNA提取及检测
壳菜果基因组DNA的提取采用天根生化科技(北京)有限公司的植物基因组提取试剂盒进行提取,具体操作按照植物基因组提取试剂盒说明书进行,仅对离心时间和裂解时间稍作修改.
所提取的基因组 DNA 用10 g/L琼脂糖凝胶电泳检测,倒胶前加入EB,终浓度为0.5 mg/L;用核酸蛋白测定分析仪检测DNA样品纯度和浓度,将所有样品DNA浓度稀释为 40 mg/L,置于-20 ℃冰箱中保存备用.
1.3 引物的合成与筛选
ISSR引物是根据加拿大哥伦比亚大学公布的第九套ISSR引物序列,由南京金斯瑞生物科技有限公司合成.从中筛选出9条扩增条带较多、条带清晰、重复性好的引物用于ISSR-PCR扩增.
1.4 ISSR-PCR扩增与电泳检测
利用筛选出的9条引物对43个样品进行PCR扩增,ISSR-PCR扩增体系为:在20 μL的反应体系中,模板DNA为30 ng,Mg2+浓度为2.75 mmol/L,TaqDNA聚合酶为36.67 nkat,dNTPs浓度为0.20 mmol/L,引物浓度为0.6 μmol/L,10×PCR Buffer 2.0 μL,最后用灭菌好的ddH2O将体系补足.扩增程序为:94 ℃预变性5 min,94 ℃变性30 s,50~54 ℃(依据引物而定)退火45 s,72 ℃延伸90 s,36个循环,72 ℃延伸7 min,4 ℃保存.扩增产物用10 g/L的琼脂糖凝胶电泳检测,用200 bp DNA Ladder Marker(200~3 000 bp)作标记,溴化乙锭染色后在凝胶成像系统上成像,拍照.
1.5 数据处理与分析

M:200 bp DNA Ladder图1 引物UBC835对壳菜果的多态性扩增
电泳图谱中扩增出的每一条带代表引物的一个结合位点,视为有效的分子标记,同一引物的扩增产物中电泳迁移率一致的条带被认为具有同源性.根据电泳图谱中扩增条带的有无及扩增片段的大小,有条带的记作“1”,否则记作“0”,建立0/1数据矩阵,通过Popgene32软件计算壳菜果群落的多态性位点百分比(PPB)、观测等位基因数(Na)、有效等位基因数(Ne)、Nei’s基因多样性指数(H)、Shanon多样性指数(I)、种群总基因多样性(Ht)、种群内基因多样性(Hs)、种群间遗传分化指数(Gst)及Nei’s遗传距离(D).
2 结果与讨论
2.1 广西壳菜果种群的扩增产物多态性
9条引物对4个种群的43份广西壳菜果样品进行扩增,结果显示,9条引物均能扩增出很好的图谱,(图1为引物UBC836对43份广西壳菜果样品进行扩增的图谱)共扩增出129条带,平均每条引物扩增出14.3条带,其中105条带是多态性条带,多态性条带占81.40%,说明43个广西壳菜果样品的ISSR标记存在较高的遗传多样性.引物UBC841扩增出13条带,有12条带是多态性条带,多态性最高为92.30%,引物UBC840扩增的多态性条带最少,多态性也最低,为61.54%(表2).

表2 ISSR引物扩增位点
2.2 广西壳菜果自然种群的遗传多样性分析
4个广西壳菜果自然种群43个样品的遗传多样性分析表明(见表3),壳菜果在物种水平上的多态位点百分率(PPB)为81.40%,表明其拥有较高的遗传多样性.在种群水平上,广西凭祥种群的最高,为69.77%;其次为广西德保和广西靖西的种群,同时为62.79%;广西那坡种群的最低,为54.26%.利用Popgene32软件分析表明4个种群总体水平上的观测等位基因数(Na)为1.845 0;有效等位基因数(Ne)为1.511 9;Nei’s基因多样性指数(H)为0.296 9;Shannon多样性指数(I)为0.440 4.对4个种群而言,Na的变化幅度为1.542 6~1.697 7;Ne的变化幅度为1.355 9~1.471 8;H的变化幅度为0.203 1~0.268 6;I的变化幅度为0.300 4~0.394 5,其变化趋势与种群位点多态性一致.说明广西壳菜果自然种群具有丰富的遗传多样性,在这4个种群中,广西凭祥种群适应环境的能力最强,其次为广西德保种群和广西靖西种群,广西那坡种群最弱.因此,广西凭祥的遗传基础最好,在将来的引种试验中建议从广西凭祥引种是比较合理的.
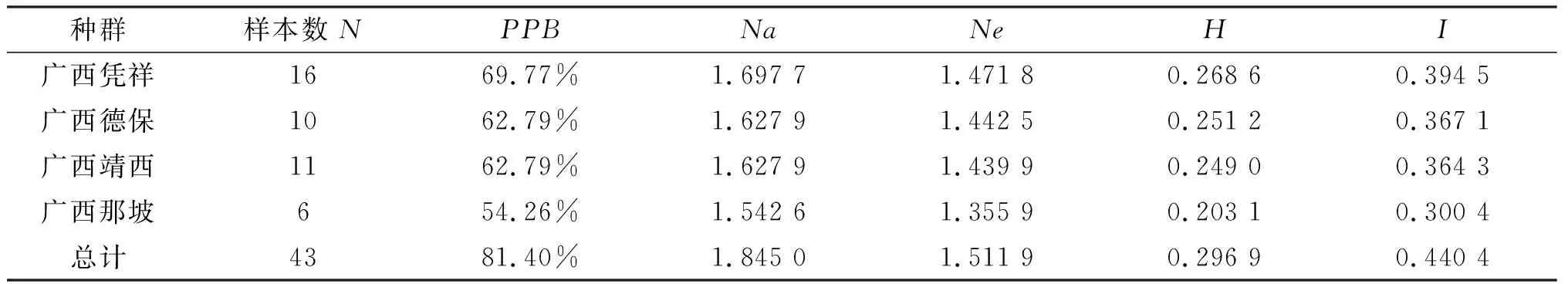
表3 壳菜果种群内的遗传多样性
2.3 广西壳菜果自然群落的遗传分化研究
壳菜果种群总基因多样性(Ht)为0.294 8,种群内的基因多样度(Hs)为0.243 0,种群间基因多样性等于总基因多样性减去种群内的遗传多样性,即种群间的基因多样性为0.051 8;在物种水平上有82.43%的遗传变异存在于种群内,而17.57%的遗传变异存在于种群间.各个种群之间的基因分化系数Gst为0.175 8,说明壳菜果自然种群间存在一定程度的遗传分化,但分化程度比较低.壳菜果种群间的基因流(Nm)为2.344 7,大于1,证明种群间存在一定的基因流动,足以抵制遗传漂变的作用.
2.4 遗传一致度与聚类分析
如表4所示,广西壳菜果4个自然种群之间的Nei’s遗传距离范围在0.055 8~0.138 5之间.广西德保和广西靖西2个种群之间的遗传距离最小,说明它们之间的遗传差异最小;而广西那坡种群与广西凭祥之间的遗传距离最大,为0.138 5,表明广西凭祥与广西那坡之间存在的遗传差异也最大;4个种群的遗传一致度变化范围在0.870 7~0.945 7之间,变化趋势与4个种群之间的遗传距离变化趋势一致.
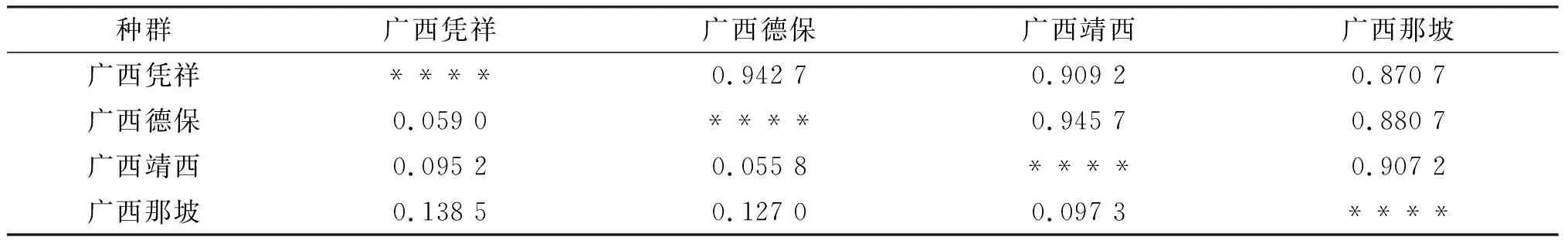
表4 4个壳菜果种群间的遗传一致度和遗传距离
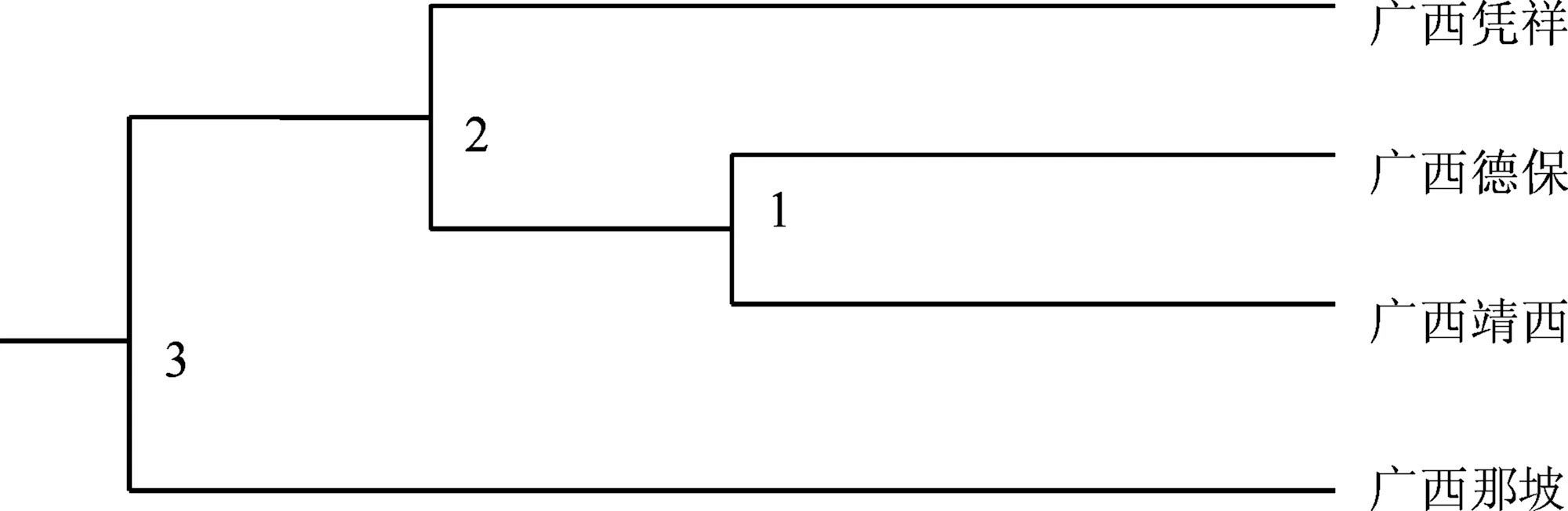
图2 4个壳菜果种群间遗传距离的聚类分析
根据Nei’s(1978)的遗传距离对广西壳菜果种群进行UPGMA聚类分析(见图2),聚类结果表明:4个广西壳菜果自然种群聚为两大类,一类是广西德保和广西靖西的2个种群聚在一起,再与广西凭祥的聚在一起;广西那坡种群单独聚为一类.表明广西德保与广西靖西2个自然种群之间的亲缘关系最近,与广西那坡之间的亲缘关系最远.
3 讨论
遗传多样性是生物多样性的基本特性,是物种长期进化的结果,遗传多样性的高低对种群的生存和分布有很大影响[13].通过ISSR分子标记技术对壳菜果遗传多样性进行分析,多态位点百分率为81.40%,比广布型植物略低,如木荷的多态位点百分率为90.02%[14],油松的多态位点百分率为91.67%[15],枫香的多态位点百分率为87.41%[16],比频危植物要高,如资源冷杉的多态位点百分率为77.78%[17].表明尽管壳菜果的多态位点百分率比广布型植物要低,但壳菜果仍处于较高水平,仍有很强的适应能力.广西壳菜果的多态位点百分率介于广布型植物和频危植物之间,可能与两方面原因有关:一是与广西壳菜果自然群落的分布状况有关,目前广西壳菜果除了在广西凭祥有大面积的天然林外,在广西其他地方很少有成片的天然林,且多集中在一些林场或者在一些自然保护区,地理距离比较远,因此壳菜果的多态位点百分率比广布型的要低;另一方面是壳菜果结实量大,种子的含油量高达36.8%[7],种子的萌发能力比较强,发芽率在90%左右,易于植株的存活,这与Hamrick[18]提出的具有高水平遗传变异的物种寿命长、结实性高的观点一致.
广西壳菜果自然群落的遗传分化程度比较低,种群内的遗传变异占主导地位,种群间遗传变异小,这是由基因流和微环境共同作用的.基因流被视为是使种群遗传结构均质化的主要因素之一, 具有广泛基因流的物种遗传分化程度也比较小[19].壳菜果种群间的基因流(Nm)为2.344 7,说明基因流发挥了均质化作用.种群间微生境的差异也是产生种群间遗传分化的原因之一,不同的微生境条件下存在不同的适应型,种群的基因型之间必存在相应的差异,从而产生种群间的遗传分化[20].本研究中的壳菜果样品均来自广西,温度、水分、光照、土壤等生态因子变化较小, 微生境差异不大,不同种群所承受的生境选择压力差异比较小.但是目前很多广西壳菜果天然种群都被分割开来,种群之间相距比较远,产生了生境片段化,而生境片段化可以阻断原种群之间的基因交流[21],降低遗传多样性,加大遗传分化程度,估计随着时间的推移,各种群之间的遗传分化将逐渐增大.
本文从分子水平对壳菜果遗传多样性的研究,有助于了解其遗传基础,为种群保护、引种栽培和生产实践提供参考依据;UPGMA聚类分析结果有助于探清壳菜果种群间的演化规律.但目前仅仅对广西壳菜果天然种群进行了研究,其他省份的壳菜果的生长状况和亲缘关系还不清楚.下一步将在全国范围内对壳菜果进行研究,除探清壳菜果天然种群间的亲缘关系外,还要探清天然林与引种地之间的差异,从分子水平上了解壳菜果是怎样对迁移地进行适应的,对引种是否成功从分子水平上作出评价.
参考文献:
[1] 中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1979:50-52.
[2] 梁善庆,罗建举.人工林米老排木材化学成分及其在树干高度上的变异[J].中南林学院学报,2004,24(5):28-31,52.
[3] 梁善庆,罗建举.人工林米老排木材的物理力学性质[J].中南林业科技大学学报, 2007, 27(5): 97-100,116.
[4] 郑万钧.中国树木志(第二册)[M].北京:中国林业出版社,1985.
[5] 景跃波,杨德军,马赛宇,等.热带速生树种米老排的育苗与造林[J].林业实用技术,2008(1):21-23.
[6] 黄秦康.常用中药成分与药理手册[M].北京:中国医学科技出版社,1994:18.
[7] 中国油脂植物编写委员会.中国油脂植物[M].北京:科学出版社,1987:346-347.
[8] 李良昌,廖翠兰,黄德林,等.米老排在乐昌林场的引种及生长表现[J].广东林业科技,2003,19(4):66-68.
[9] 唐社云.米老排与南酸枣混交造林试验报告[J].西部林业科学,1992(2):35-40.
[10] ZIETKIEWIEZ E, RAFALSKI A, LABUDA D. Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification [J]. Genomics, 1994, 20: 176-183.
[11] GILBERT J E, LEWIS R V, WILKINSONM J,etal. Developing an appropriate strategy to assess genetic variability in plant germ plasm collections[J]. Theor Appl Genet, 1999,6(98):1125-1131.
[12] 魏小玲,曹福祥,陈 建.海南木莲基因组DNA提取及ISSR反应体系的优化[J].中南林业科技大学学报,2010,30(5):91-96.
[13] 钱迎倩,马克平. 生物多样性研究的原理和方法[M]. 北京: 中国科学技术出版社, 1994: 123-140.
[14] 金则新, 李钧敏, 李建辉. 木荷种群遗传多样性的ISSR分析[J]. 浙江大学学报:农业与生命科学版, 2007, 33(3): 271-276.
[15] 李 毳, 柴宝峰, 王孟本. 华北地区油松种群遗传多样性分析[J]. 植物研究, 2006, 26(1): 98-102.
[16] 毕泉鑫,金则新,李钧敏,等. 枫香自然种群遗传多样性的ISSR分析[J].植物研究,2010,30(1):120-125.
[17] 张玉荣,罗菊春,喻锦秀. 资源冷杉遗传多样性的ISSR分析[J]. 北京林业大学学报, 2007,29(6):41-46.
[18] HAMRICK J L, MITTON J B, LINHART Y B. Leves of genetic variation in trees: The influence of life history characteristics[C]//PACIFIC S W. Proc Symp on Isozymes of North American Forest Trees and Forest Insects. For Range Expt Stat Tech Report PSW-48,1981: 35-41.
[19] HAMRICK J L, LINHART Y B, MITTON J B. Relationships between life history characteristics and electropho retically detectable genetic variation in plants[J]. Annu Rev Ecol Syst,1979, 10:173-200.
[20] 陈小勇, 宋永昌. 安徽黄山西部青冈种群小地理范围的遗传分化[J]. 植物资源与环境学报, 1998, 7(1): 10-14.
[21] 陈小勇. 生境片断化对植物种群遗传结构的影响及植物遗传多样性保护[J]. 生态学报,2000,20(5):884-892.

