补肾填精法对骨折后不同时相骨髓间充质干细胞增殖影响的实验研究
王 斌 罗毅文 胡年宏
(广州中医药大学附属骨伤科医院,广东 广州 510240)
骨修复过程类似于胚胎期的骨形成,存在两种骨化形式,软骨内成骨和膜内成骨,均需要骨折局部聚集数量足够的骨髓间充质干细胞(marrow mesenchymal stem cells,MSCs)[1]。我们以往的实验及临床研究发现中药骨康方具有补肾壮骨、填精养髓、健脾益气的作用,骨康含药血清能促进体外分离骨髓源性骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)增殖和成骨分化[2-3],对骨质疏松性骨折有良好的治疗作用[4]。为进一步证实骨康方具有修复骨损伤的效应,本实验观察骨康方对大白兔骨折后不同时相BMSCs增殖能力的影响,为中医药促进骨折早期愈合及与时间相关性机制提供理论和实验依据。
1 材料与方法
1.1 实验动物及分组 4周龄新西兰白兔20只,清洁级,雌雄不限,体重0.8~1.0kg,由广州中医药大学动物实验中心提供。20只白兔按随机数字表法分成4组,即正常对照组、骨折模型组、中药治疗组、西药治疗组,每组5只。4组标记后分笼喂养,均予以普通饲料及洁净自来水饲养,温度维持在24℃左右。
1.2 桡骨骨折模型制作 正常对照组不作骨折处理。骨折模型组进行右侧桡骨旋转扭转性骨折损伤处理,具体操作方式见文献[5]。中药治疗组作上述骨折损伤处理后灌胃中药骨康方。西药治疗组作上述骨折损伤处理后灌胃钙尔奇D。对动物采用针筒灌药,正常对照组和骨折模型组灌胃等量生理盐水。每日给药1次,连续给药21d。
1.3 主要试剂 IMDM干粉、胎牛血清、0.25%胰酶、青霉素和链霉素(美国Gibcol公司),PBS缓冲液粉剂(武汉博士德公司),Percoll梯度分离液(美国Pharmacia公司),噻唑蓝MTT(上海申能博采生物科技有限公司),二甲基亚砜(DMSO广州威佳科技公司)。
1.4 药物制备及给药量
1.4.1 补肾填精法方药(骨康方) 骨康方由补骨脂、制淫羊藿、肉苁蓉、熟地黄、白芍、黄芪、菟丝子、丹参、当归、大枣组成。将中药制成粗粉,首煎将中药粗粉置8倍温水中浸泡0.5h,沸腾后文火煎煮4h,注意均匀搅拌,取汁后经3层纱布过滤;第2次和第3次煎煮均分别以6倍水文火煎煮2h,取汁,合并3次药液,置水浴箱内浓缩至每毫升含生药量1.43g(此药物浓度是按人日用剂量,经人-兔体表面积比值折算成相当于人临床剂量,浓缩8倍而成。由广州中医药大学附属骨伤科医院制剂室提供,批号:960211)。药液常温冷却后,置4℃冰箱内保存备用。根据临床用药剂量及新药研究中动物用药剂量要求,生药按剂量9.6g/kg(根据以往实验高剂量组增殖、诱导效果最佳[2-3])配制,相当于临床剂量的20倍,药物以蒸馏水定容至所需浓度。
1.4.2 西药 钙尔奇D(由Wyeth惠氏制药有限公司提供,批号0501125,每片600mg),根据“人和动物体表面积折算比率表”进行计算,兔的剂量约为28mg/kg。将钙尔奇D以蒸馏水定容至所需浓度。
1.5 BMSCs的分离 将4组白兔分别给予3g/L苯巴比妥腹腔注射麻醉,术区剃毛、消毒,铺洞巾,用骨髓穿刺针在T0(创前)、T7(创后第 7 天)、T14(创后第 14 天)、T21(创后第 21 天)分别无菌抽取右侧桡骨骨折部位的骨髓液,缓慢注入含4mL淋巴细胞分层液试管内,2000r/min离心 25min,吸取中间单个核细胞层,用pH值为7.2的 Hank’s液洗 2次。
1.6 BMSCs流式细胞仪检测 取洗涤后的分离液离心后去上清液,加入1mL磷酸盐缓冲液稀释,计算浓度。取含1×106个细胞的液体,离心去上清加100μL磷酸盐缓冲液重悬,再分别加入荧光抗体CD44-FITC及CD45-RPE 各 10μL,避光孵育 30min,加磷酸盐缓冲液洗涤2次,去上清加500μL 1%多聚甲醛重悬固定,冰盒保存,送流式细胞实验室检测。含CD44-FITC阳性而CD45-PE阴性的细胞定为BMSCs,由此测得的该细胞数值即为BMSCs构成比(BMSCs占总细胞数的构成比),通过多个构成比求其平均值。
1.7 BMSCs的培养 用含体积分数为10%小牛血清的DMEM作为培养液(含青霉素100U/mL、链霉素100g/mL、两性霉素 B 0.25g/mL),将细胞密度调至 2×109/L,接种于培养瓶中,置于37℃恒温,含体积分数为5%CO2的饱和湿度培养箱中培养。第3天换液1次,弃除未贴壁细胞,以后隔天换液,待融合成单层细胞后,传代培养。
1.8 形态学观察 通过倒置相差显微镜连续观察BMSCs的生长情况,观察细胞在不同时间段的形态学变化。观察样本量为6孔。
1.9 四甲基偶氮唑盐检测(MTT法) 取生长良好的P3代细胞消化后制成细胞悬液,计数后将BMSCs以2×104细胞/孔的密度接种于6孔培养板中(孔内各置一无菌盖玻片),每孔加入1g/L四甲基偶氮唑盐溶液,0.5mL/孔。细胞继续于37℃避光孵育4h,弃去培养液,每孔加入150μL二甲基亚砜,振荡培养板直至紫色结晶完全溶解。于48h时进行MTT检测,用酶标仪测定490nm波长的吸光度(A)值。
2 结果
2.1 骨康方对兔骨折端BMSCs构成比的影响 除T0外,与正常对照组比较,同一时相其他各组兔骨折端BMSCs构成比显著升高(P<0.05,P<0.01)。中药治疗组不同时相(T7、T21)BMSCs 构成比显著高于其他 3 组(P<0.01)。见表1。
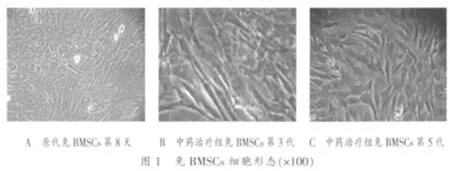
2.2 各组兔骨折端BMSCs形态学观察 原代及传代培养:原代培养细胞48h首次换液,BMSCs呈短梭形贴壁生长,并逐渐呈现集落生长,12~14d达到融合生长,融合成片的细胞排列有一定的方向性,呈漩涡状排列,细胞呈梭形或椭圆形等,见图1-A。传代细胞2~4h迅速贴壁,伸展,细胞呈均匀生长,细胞形态更加单一,5~6h铺满瓶底。倒置相差显微镜下,刚接种的骨髓中体积较大的单个核细胞呈球形,悬浮于培养液中。8~10h开始逐渐沉降贴壁,48h少数贴壁细胞呈成纤维细胞样外形,以后细胞呈克隆均匀分布生长,形态均一,呈长梭形,见图1-B。生长期细胞分裂相多见,细胞突起互相连接,增殖速度快,两三天即可传代,见图1-C。
表1 各组兔不同时相骨折端BMSCs构成比()
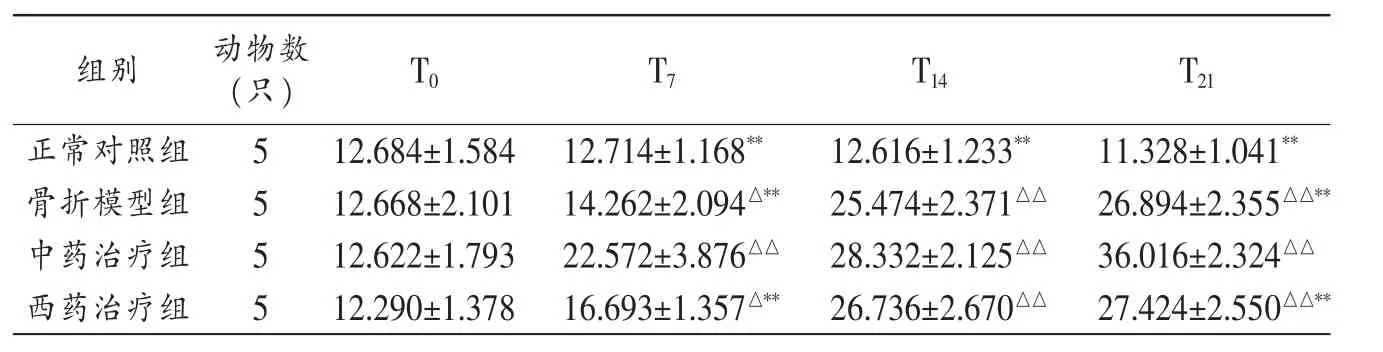
表1 各组兔不同时相骨折端BMSCs构成比()
注:与同时相正常对照组比较,△P<0.05,△△P<0.01;与同时相中药治疗组比较,**P<0.01。
组别 动物数(只)T21 T0正常对照组5 T7 T14 12.684±1.58412.714±1.168** 12.616±1.233**11.328±1.041**骨折模型组 12.668±2.101 14.262±2.094△** 25.474±2.371△△ 26.894±2.355△△**5中药治疗组 5 12.622±1.793 22.572±3.876△△ 28.332±2.125△△ 36.016±2.324△△西药治疗组 5 12.290±1.378 16.693±1.357△** 26.736±2.670△△ 27.424±2.550△△**
2.3 骨康方对兔骨折端BMSCs增殖能力的影响 中药治疗组不同时相BMSCs增殖能力均显著高于其他3组(P<0.01)。见表2。
表2 各组兔不同时相骨折端BMSCs增殖OD值()
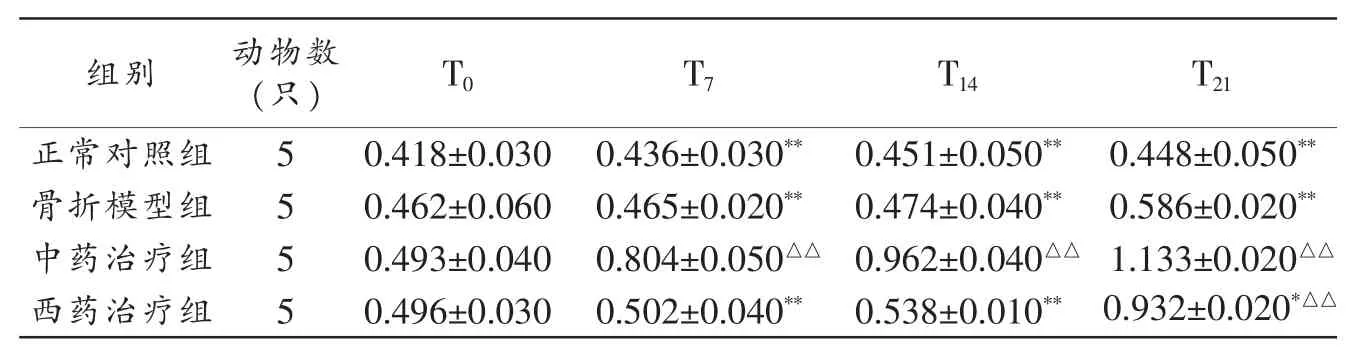
表2 各组兔不同时相骨折端BMSCs增殖OD值()
注:与正常对照组同时相比较,△△P<0.01;与同时相中药治疗组比较,*P<0.05,**P<0.01。
组别 动物数(只)T21 T0正常对照组5 T7 T14 0.418±0.0300.436±0.030** 0.451±0.050**0.448±0.050**骨折模型组 0.462±0.060 0.465±0.020** 0.474±0.040** 0.586±0.020**5中药治疗组 5 0.493±0.040 0.804±0.050△△ 0.962±0.040△△ 1.133±0.020△△西药治疗组 5 0.496±0.030 0.502±0.040** 0.538±0.010** 0.932±0.020*△△
3 讨论
骨折的愈合实质上是骨损伤后的再生过程,也是骨组织的形成过程。现多认为,在骨折愈合中直接参与骨折修复的细胞主要是BMSCs,这种未分化细胞具有增殖和自我更新的能力,并且有向骨、脂肪、软骨组织分化的潜能,因此BMSCs的增殖对骨折愈合具有促进作用[6]。BMSCs的增殖和向成骨细胞方向分化不仅有利于骨折的愈合,更有利于进行BMSCs的自体移植,无免疫原性且不牵涉到伦理问题,如果利用这一特性对其进行强化干预则有利于增进骨折的愈合速度,尤其有利于骨折后出现的骨缺损、骨不连及骨折制动后出现的骨质疏松等难治性骨科疾病的治疗。
中医理论认为,肾藏精,生髓主骨,肾中精气的盛衰能够决定骨骼的强弱,影响骨的代谢。补肾中药对BMSCs的体外培养及分化已有相当的研究[7],但如何提高骨折后不同时相体内BMSCs的增殖和促进骨化尚未见报道。本课题前期实验研究表明骨康含药血清对BMSCs增殖和成骨分化作用大都基于体外的细胞培养[2-3],组织细胞的生存环境在很大程度上有异于体内,因此运用整体动物口服补肾填精中药骨康后对BMSCs增殖的影响,更接近于临床试验。本实验研究结果发现:白兔在右侧桡骨旋转扭转性骨折损伤后1周内出现BMSCs构成比增加,并持续至第3周;而没有骨折损伤刺激的白兔BMSCs处于比较低水平的构成比状态,两者比较有显著性差异(P<0.05或P<0.01)。因此,骨损伤刺激可诱导活体内骨髓间充质干细胞的增殖,这与谢明等[8]研究结果一致。兔骨折端BMSCs构成比在不同处理方法下不同处理时相变化的趋势不同,其中中药治疗组不同时相(T7、T21)BMSCs构成比显著高于其他 3 组(P<0.01)。因此,运用中药骨康干预骨折损伤白兔有利于增加BMSCs构成比,尤其是对骨折损伤后第3周仍有较强的促进BMSCs增殖作用。
中药对骨折愈合具有明显促进作用,特别对于骨延迟愈合和不愈合具有较高的治愈率[9-10]。目前研究大多集中在中药作用于骨折局部的宏观水平,而对其促进骨折愈合的细胞学及分子学机制研究较少。众所周知,骨折愈合是一个复杂而有序的病理过程,涉及一系列细胞的募集、增殖及分化。因此BMSCs的增殖对骨折愈合具有促进作用。细胞增殖在时间上以48h最理想,本实验运用MTT法检测各组骨折后BMSCs培养48h时的增殖效应,发现骨折模型兔骨折端BMSCs增殖能力在不同处理方法下不同处理时相变化的趋势不同,其中中药治疗组不同时相BMSCs增殖能力显著高于其他 3组(P<0.05,P<0.01),并随着治疗时间的推移呈现逐渐增加的趋势,这表明中药骨康具有促进BMSCs增殖的能力,且发挥增殖作用有一定的时效关系。
综上所述,中药骨康方有利于骨折后白兔体内BMSCs构成比增加,对BMSCs增殖有明显的促进作用。由此,我们可以推测,骨康方可以通过在增殖高峰时刻刺激体内BMSCs增殖,不断增加BMSCs数量,从而增加软骨细胞、成骨细胞转化数量[11],促进骨折愈合康复的速度,缩短康复时间,其机理还有待进一步研究探讨。
[1]Sundeep Khosla,Jennifer J,Westendorf,et al.Concise Review:Insights from Normal Bone Remodeling and Stem Cell-Based Therapies for Bone Repair.Stem Cells,2010,28(12):2124
[2]王斌,罗毅文,胡年宏.骨康方对大鼠MSCs体外向成骨细胞分化和 ALP 的影响.中国中医骨伤科杂志,2007,15(12):5
[3]王斌,罗毅文,胡年宏.骨康方含药血清诱导大鼠骨髓基质细胞向成骨细胞方向分化的实验研究.中国中医骨伤科杂志,2007,l5(11):32
[4]庄洪.骨康对骨质疏松性骨折愈合过程Ⅰ、Ⅱ型胶原及CTGF表达的影响.中国优秀博硕士学位论文全文数据库(博士),2005
[5]Farso Nielsen F,Karring T,Gogolewski S.Biodegradable guide for bone regeneration.Polyurethane membranes tested in rabbit radius defects.Acta Orthop Scand,1992,63(1):66
[6]Xuesong Han,Liu Liu,Fuke Wang,et al.Reconstruction of tissue-engineered bone with bone marrow mesenchymal stem cells and partially deproteinised bone in Vitro.Cell Biology International,20 Aug 2012 as manuscript CBI,2011:1
[7]范海蛟.补肾中药对大鼠骨髓基质干细胞增殖和分化的影响.广州中医药大学,2008
[8]谢明,封卫兵,刘艳萍,等.骨折后骨髓间充质干细胞的增殖变化.中国临床康复,2008,10(29):56
[9]王书湘.中医辨证结合手术治疗骨不连46例.河南中医,2011,31(8):903
[10]康金平.中医药治疗骨折研究进展.中医药临床杂志,2012,24(5):476
[11] 徐无忌.骨康对不同诱导条件下MSCs分化影响及BMP-2对成骨分化的作用.广州中医药大学,2008

