酸乳体系中乳酸菌胞外多糖与蛋白相互作用研究进展
曾令鹤 钱 方 姜淑娟 牟光庆
ZENG Lin-he QIAN Fang JIANG Shu-juanMU Guang-qing
(大连工业大学食品学院,辽宁 大连 116034)
(School of Food Science and Technology,Dalian Polytechnic University,Dalian,Liaoning 116034,China)
酸乳制品在生产过程中易出现组织结构松散、凝胶性差、乳清析出等问题已成为近年研究重点。酸乳的组织结构主要是蛋白在酸性条件下发生凝集形成空间网状结构所致。乳酸菌胞外多糖(exopolysaccharides,EPS)作为乳酸菌生长代谢过程中自身不断产生并分泌到细胞壁外的糖类化合物[1],主要通过与蛋白发生作用,影响蛋白网状结构的构建,从而在较低浓度下对酸乳的黏度、粘弹性、持水力、质构、风味等产生显著影响[2],改善酸乳品质[3]。
1 多糖与蛋白相互作用研究
多糖和蛋白之间发生的相互作用主要有非共价作用和共价作用两种[5]。非共价作用主要有强的静电作用和弱的相互作用(氢键、范德华力、疏水相互作用等)。强的静电作用主要由带电多糖与蛋白形成;中性多糖和蛋白之间不发生相互作用或者发生弱的相互作用[6]。共价作用主要通过Maillard反应产生[7,8]。两者的相互作用会改善蛋白质的溶解性、热稳定性、起泡性以及乳化性等[9]。
目前对多糖和蛋白的作用研究主要集中在两元体系,研究发现多糖会通过吸附多个蛋白使得蛋白间发生聚合甚至沉淀。Jiulin X等[10]利用电泳光散射和准弹性光散射法发现在稀溶液中蛋白和多糖最初的相互作用发生在分子水平,且多个蛋白与单个多糖链相连。随着pH降低,这些大分子进一步聚合,絮凝。Doublier等[11]也发现多糖分子通过吸附多个蛋白胶粒连成桥或者聚合与蛋白发生相互作用。单个多糖分子会吸附至多个蛋白质表面,将蛋白胶粒桥连起来。
体系环境(pH、温度、离子强度等)、多糖的添加量以及两种物质的结构(分子大小、带电量以及电荷分布情况等)都会影响蛋白和多糖之间的作用。Maude等[12]采用电势滴定法和离心法研究了几种阴离子胞外多糖和蛋白的相互作用,发现带电荷的胞外多糖主要通过离子作用和蛋白反应,限制蛋白的聚合沉淀,且所带电荷越多,与蛋白的作用越强。
2 酸乳体系中乳酸菌胞外多糖和蛋白相互作用研究
胞外多糖作为多糖的一种,可通过乳酸菌发酵直接产生,无需人为添加,因而在酸奶中作为良好的稳定剂及增稠剂应用广泛。胞外多糖在酸乳中的含量较低(50~2 700mg/L),对酸乳质构的影响主要是通过与乳中蛋白发生相互作用所致。要研究酸乳体系中两者的相互作用,首先要了解牛奶蛋白稳定体系的构成,酸奶发酵过程中蛋白的失稳,进而研究胞外多糖产生后与蛋白作用对蛋白簇乃至酸乳结构的影响。
2.1 牛乳中蛋白的稳定体系
牛乳中的蛋白主要有酪蛋白、乳清蛋白两种。其中酪蛋白的比重较大,约占总蛋白的80%,由α-酪蛋白、β-酪蛋白和κ-酪蛋白组成。作为牛乳中的主要成分,酪蛋白的稳定决定了牛乳的稳定。在牛乳中,酪蛋白以稳定的胶粒形式存在[13]。目前普遍认为酪蛋白胶粒是由亚胶束通过内部氢键及疏水相互作用与少量的胶态磷酸钙相连而成,如图1所示。亚胶束分为两种:一种疏水性较强,主要由α-酪蛋白及β-酪蛋白构成,一般在形成的胶粒内部;另一种亲水性较强,主要由α-酪蛋白及κ-酪蛋白构成,一般在形成的胶粒外部[14]。
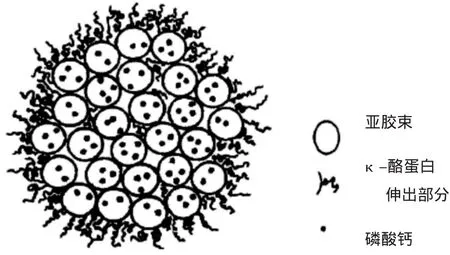
图1 酪蛋白亚胶束模型Figure 1 Caseinmicellemodel
酪蛋白胶粒之所以能以稳定的形式存在于牛乳中,是因为胶粒之间发生了空间位垒以及静电排斥两种作用。酪蛋白的等电点大概在4.6左右,在牛乳(pH 6.5~6.7)中带负电,胶粒间发生静电排斥作用,一定程度上保证了酪蛋白的稳定。胶粒表面是κ-酪蛋白,其碳端发生亲水作用,在胶粒表面形成高密度的水化层,即κ-酪蛋白的“毛发层”,当胶粒互相之间发生碰撞时,毛发层因为疏水相互作用互相排斥,产生空间位垒效应,防止胶粒之间接近,造成胶粒无法凝集,最终乳体系保持稳定[15]。
牛乳中乳清蛋白含量较小,约占总蛋白量的20%,主要由α-乳白蛋白、β-乳球蛋白、血清白蛋白、免疫球蛋白、乳铁蛋白等构成[16]。乳清蛋白主要以乳清蛋白聚合物及乳清蛋白—酪蛋白聚合物的形式稳定存在于牛乳中[17]。
体系中pH、温度、盐离子浓度等都会对蛋白在牛乳中的稳定存在产生较大的影响[18]。牛乳进行加热处理(不超过100℃)时,不影响酪蛋白的化学性质,但维持其胶粒的次级键发生改变,疏水键暴露,对牛乳的稳定体系产生一定影响。乳清蛋白因含有大量的二硫键和巯基故对热比较敏感,加热过程中β-乳球蛋白的三级结构会解体,多肽链打开,疏水基团暴露,分子间二硫键发生互换,形成聚集体。继续加热,α-乳白蛋白发生变性,与β-乳球蛋白聚集体继续缔合,形成更大凝集体。随着加热的进行,变性的乳清蛋白进一步和酪蛋白胶粒表面的κ-酪蛋白缔合,形成酪蛋白胶粒—变性乳清蛋白复合物。
2.2 酸乳中蛋白的失稳
酸乳的发酵过程中,pH从6.7降至5.8左右时,胶粒容积度降低,失去矿物质,大部分胶态磷酸钙溶解[15],pH继续下降,达到酪蛋白的等电点时,胶粒表面的κ-酪蛋白坍塌,电解质层裂解,胶粒缩小,ξ-电位降低[19]。胶粒表面电荷由负电变为正电,静电排斥作用减弱,同时胶粒的缩小使得空间位阻减弱,蛋白发生聚集沉淀[20]。
2.3 酸乳体系中两者作用时间及方式研究
酸乳体系中,胞外多糖和蛋白发生非共价作用,主要通过静电作用或空间位垒作用影响酸乳的质构[21]。静电作用主要由带电胞外多糖和蛋白产生,两者的相互作用会改变酸奶中钙离子平衡,阻止胶粒表面κ-酪蛋白的坍塌,促使网状结构重组。空间位垒主要由中性胞外多糖自身产生,它会影响酪蛋白簇、酪蛋白—乳清蛋白聚合体的动态变化,打破蛋白凝胶体系中处于连续相的蛋白质胶粒,进而改变酸乳的凝胶结构[22]。关于酸乳中哪种作用占主导,目前尚无定论,一般认为空间位垒起主要作用。
关于两者发生作用的时间,早先有学者[23,24]发现胞外多糖产生后即开始与蛋白发生作用,发生热力学不相容现象,混合体系稳定性降低。但新近研究[25]表明,胞外多糖的存在对发酵过程中的酪蛋白胶粒聚合前和聚合中都无影响,在之后的凝胶化过程中才开始起作用。Eleana等[25]利用扩散波光谱技术研究发酵早期蛋白的凝集以及空间网状结构的形成,结合流变学和微观结构观察研究从蛋白开始失稳到形成网状结构过程的动力学。研究发现胞外多糖存在与否对酸乳中酪蛋白胶粒的扩散系数和表观半径(5.21±0.07,5.23±0.11)无明显影响,说明L.lactis subsp.Cremoris JFR1产生的胞外多糖对酪蛋白胶粒聚合早期无明显作用。发酵后期,通过比较储能模量(G'值),pH 4.6时tanδ值(介损)说明胞外多糖在凝胶化中后期开始起作用。可能是因为乳酸菌胞外多糖一般在菌株对数生长的末期和稳定期产生[26],此时蛋白之间已经发生聚合,故胞外多糖对酪蛋白胶粒的早期聚合不能起作用。
关于两者作用后的结合方式,学者普遍认为多糖是镶嵌在蛋白簇中心或网状结构的空隙部分,形成富含多糖的区域[27]。Hassan等[24]用共聚焦激光扫描显微镜观察酸乳凝胶的显微结构,发现酸乳的凝胶网状结构中大的空隙被菌体填充,菌体周围是多糖围绕。Ayala-Hernandez等[28]利用扫描电子显微镜发现酸乳体系中胞外多糖并不是简单地覆盖在蛋白簇的表面或者空隙部分,而是呈链状将蛋白簇和菌体连接起来。这可能是因为胞外多糖产生在蛋白胶粒聚合之后,被限制在网状结构的空隙内。这种空间限制阻碍了胞外多糖和蛋白之间的作用。此时蛋白聚合物之间以及胞外多糖所在的空隙部分都处在不断的动态变化中,这种动态环境使得蛋白簇更厚,网状结构的重组更快也更致密[25]。
2.4 影响因素
2.4.1 胞外多糖的性质及添加方式对两者作用的影响 发酵过程中胞外多糖带电情况、分子量[29]、添加方式等的都不同会对两者作用产生影响。
中性胞外多糖多因为与蛋白聚合物的不相容性导致其通过空间位阻破坏蛋白的交联,影响空间网状结构的构建。李全阳等[30]用电子显微镜观察不同酸乳凝胶的微观结构,发现同样的结果。酸性胞外多糖则可能因为带负电,硫酸基团,或者高分子量导致与蛋白之间发生强的静电作用,强化酪蛋白之间的交联作用,使得胞外多糖与蛋白桥连后嵌入到网状结构中,减少凝胶时间,增加凝胶强度。Maude等[31]将带负电的胞外多糖添加至牛乳中,研究其对酸乳(通过添加葡萄糖酸内酯来对牛乳进行调酸得到)凝胶情况以及剪切处理后凝胶结构恢复的影响。研究发现pH近中性时,未吸附的胞外多糖分子会产生空间位垒,使得酪蛋白胶粒互相靠近,发生进一步的凝集,形成凝胶。pH继续降低,带电胞外多糖和蛋白因为带电不同相互吸引,进一步影响酸奶质构。与一般酸乳相比,带电多糖添加后的酸乳凝胶更易碎,剪切处理后凝胶的恢复能力也更差。
分子量不同的胞外多糖对两者作用的影响主要因空间位垒不同实现。当胞外多糖分子较小(与酪蛋白胶粒大小相近或更小)时,形成的空间位垒较小,此时即使浓度较大,对酪蛋白凝集形成网状结构的影响仍很小,所形成的酪蛋白簇较粗,网状结构中网孔较大,酸乳的硬度也较大。相反,当胞外多糖分子较大时,其空间位阻效应明显,使得蛋白簇较细,网状结构中网孔较多、较小,酸乳的黏度较大[30]。
内源产生和外源添加胞外多糖也会因空间位垒产生方式的不同对酸乳质构产生影响。杨同香等[32]研究内、外源胞外多糖的存在对酸乳流变学特性的影响发现,内源产生胞外多糖的酸乳与外源添加胞外多糖的酸乳相比,其表观黏度更高,剪切应力的变化更大,酸乳粘弹性更好。其胶体脱水收缩作用敏感性(STS值)小,持水力(WHC值)大,即乳清析出少,稳定性好。这是因为乳酸菌发酵过程中胞外多糖的不断产生,空间位垒效应从无到有,从小到大,形成的网状结构就会细密、连续。而外源添加胞外多糖后再发酵,胞外多糖在发酵前自身已形成空间网络,对酪蛋白的凝集产生很强的排斥作用,使得酪蛋白只能形成不连续的空间网状结构,最终酸乳的黏度较低。
2.4.2 蛋白的构成及浓度对两者作用的影响 蛋白结构、浓度大小、种类、比例不同等会对蛋白和胞外多糖的作用产生影响,进而影响酸乳质构。
酪蛋白胶粒的表面不平滑以及空隙的存在,会为胞外多糖等分子的加入提供位置,外层的κ-酪蛋白存在电解质层,将决定吸引或是排斥附近的胞外多糖[33]。
发酵前牛乳中蛋白的含量越高,胞外多糖的产量也越高,酸乳的黏度也越高。Ayala-Hernandez等[34]研究了蛋白含量对乳酸乳球菌产胞外多糖与蛋白之间相互作用以及对酸乳流变学特性的影响,发现酸乳的黏度随酸乳中乳清蛋白含量的增加而增高,其黏度的增高很可能是胞外多糖与蛋白之间的相互作用所致。
改变牛乳中乳清蛋白和酪蛋白的比例会因发酵过程中两者与胞外多糖作用的不同对酸乳的质构产生大的影响。Maude等[12]用电势滴定法研究了几种阴离子胞外多糖和蛋白相互作用的初始pH,发现中性胞外多糖和乳清蛋白、酪蛋白发生作用的初始pH分别在6.1,5.4左右。由此推断:改变乳中乳清蛋白和酪蛋白比例,会影响酸乳发酵过程凝胶网状结构的形成情况,影响酸乳的最终质构。
2.5 两者作用对酸乳品质的影响
酸乳中存在胞外多糖时,胞外多糖会与蛋白发生作用,影响蛋白簇的聚合情况,进而影响酸乳网状结构的构建,最终影响酸乳的品质。有胞外多糖存在的酸乳与不产胞外多糖的酸乳相比,剪切应力和滞后回线面积更大,黏度、持水力、凝胶强度也较强[35,36]。对酸乳微观结构观察[37]发现:胞外多糖存在时,酸乳网状结构中孔较大、蛋白簇较厚、凝胶较密;而不产胞外多糖的酸乳结构中孔较小且单一,蛋白簇较薄。Prasannaa等[38]发现产胞外多糖的酸乳脱水缩合作用较弱,但硬度及储能模量较高,酸乳形成了良好的多孔状网状结构。
3 结论及展望
①胞外多糖在乳酸菌进入对数后期及稳定期后产生,在酸乳凝胶化后开始与蛋白发生作用;②胞外多糖和蛋白之间的作用主要有空间位垒和静电作用两种;③胞外多糖的性质及添加方式、蛋白的构成及浓度等都会对两者的作用产生影响;④两者相互作用会对酸乳的质构、黏度、粘弹性、持水力、风味等产生较大影响。
之前的研究多集中在孤立的多糖—蛋白二元体系中两者的相互作用[39]。近年来开始有利用流变学技术、光学分析、光散射技术、显微技术等方法分析乳加工过程中蛋白和胞外多糖的相互作用[40]。目前关于酸乳发酵过程中两者分子水平上的作用机制仍不明了,如何应用于乳品生产还有待进一步的研究。
1 Mozzi F,Gerbino E,Torino M I,et al.Functionality of exopolysaccharides produced by lactic acid bacteria in an invitro gastric system[J].Journal of Applied Microbiology,2009,107(1):56~64.
2 李清春,张景强,贺稚非.乳酸菌胞外多糖的研究[J].电子科技大学学报,2003,32(6):764~769.
3 顾瑞霞,骆承庠,张文.乳酸菌胞外多糖的研究进展[J].中国乳品工业,1999,27(2):43~46.
4 Mahmood A.Emulsifying properties ofwhey protein-dextran conjugates at low pH and different salt concentr-ations[J].Colloids and Surfaces B:Biointerfaces,2003,31(1):125~132.
5 申瑞玲,田广瑞.食品中蛋白质—多糖混合体系研究进展[J].粮食与油脂,2009(7):1~3.
6 McClements,Julian D.Non-covalentinteractionsbetween proteinsand poly saccharides[J].Biotechnology Advances,2006,24(6):621~625.
7 许朵霞,许洪高,毛立科.蛋白质多糖共价复合物的研究进展[J].食品研究与开发,2008,29(11):186~189.
8 王延青,郭兴凤.蛋白—多糖共价复合物及其应用研究进展[J].中国食品添加剂,2009(5):151~155.
9 Deep G,Hassan A N,Metzger L.Exopolysaccharidesmodify functional properties of whey protein concentrate[J].Journal of Dairy Science,2012,95(11):6 332~6 338.
10 Jiulin X,Paul L,Yesook K,et al.Electrophoretic and quasielastic light scattering of soluble protein-polyelectrolyte complexes[J].Journal of Physical Chemistry,1993,97(17):4 528~4 534.
11 Doublier J L,Garnier C,Renard D,et al.Protein-polysaccharide interactions[J].CurrentOpinion in Colloid&Interface Science,2000,5(3):202~274.
12 Girard M,Schafferlequart C.Attractive interactions between selected anionic exopolysaccharides and milk proteins[J].Food Hydrocolloids,2008,22(8):1 425~1 434.
13 Tuinier R,de Kruif C.Stability of caseinmicelles inmilk[J].Journal of Chemical Physics,2002,117(3):1 290~1 295.
14 李静,杜柏桥,黄龙.酸性乳体系中果胶对酪蛋白胶粒稳定作用的研究进展[J].食品科技,2007(6):21~23.
15 韩清波,刘晶.酪蛋白胶束结构及其对牛乳稳定性的影响[J].中国乳品工业,2007,35(2):43~59.
16 张旭晖,龙芳羽,孙健.乳清蛋白的功能特性及其在酸奶中的应用[J].乳品加工,2006(6):46~48.
17 Donato L,Guyomarc'h F.Formation and properties of the whey proteins/κ-casein complexes in heated skim milk-a review[J].Dairy Science and Technology,2009,89(1):3~29.
18 张和平.乳中酪蛋白胶粒的形成及其结构[J].中国乳品工业,1991,19(5):235~239.
19 王冠群,崔波,檀琮萍,等.变性淀粉对酸奶体系中酪蛋白胶束稳定作用的研究进展[J].山东轻工业学院学报,2012,26(2):11~14.
20 张和平.乳中酪蛋白胶粒的扩散双电层及稳定性[J].内蒙古农牧学院学报,1990,11(2):61~65.
21 卫晓英,李全阳,赵正涛,等.低温刺激对凝固型酸乳质构的影响[J].中国乳品工业,2009,37(7):16~19.
22 赵正涛,王秀菊,安鑫.酪蛋白和胞外多糖作用机理研究进展[J].乳业科学与技术,2009,32(5):246~248.
23 Philippe D,Beat M.Applications of exopolysaccharides in the dairy industry[J].International Dairy Journal,2001(11):759~768.
24 Hassan A N,Ipsen R,Janzen T,et al.Microstructure and theology of yogurtmade with cultures differing only in their ability to produce exopolysaccharides[J].Journal of Dairy Science,2003,86(5):1 632~1 638.
25 Eleana K,Zhutuan Miao,Milena C.The role of exopolysaccharide produced by Lactococcus lactis subsp.cremoris in structure formation and recovery of acid milk gels[J].International Dairy Journal,2011,21(9):656~662.
26 马静,裴家伟,吴荣荣,等.影响乳酸菌胞外多糖产量的因素研究[J].中国乳品工业,2003,31(5):12~16.
27 Corredig M,Sharafbafi N,Kristo E.Polysaccharide-protein interactions in dairymatrices,control and design of structures[J].Food Hydrocolloids,2011,25(8):1 833~1 841.
28 Ayala-Hernández I,Goff H D,Corredig M.Interactions between milk proteins and exopolysaccharides produced by Lactococcus lactis observed by scanning electron microscopy[J].Journal of Dairy Science,2008,91(7):2 583~2 590.
29 Susann M,Mi chaela P,Karin B,et al.Addition of purified exopolysaccharide isolates from S.thermophilus tomilk and their impact on the rheology of acid gels[J].Food Hydrocolloids,2013,32(1):178~185.
30 李全阳,夏文水.一种乳酸菌多糖对酸乳凝胶的影响机理[J].高等学校化学学报,2007,28(5):868~871.
31 Maude G,Christelle S L.Gelation of skim milk containing anionic exopolysaccharides and recovery of texture after shearing[J].Food Hydrocolloids,2007,21(7):1 031~1 040.
32 杨同香,王芳,李全阳,等.温度对酸乳中乳酸菌胞外多糖作用机制的研究[J].食品工业科技,2012,33(9):58~61.
33 Douglas G,Paul A,Douglas H,et al.A possible structure of the casein micelle based on high-resolution field-emission scanning electron microscopy[J].International Dairy Journal,2004,14(12):1 025~1 031.
34 Ayala-Hernández I,Goff H D,Corredig M.Interactions between milk proteins and exopolysaccharides produced by Lac tococcus lactis observed by scanning electron microscopy[J].Journal of Dairy Science,2008,91(7):2 583~2 590.
35 Martin H,Goff H,Alexandra S.Immobilization of casein micelles for probing their structure and interactions with polysaccharides using scanning electron microscopy(SEM)[J].Food Hydrocolloids,2006,20(6):817~824.
36 Amatayakul T,Halmos A L,Sherkat F,et al.Physical characteristics of yoghurts made using exopolysaccharide producing starter cultures and varying casein to whey protein ratios[J].International Dairy Journal,2006,16(1):40~51.
37 罗玲泉,刘成国,黄永锋.乳酸菌胞外多糖及其对酸乳品质的影响[J].食品工业科技,2007,28(6):233~236.
38 Prasannaa PH P,Grandisona A S,Charalampopoulos D.Microbiological,chemical and rheological properties of low fat set yoghurt produced with exopolysaccharide(EPS)producing Bifidobacterium strains[J].Food Research International,2013,51(1):15~22.
39 Rodríguez Patino JM,Pilosof M R.Protein-polysaccharide interactionsat fluid interfaces[J].Food Hydrocolloids,2011,25(8):1 925~1 937.
40 Martin H,Goff H,Alexandra S.Immobilization of casein micelles for probing their structure and interactions with polysaccharides using scanning electron microscopy(SEM)[J].Food Hydrocolloids,2006,20(6):817~824.

