表面活性剂与β-环化糊精共同作用对放线菌羟基化维生素D3的影响
王国盼,苏宏飞,+,韦春葵,熊思驰,黄 飞,李 丽,黄时海,*
(1.广西大学生命科学与技术学院,广西南宁530005;2.南宁高新区,广西南宁530007)
维生素D3羟基化成活性形式如1α羟基维生素D3、25羟基维生素D3和1α,25位二羟基维生素D3才能发挥生理活性[1]。研究发现活性维生素D3可调节细胞繁殖和分化[2]。活性维生素D3广泛应用于一些疾病的临床治疗[3]。许多丝状真菌及放线菌具有甾醇羟基化能力,该羟基化作用主要由P450酶催化[4]。微生物的P450和电子传递链相关的蛋白大都在于细胞质或细胞质膜,属于胞内酶。因此发酵往往受到细胞壁和细胞膜的影响。维生素D3并非P450羟化酶的天然底物[5],因此研究作用于细胞膜、细胞壁和底物的物质对于微生物羟基化甾醇和维生素D3具有重要意义。近年来,β-环糊精与表面活性剂等在水溶液中的相互作用对于生命科学相关的囊泡形成以及蛋白质分子折叠有重要影响[6]。水相中β-环糊精与表面活性剂的相互作用主要是前者的憎水性分子内孔容纳后者的疏水性基团形成包合物[7]。有些表面活性剂通透性,活化微生物细胞膜并促进底物、产物的传递和运输,从而影响物质代谢和细胞生长。Fu jii Y等[5]研究证明,β-环糊精能提高25位羟化维生素D3产率。前期实验中紫外诱变选育获得了一株产维生素D羟化酶的放线菌CXX-10突变株。其所产羟化酶为胞内酶,若直接用菌体转化反应,细胞壁及细胞膜会阻碍底物及产物在细胞内外的交换,羟基化产率较低。因此寻找一种既能使产羟化酶菌株细胞膜活化,又不与维生素D3竞争包容于β-环糊精的表面活性剂,对共同发挥两者的促发酵优势是必要和可行的。
1 材料与方法
1.1 材料与仪器
放线菌CXX-10突变株 广西大学生命科学与技术学院食品与发酵工程研究所保藏保存;维生素D3、25羟基维生素D3、β-环化糊精 Sigma公司;表面活性剂 国药集团化学试剂有限公司;其他试剂 为国产分析纯;ISP2固体培养基[8]葡萄糖10g,酵母膏10g,麦芽汁10g,琼脂20g,蒸馏水1000mL,pH7.0~7.5;种子培养基 可溶性淀粉20g,K2HPO41g,KNO30.5g,NaCl 0.5g,FeSO4·7H2O 0.01g,MgSO4·7H2O 0.5g,蒸馏水1000mL,pH7.0~7.2;发酵培养基 蔗糖10g,鱼粉10g,K2HPO41g,KNO30.5g,NaCl 1g,FeSO4·7H2O 0.01g,MgSO4·7H2O 0.5g,蒸馏水1000mL,pH6.0~8.5。
LC-10AVP型高效液相色谱仪 日本岛津公司;移液枪 日本立洋公司;电子分析天平 MEITLER公司;YP1200电子天平 上海精科有限公司;
1.2 实验方法
1.2.1 种子液培养 将ISP2培养基斜面上的单菌落接种到装有玻璃珠的种子培养基中,28℃,180r/min振荡培养72h作为种子液。
1.2.2 25-羟基维生素D3含量的测定 按照改进的Bligh-Dyer[9]方法制备得到粗品。粗品溶解于乙腈,HPLC检测25-(OH)D3含量[10]。产率计算公式:产率=液相检测浓度×浓缩液体积/样品总体积。
1.2.3 表面活性剂和环化糊精最佳组合的选择 以50mL/250mL的发酵液/三角瓶装液量,将培养好的种子液按3%接种量接入带有玻璃珠的发酵培养液中,28℃,180r/min振荡培养72h。添加乙醇溶解的终浓度为0.1mg/mL的维生素D3,实验组一:同时添加浓度为0.02%的各种表面活性剂或者只添加0.5% β-环化糊精,其他条件不变的情况下发酵。实验组二:同时添加浓度为0.02%的各种表面活性剂和0.5% β-环化糊精,其他条件不变的情况下发酵。空白对照组:不添加表面活性剂和β-环化糊精。每个因素做3个平行实验,28℃,180r/min,发酵转化96h。测定25-羟基维生素D3含量。
1.2.4 菌丝体干重的测定 以50mL/250mL的装液量,接入0.25mL出发菌株的孢子悬浮液于带有玻璃珠的浓度为0.02%不同表面活性剂的菌丝培养液中,28℃,180r/min振荡培养96h。用蒸馏水将菌丝体冲洗3次后真空抽滤,将抽滤好的菌丝体置于65℃的烘箱烘干至恒重,用电子天平称其重量。
1.2.5 表面活性剂和环化糊精较佳组合的发酵条件优化 根据上述实验,选取较佳的表面活性剂和环化糊精组合,优化添加浓度、发酵温度、pH、培养时间和添加时间等条件,研究其对羟基化产物产率的影响。
2 结果与讨论
2.1 表面活性剂和环化糊精较佳组合的选择
由图1可知,Tween-80和Glycein(甘油)单独作用可提高25-羟基维生素D3的产率,Triton-100、SDS和CTAB可抑制25-羟基维生素D3的生成。β-环化糊精单独作用也可提高25-羟基维生素D3的产率。表面活性剂Tween-80、甘油与β-环化糊精共同作用能较大程度地提高25-羟基维生素D3的产率。依据实验结果,可选择Tween-80和β-环化糊精组合做进一步研究。
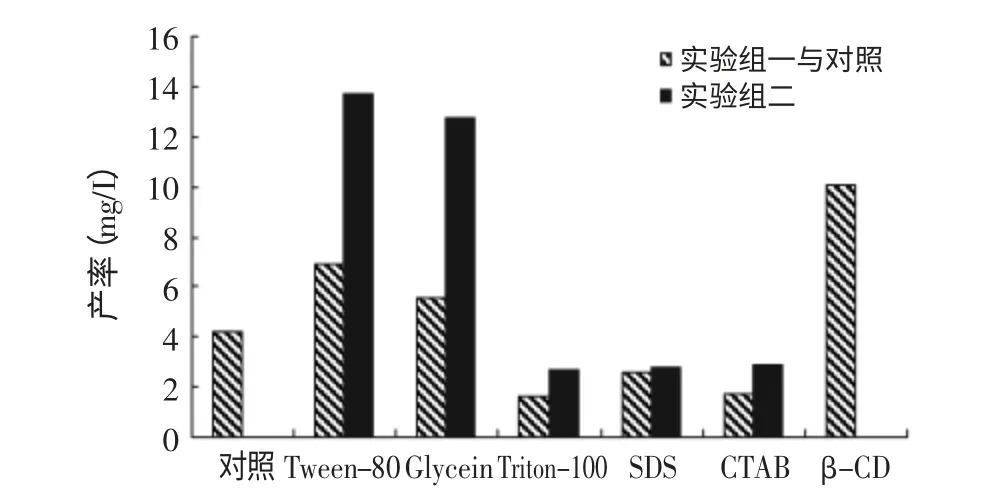
图1 表面活性剂和β-环糊精对25-(OH)VD3产率的影响Fig.1 Effect of various surfactants and β-CD on productivity of 25-(OH)VD3
对于实验结果,分析认为:放线菌CXX-10细胞壁受到一些表面活性剂的影响变得松弛,如Tween-80和Glycein,从而有利于底物维生素D3到达细胞膜并通过协助扩散进入细胞质。表面活性剂一般来说具有活化细胞膜的作用,但有些表面活性剂可能也会过度损伤细胞膜,抑制菌体的生长,不利于酶的生成[11]。进一步研究各种表面活性剂对菌体生长的影响。β-环化糊精与维生素D3形成复合物,有利于维生素D3溶于发酵液,从而增大细胞与维生素D3接触几率。另外β-环化糊精与维生素D3形成复合物有可能使维生素D3构象发生变化,形成的复合物能更好地结合到羟化酶结合位点[5]。此外,其他可能的原因是β-环化糊精疏水性的内腔可包容产物25-(OH)D3,从而间接降低代谢产物积累,减少羟基化产物对羟基化酶的反馈抑制作用,从而有利于产物的合成。而Tween-80、甘油与β-环化糊精共同作用,可能综合提高了维生素D3溶解度、运输和酶作用效率等,增加羟基维生素D3产率的效果更加明显。依据实验结果,可选择Tween-80和β-环化糊精组合做进一步研究。
2.2 表面活性剂对菌体生长的影响
有些表面活性剂通透性,活化微生物细胞膜并促进底物、产物的传递和运输,从而影响物质代谢和细胞生长。各种表面活性剂对CXX-10突变菌株生长的影响表1所示。
由表1可知,Tween-80和Glycein对菌体的生长影响不大,SDS、CTAB和Triton-100对菌体的生长影响大,抑制菌体的生长。因此选择合适的表面活性剂对羟化菌株的生产很重要。

表1 Tween-80和β-环化糊精浓度对菌体生长的影响Table 1 Effect of β-CD and Tween-80 on mycelia growth
2.3 添加表面活性剂Tween-80和β-环化糊精较适浓度
由表2可知,固定Tween-80的浓度不变,在0.5%~1.5%范围内,25-(OH)VD3产率随β-CD浓度的增高而降低;固定β-CD的浓度不变,在0.02%~0.06%范围内,25-(OH)D3产率随Tween-80浓度的变化先升高后降低;同时添加β-CD和Tween-80的较适浓度分别为0.5%和0.04%。在此条件下25-(OH)D3产率达14.0mg/L。

表2 Tween80和β-环化糊精浓度对25-(OH)D3产率的影响Table 2 Effect of β-CD and Tween-80 density on productivity of 25-(OH)D3
2.4 发酵温度对25-(OH)D3产率的影响
设置不同温度的摇床,其他条件不变的情况下,添加乙醇溶解的维生素D3,同时添加0.04% Tween-80和0.5% β-环化糊精进行实验对照,转化培养96h后,提取产物检测。如图2所示,添加或者不添加表面活性剂Tween-80和β-环化糊精的较适温度均为28℃。其可能原因是羟化酶是蛋白酶,随着温度升高酶活增高,达到最适温度后,蛋白酶开始因温度升高慢慢失活,造成酶活降低。
2.5 pH对25-(OH)D3产率的影响
根据上述实验得出的较适条件,配制不同pH的发酵液,以不添加Tween-80和β-环化糊精为对照组,其他条件不变,转化反应完成后提取产物检测。结果如图3所示,添加、不添加表面活性剂Tween-80和β-环化糊精的较适pH都为7.0。可能的原因是羟化酶是蛋白酶,溶液的pH会影响底物的解离状态,影响底物与酶的结合。

图3 pH对25(OH)D3产率的影响Fig.3 Effect of pH value on productivity of 25(OH)D3
2.6 发酵转化时间对25-(OH)D3产率的影响
在以上优化条件的基础上,以不添加Tween-80和β-环化糊精为对照组,分别在发酵3、5、7、9、11d后取样,提取产物检测。如图4所示,添加表面活性剂Tween-80和β-环化糊精后,25-(OH)D3产率随发酵时间的延长而提高,但发酵7d后产率不再增加。对照组在7d时产率最大,随后有所回落。有可能β-环化糊精包容产物,使其不容易变质,所以在产率最高发酵时间7d后,产物没有明显的降低。而空白对照组在产率最高发酵时间7d后,产物有明显下降趋势。但考虑到发酵工艺要求,较适发酵时间以7d为宜。
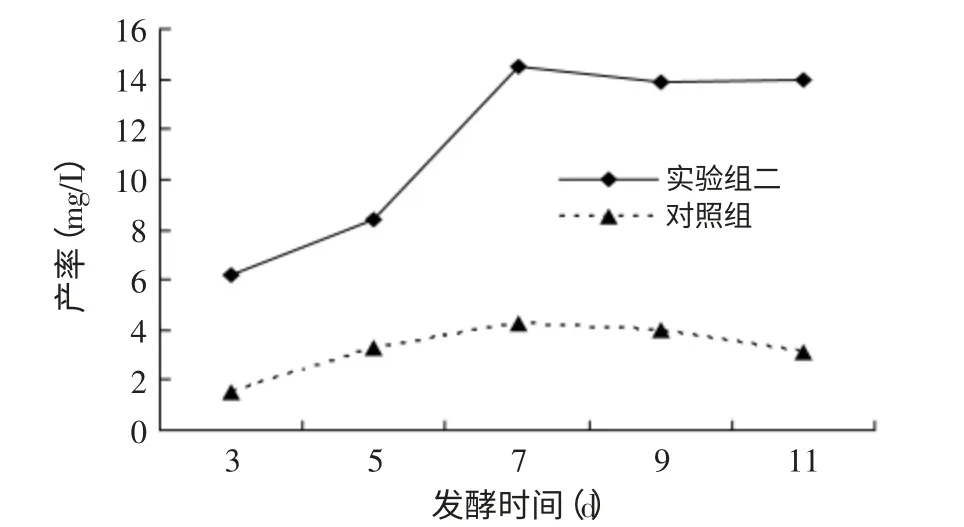
图4 发酵时间对产率的影响Fig.4 Effect of fermentation time on productivity
2.7 表面活性剂Tween-80和β-环化糊精添加时间对产率的影响
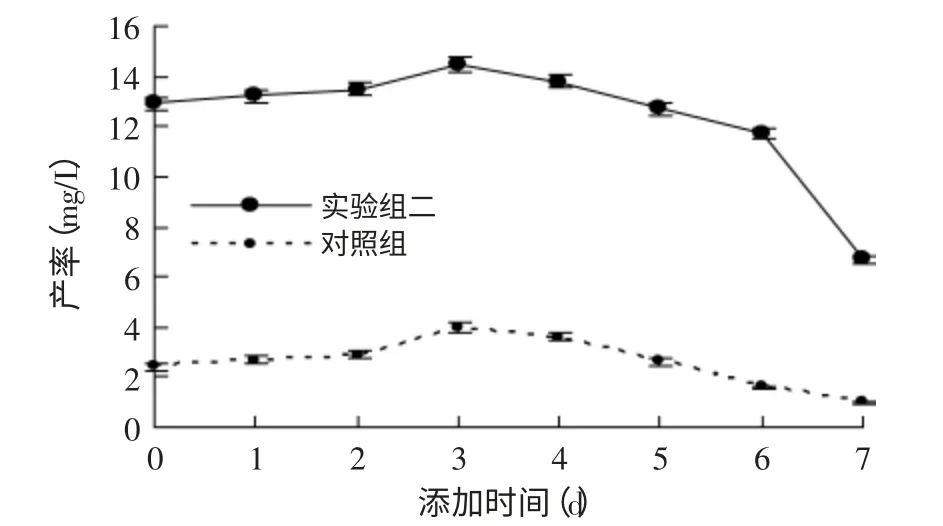
图5 Tween-80和β-CD添加时间对产率的影响Fig.5 Effect of addition time of Tween-80 and β-CD on productivity
在以上优化条件的基础上,保持其他条件不变,以不添加Tween-80和β-环化糊精为对照组,分别在培养0、1、2、3、4、5、6、7d时添加Tween-80、β-环化糊精和VD3,发酵转化至第8d后提取产物检测。如图5可知,实验组在培养3d时添加,产物25-(OH)D3产率最高,达到了14.5mg/L;对照组也是在第3d时添加VD3合适,过早或延后均不利于菌体的羟基化能力。可能的原因是3d时菌体处在对数生长期,菌体较多,酶活较高,反应时间充足。
3 结果与讨论
通过研究表面活性剂、β-环化糊精及其共同作用对放线菌CXX-10诱变菌株羟基化维生素D3的影响,选择了促进作用较明显的Tween-80和β-环化糊精组合,25-(OH)D3的产率达14.0mg/L左右。并优化其使用浓度、作用温度、pH、转化和添加时间等反应条件:培养3d后添加0.04% Tween-80、0.5% β-环化糊精和VD3,pH为7.0,28℃,180r/min,发酵转化反应7d。在此条件下,25-(OH)D3产率达14.5mg/L,约为未添加Tween-80和β-环化糊精的对照组的300%,显著提高了该菌株的羟基化效率。
利用微生物转化维生素D3生产活性维生素D3具有条件温和、污染少、提纯方便等优势,但由于菌体酶活力、底物的溶解性和细胞膜壁等限制,效率不高,现阶段与实际应用尚有一段距离。而通过添加表面活性剂Tween-80以促进菌体膜壁运输、β-环化糊精与底物形成复合物,探讨发酵条件等方面,是一种有效的选择。而有表面活性剂和β-环化糊精单独和共同作用的机理也尚未清楚,有必要进一步做详细研究。
[1] DeLuca HF,Schnoes HK.Vitamin D:recent advances[J]. Ann Rev Biochem,1983(52):411-439.
[2] Y Seino,H Tanaka,K Yamaoka,et al. Circulating 1a,25-dihydroxyvitamin D levels after a single dose of 1a,25 -dihydroxyvitamin D3or 1a-hydroxyvitamin D3in normal men[J].Bone Miner,1987(2):479-485.
[3] Rachez C,Freedrmn LP. Mechnisms of gene regulation by vitamin D3receptor,a networrk of CO,activator interactions[J].Gene,2000,246:9221.
[4] 张裕卿,王东青. 植物甾醇微生物转化制备甾体药物中间体的研究进展[J]. 微生物学通报,2006,33(2):142-146.
[5] Fu jii Y,Kabumoto H,Nishimura K,et al. Purification,characterization,and directed evolution study of a vitamin D3hydroxylase from Pseudonocardia autotrophica[J].Biochemical and Biophysical Research Communications,2009,385(2):170-175.
[6] 张元超,黄立新,徐正康. 环糊精的改性和应用研究进展[J].现代食品科技,2008,24(9):947-948.
[7] 蒋锡夔,汁国桢. 物理有机化学前沿领域两个重要方面:有机分子簇集和自由基化学的研究[J]. 化学通报,2003,66(3):147-161.
[8] Shirling EB,Gottlieb D. Methods for characterization of Streptomyces species[J]. International Journal of Systemratic and Evolutionary Microbiology,1966,16:313-340.
[9] Lund J,H F DeLuca.Biologically active metabolite of vitamin D3from bone,liver,and blood serum[J]. J Lipid Research,1999,7:739-744.
[10] Sasaki J,Mikami A,Mizoue K,et al. Transformation of 25-and la-hydroxy vitamin D3to la,25-dihydroxy vitamin D3by using Streptomyces sp.strains[J].Apply Environment Microbiology,1991,57:2841-2846.
[11] 钱欣平,阳永荣,孟琴. 生物表面活性剂对微生物生长和代谢的影响[J]. 微生物学通报,2002,29(3):75-78.

