胱抑素C原核表达载体的构建、表达及蛋白纯化
唐红卫,刘一凡,孙 禅,端永艳,李 迪,李绵洋,王成彬解放军总医院 临检科,北京 0085;中南大学湘雅医学院 医学检验系,湖南长沙 400;深圳康美天鸿有限公司,北京 008
血清胱抑素(cystatin C,Cys-C)是一种低分子量蛋白质,是由122个氨基酸组成的半胱氨酸蛋白酶抑制剂,是一种血浆内源性成分,它具有稳定和不受调节的性质,可自由通过肾小球。Grubb等[1]于1985年首先报道其血清Cys-C水平与肾小球滤过率(glomerular filtration rate,GFR)密切相关,可作为肾小球滤过功能的指标,对早期肾病的检测有重要意义。目前常用的检测Cys-C的方法有:单向免疫扩散法(radial immmene diffusion,RID)、酶免疫测定法(enzymeimmunoassay,EIA)、放射免疫法(radioimmunoassay,RIA)、乳胶颗粒增强免疫比浊法(particle enhanced turbidimetric immunoassay,PETIA)、时间分辨荧光免疫法(time resolved fluoroisnmunoassay,TRFIA)、颗粒增强散射免疫比浊法(particle-enhanced nephelometric immunoassay,PENIA)等。而PENIA法因其自动化程度较高,灵敏度可达150 μg/L,远远底低于健康人的下限,而成为临床检测Cys-C的最常用方法[2]。但目前国内常用的胱抑素C监测试剂盒均为进口试剂盒,价格昂贵,影响其在国内的推广应用。本实验利用pET表达系统,在大肠埃希菌中表达Cys-C,并进行纯化,为进一步制备抗体,制备研发测Cys-C试剂盒奠定基础。
材料和方法
1 主要材料 大肠埃希菌Rosetta、载体pET-30a(+)购自上海诺力有限公司;琼脂糖凝胶回收试剂盒购自Bioflux公司;载体测序和引物合成均由Invitrogen公司完成;HEK293细胞株购自北京伯乐生命科学发展有限公司;限制性核酸内切酶BamHⅠ和HindⅢ、DNA连接酶、Trizol试剂购自TAKARA公司;AMV逆转录酶购自美国Promega公司;质粒提取试剂盒、DNA凝胶回收试剂盒、普通DNA产物纯化试剂盒购自天根生化科技有限公司;蛋白Marker购自Fermentas公司;镍离子亲和层析柱(Ni2+-NTA agarose)购自Qiagen公司;羊抗人Cys-C蛋白抗体购自 Santa Cruz公司;兔抗羊IgG及辣根过氧化物酶标记的亲和素均购自北京鼎国生物公司;其他化学试剂均为国产分析纯。
2 寡核苷酸引物设计与合成 遵循PCR引物设计的原则,根据GeneBank(NM-000099.2)报道的Cys-C的cDNA序列,设计编码Cys-C基因片段5'和3'端寡核苷酸引物,并在各自5'末端分别引入BamHⅠ和HindⅢ限制性内切酶位点5'和3'端引物序列:5'端引物,5'-CGGGATCCGGCTCCAGTCCT GGCAAG-3';3'端引物,5'-CCCAAGCTTTTAGGC GTCCTGACAGGTGGATT-3',以上引物由Invitrogen公司完成合成。
3 RT-PCR扩增及测序 Trizol法从HEK293细胞株提取mRNA,1%琼脂糖凝胶电泳测RNA纯度,AMV逆转录酶逆转录合成单链cDNA,并以此为模板RT-PCR得到Cys-C基因双链DNA。PCR参数:94 ℃预变性4 min;94 ℃变形40 s;57 ℃退火40 s,72 ℃延伸30 s,循环30次;72 ℃终延伸5 min。1%琼脂糖凝胶电泳鉴定并最终获得重组载体pET-30a(+)-CysC体,转化大肠埃希菌Rosetta,经过蛋白筛选,酶切、 PCR鉴定初筛阳性克隆菌株。基因测序由Invitrogen公司完成。
4 Cys-C阳性克隆菌株的诱导表达 阳性克隆菌接种于20 ml LB液体培养基中(含50 mg/L卡那霉素),37 ℃,200 r/min摇荡过夜。次日取2 ml菌液接种于600 ml液体培养基中(含50 mg/L卡那霉素),37 ℃,200 r/min培养4 h左右,至OD值A600为0.6 ~ 0.8。添加诱导剂异丙基-β-D-硫代吡喃半乳糖苷(isopropyl-β-D-thiogalac-topyranoside,IPTG)(0.1 mm),16 ℃,100 r/min培养17~18 h。将培养基4 ℃,5 000 r/min离心10 min,收集菌体。取部分菌加入裂解液(pH 8.0 Tris-Hcl 20 mmol/L),取上清,超生破碎取蛋白,13 000 r/min,10 min。将沉淀物再进行裂解悬浮,超生破碎。分别取上清和沉淀加入5×SDS缓冲液中,SDS-PAGE电泳显示表达的Cys-C多数存在于沉淀中。
5 Cys-C的提取及纯化 诱导600 ml阳性表达菌液,离心收集菌体沉淀,加入Tris-NaCl缓冲液A(20 mmol/L Tris,300 mmol/L NaCl,5 mmol/L咪唑,pH=8.0),超声裂解菌体(冰水混合物,180 W,30 min)。4 ℃、12 500 r/min,取上清,溶液过滤器抽滤,通过AKTA purifier 10/100系统,运用镍柱亲和层析法纯化Cys-C。收集原液、流出液、10%、20%、30%、60%、100%B(20 mmol/L Tris,300 mmol/L NaCl,500 mmol/L咪唑,pH = 8.0)洗脱液,SDS-PAGE电泳,得到蛋白纯化图。
6 Cys-C的ELISA评价 微孔板每孔包埋纯化所得Cys-C蛋白1 μg,阴性对照包被HP天然抗原。将羊抗人Cys-C单抗按1∶20 000、1∶40 000、1∶80 000、1∶160 000、1∶320 000、1∶640 000、1∶1 280 000、1∶5 120 000、1∶10 240 000、1∶20 480 000、1∶40 960 000、1∶81 920 000稀释,37 ℃孵育2 h,洗板。加兔抗羊IgG,37 ℃孵育2 h,洗板。加辣根过氧化物酶(horseradish peroxidase,HRP)标记的亲和素,37 ℃2 h,充分洗涤后加二氨基联苯胺(diaminobenzidine,DAB)显色鉴定表达产物。
7 Cys-C表达量的检测 纯化后洗脱液经SDSPAGE电泳图像分析相对含量。取纯化后Cys-C紫外分光光度计测OD值,计算所得Cys-C浓度为40 μg/ml。
结 果
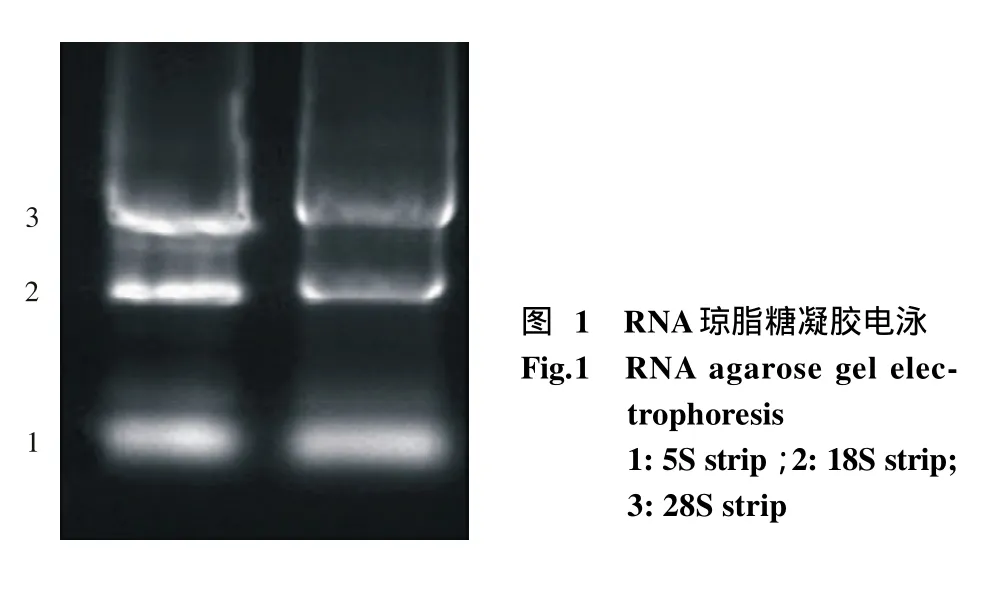
1 琼脂糖凝胶电泳检测RNA完整性 Trizol法提取的RNA,在进行PCR扩增前预先经1%琼脂糖凝胶电泳检测其纯度和完整性。结果显示RNA有明显的3条带即5S、18S和28S,表明RNA提取成功。由图还可以看出18S和28S条带较亮、5S条带亮度较浅,RNA无明显拖带,说明RNA没被降解,完整性较好。见图1。
2 Cys-C基因表达的测定 PCR扩增结果由图2A可知目的条带<400 bp,根据引物预期条带的大小为378 bp,扩增与预期结果一致,测序结果显示与GeneBank(NM-000099.2)100%同源。
3 重组载体的菌株的酶切鉴定 选取两个克隆菌株进行酶切鉴定,目的条带及载体条带均与预期一致。下面亮度较弱的条带意味着基因与载体相连接,因较多的Cys-C与载体相结合,所以目的条带亮度较弱。见图2B。

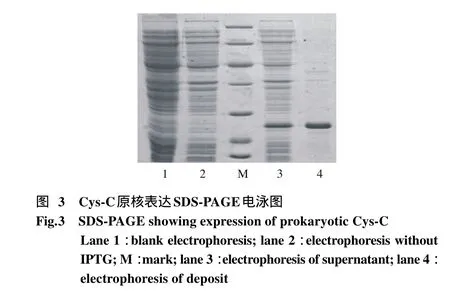
4 Cys-C原核表达SDS-PAGE电泳分析 将含有重组载体pET-30a(+)-CysC的大肠埃希菌Rosetta,经IPTG诱导,进行裂解,超声破碎后SDS-PAGE电泳,见图3。由电泳图可知,未经IPTG诱导的大肠埃希菌未能产生Cys-C;IPTG诱导的大肠埃希菌的上清液和沉淀中均含有较多Cys-C,沉淀中Cys-C较多而纯;Cys-C相当分子质量约为20 000 bp。
5 镍柱亲和层析法纯化目的蛋白 镍柱亲和层析法纯化Cys-C,原液与流出液相比,胱抑素含量明显减低;10%B洗脱可洗掉大部分杂质,且只有小部分胱抑素被洗掉;20%B可得到较多的胱抑素,但仍含有少量杂质;30%B洗脱既可得到较纯净的胱抑素;60%B洗脱所得胱抑素更为纯净,但含量较30%B明显减少。收集30%B、60%B洗脱液进行下一步处理。见图4。
6 Cys-C的ELISA评价 为证实所纯化的蛋白为Cys-C,用羊抗人Cys-C单克隆抗体进行ELISA分析。所纯化蛋白可以与羊抗人Cys-C单克隆抗体特异性结合,从而证明所纯化蛋白为Cys-C。见表1。
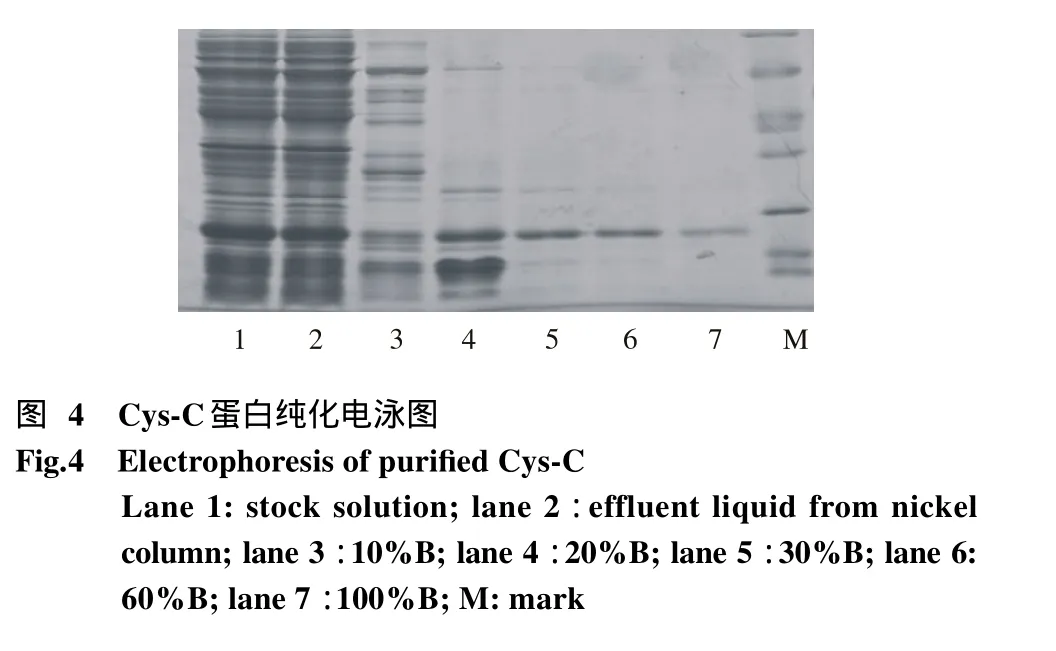
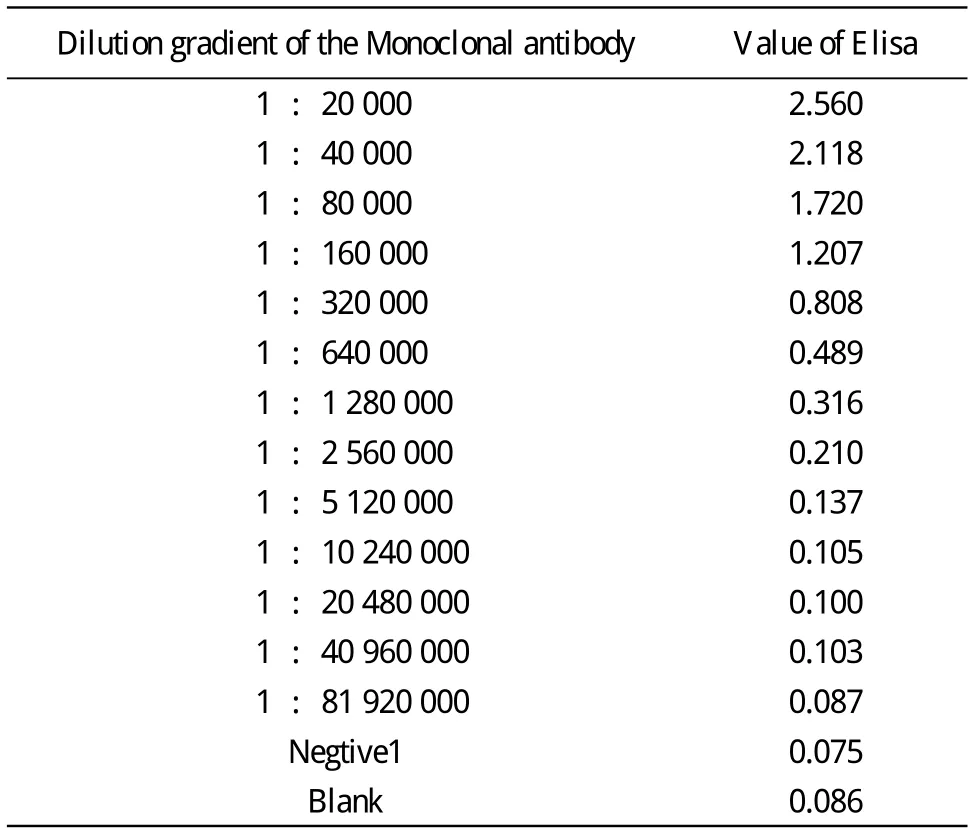
表1 ELISA分析结果Tab. 1 ELISA of Cys-C
讨 论
长期以来,血清肌酐、尿素N、尿酸等是反应肾小球滤过率的常用指标。血清尿素氮首先被作为肾功能的评价指标,但其不符合内源性滤过功能的标记物要求,只有当GFR减少到正常值的40%时,尿素氮才开始升高,且易受到内源性和外源性蛋白物质的影响;血清肌酐作为目前国内仍使用的评价肾小球功能的指标,其只有当肾小球滤过功能减小至正常的1/3以上时才会增加,且易受环境因素的影响。因此肌酐、尿素氮都不能作为肾小球功能的理想指标[3]。胱抑素(cystatin C,Cys-C)是半胱氨酸蛋白酶抑制剂蛋白质中的一种,它由管家基因编码,能在所有的有核细胞内以恒定的速度持续转录和表达,无组织特异性,故Cys-C可在体内以恒定速度产生,并存在于各种体液之中,尤以脑脊液和精浆中含量为高,尿液中最低[3],不受年龄、性别、体重、炎症等因素影响。其分子量小(13 kU),生理条件下带正电荷,能自由通过肾小球,并可被肾小管上皮细胞完全重吸收,不重新回到血液中[4];同时肾小管上皮细胞也不分泌Cys-C至管腔内,其在评估肾小球功能方面可以取代传统的GFR检测[5-6]。因此,Cys-C成为反应肾小球滤过率的理想指标[7-12]。
目前检测Cys-C常用的生化检测方法主要是免疫浊度法,其首要条件是Cys-C蛋白抗原的制备与纯化。本实验采用Trizol法从大肠埃希菌Rosetta gamiB(DE3)(DE3)中通过RT-PCR获得mRNA,经琼脂糖凝胶电泳分析知RNA的完整性较好,且没有蛋白污染。大肠埃希菌Rosetta gamiB(DE3)菌株含有trxB和gor双突变基因,能促进二硫键的形成。研究表明,含有双突变基因的菌株比单独含有trxB的菌株更容易促进二硫键的形成,提高重组蛋白的活性[13]。相同的表达水平,gamiB(DE3)菌株所表达的活性蛋白是其他菌株的10倍以上[14]。Rosetta gamiB(DE3)菌株含有T7RNA聚合酶基因,诱导产生的T7RNA聚合酶合成RNA的效率是其他大肠埃希菌聚合酶的许多倍[15]。另外该菌株缺乏外源性蛋白的lon蛋白酶和ompT外膜蛋白酶,可减少纯化过程中外源蛋白的降解。且该菌株还含有lac透性酶突变基因,可使IPTG均一性进入所有细菌中,提高IPTG的诱导效率,增加重组的Cys-C的表达。而且我们比较了其他菌株的诱导结果,发现Rosetta gamiB(DE3)菌株生成包涵体较少,从而有利于重组的Cys-C的获取。载体pET-30a(+)含有5'-his标签/凝血酶/S.Tag/ enterokinase,以及3'-his标签。pET-30a(+)在辅助噬菌体的帮助下可以产生包含克隆基因单个DNA链的粒子,从而在T7终止引物的作用下实现单链转录。另外pET-30a(+)本身含有his标签,可以与金属螯合物(如镍离子等)结合,从而利于重组蛋白的纯化。经PCR、酶切且测序准确获得重组载体pET-30a(+)-CysC,其与genebank(NM-000099.2)所报道的胱抑素C基因系列达到100%的同源性,基因序列的完全同源确保了诱导蛋白的准确性。本实验研究表明,重组的Cys-C主要以可溶性和非可溶性两种形式存在,未经IPTG诱导的大肠埃希菌基本不表达Cys-C。重组Cys-C主要以可溶性蛋白形式存在于大肠埃希菌中,菌体经超声破碎后,得到重组的Cys-C,再经镍柱亲和层析即可得到纯净的Cys-C,NC膜透析,浓缩纯化,制备纯的Cys-C蛋白。电泳分析结果表明,目的蛋白分子质量约为20 000,相对含量约为20%;ELISA结果表明,所得蛋白可与胱抑素单克隆抗体呈特异性反应,表面所得蛋白为Cys-C。
以上实验结果表明,本次构建的胱抑素C表达系统是成功的,从基因的提取、克隆、表达和纯化都比较简单,为今后制备Cys-C抗体,或实验室胱抑素校准品奠定基础。
1 Grubb A, Simonsen O, Sturfelt G, et al. Serum concentration of cystatin C, factor D and beta 2-microglobulin as a measure of glomerular filtration rate[J]. Acta Med Scand, 1985,218(5):499-503.
2 张淑兰,王铭超,李青果,等.胱抑素C的临床应用及进展[J].国外医学:临床生物化学与检验学分册,2002,23(5):271-272.
3 Tsigou E, Psallida V, Demponeras C, et al. Role of new biomarkers:functional and structural damage[J]. Crit Care Res Pract, 2013:361078.
4 Gökkuşu CA, Ozden TA, Gül H, et al. Relationship between plasma Cystatin C and creatinine in chronic renal diseases and Txtransplant patients[J]. Clin Biochem, 2004, 37(2): 94-97.
5 Dharnidharka VR, Kwon C, Stevens G. Serum cystatin C is superior to serum creatinine as a marker of kidney function: a meta-analysis[J]. Am J Kidney Dis, 2002, 40(2):221-226.
6 Macisaac RJ, Tsalamandris C, Thomas MC, et al. Estimating glomerular filtration rate in diabetes: a comparison of cystatin-C-and creatinine-based methods[J]. Diabetologia, 2006, 49(7):1686-1689.
7 李海霞,张春丽,徐国宾,等. 健康人群血清半胱氨酸蛋白酶抑制剂C与肌酐分布及其评价慢性肾脏病患者肾小球滤过功能的比较研究[J]. 中华检验医学杂志,2006, 29(11):970-974.
8 蔡文慧. 血清胱抑素C浓度在Ⅱ型糖尿病肾病早期诊断中的临床价值[J]. 临床和实验医学杂志,2011,10(4):255-256.
9 楼小伟,董芳.血清胱抑素C在2型糖尿病肾病早期诊断中的临床应用评价[J].当代医学,2011,17(7):2-3.
10 王惠琴.血清胱抑素C在肾功能评价中的应用[J].临床合理用药杂志,2010,3(6):33-33.
11 徐玲玲,姚刚. 胱抑素C评估慢性肾脏病的应用研究[J]. 齐齐哈尔医学院学报,2010,31(18):2912-2912.
12 雷光文,衡爱萍. 血清CysC在早期DN中的诊断价值[J]. 放射免疫学杂志,2010,23(4):442-443.
13 Bessette PH, Aslund F, Beckwith J, et al. Efficient folding of proteins with multiple disulfide bonds in the Escherichia coli cytoplasm[J].Proc Natl Acad Sci U S A, 1999, 96(24): 13703-13708.
14 Prinz WA, Aslund F, Holmgren A, et al. The role of the thioredoxin and glutaredoxin pathways in reducing protein disulfide bonds in the Escherichia coli cytoplasm[J]. J Biol Chem, 1997, 272(25):15661-15667.
15 梁国栋. 最新分子生物学实验技术[M].北京:科学出版社,2003.

