肠系膜淋巴结Th1、Th17细胞在小鼠结肠炎模型发病中作用的研究
万春平 熊尤龙 祁 燕 杨会军 郑 喜 王华宁
云南中医学院第一附属医院中心实验室1(650021) 脾胃病科2
溃疡性结肠炎(ulcerative colitis,UC)是一种病因和发病机制至今尚未完全明确的慢性非特异性肠道炎症性疾病,与克罗恩病(Crohn’s disease,CD)同属于炎症性肠病(inflammatory bowel disease,IBD)范畴,大量临床和动物实验研究表明细胞因子平衡调控网络在IBD的发病和疾病进程中起关键作用[1]。鉴于IBD系以肠黏膜免疫系统异常导致黏膜病理损伤为突出表现,目前关于细胞因子平衡调控网络与UC的研究主要集中于肠黏膜免疫细胞方面,对肠黏膜周围免疫器官——肠系膜淋巴结免疫功能状态及其细胞因子调控在UC中的作用,尤其是Th17细胞作用的研究甚少。本研究应用葡聚糖硫酸钠(DSS)诱导小鼠结肠炎模型以模拟人类UC,探讨肠系膜淋巴结Th1、Th17细胞在UC发病中的作用。
材料与方法
一、实验动物和主要试剂、仪器
雌性C57BL/6小鼠,6~8周龄,体质量20~22 g,购自昆明医科大学实验动物中心。小鼠饲养于SPF级动物实验室,温度(22±1)℃,湿度55%±5%,12 h明暗循环,饲料和饮用水消毒后由动物自由摄取。实验开始前至少适应性饲养1周。
DSS(上海西宝生物科技有限公司),粪隐血测试盒(南京建成生物工程研究所),BD OptEIATM小鼠白细胞介素-1β(IL-1β)、小鼠干扰素-γ(IFN-γ)ELISA试剂盒、BD PharmingenTM小鼠CD16/CD32单克隆抗体(2.4G2)、PE-小鼠 CD11b 抗体(M1/70)、PE-CyTM5-小鼠 CD4 抗体(RM4-5)、PE-小鼠 IL-17A抗体(TC11-18H10)、FITC-小鼠 IFN-γ 抗体(XMG 1.2)、PE-小鼠 IgG1(A85-1)、BD FACSCaliburTM流式细胞仪(BD Biosciences),小鼠CD3e纯化单克隆抗体(145-2C11)、小鼠 CD28纯化单克隆抗体(37.51)、小鼠IL-17A Platinum ELISA试剂盒、FITC-小鼠F4/80 抗体(BM8)(eBioscience,Inc.)。
二、方法
1.动物分组和结肠炎模型制备:20只小鼠随机分为正常对照组和结肠炎模型组,每组10只,前者正常饮水,后者予含5%DSS的饮用水,每2 d更换一次饮用水,连续饮用7 d。
2.结肠炎症程度评估:实验过程中每天称量小鼠体质量,同时观察粪便性状和隐血情况,用于评估疾病活动指数(DAI)。无体质量下降、下降1% ~5%、6% ~10%、11% ~15%、>15%分别计 0、1、2、3、4分;粪便性状正常、半稀便、稀便分别计 0、2、4分;粪隐血(-)、(+)、肉眼血便分别计 0、2、4分。DAI=(体质量下降分数+粪便性状分数+便血分数)/3。于第8 d脱脊椎处死所有小鼠,取自肛门至盲肠段全结肠,测量其长度。
3.结肠组织IL-1β含量测定:取末端结肠组织并称重,每10 mg组织加入冰冷 PBS(pH 7.2)50 μL,以剪刀剪碎组织后制备匀浆,4℃ 400×g离心15 min,吸取上清液,-20℃冻存。参照ELISA试剂盒说明书测定IL-1β含量。
4.肠系膜淋巴结细胞分离[2]以及IL-17A、IFN-γ的诱导表达和测定:无菌取小鼠肠系膜淋巴结,以玻片磨碎,200目尼龙筛网过滤,4℃ 300×g离心5 min,弃上清液,以含10%FBS的RPMI-1640培养基洗涤2次,调整细胞浓度为4×106/mL。将经PBS稀释的CD3单抗(5 μg/mL)加入96孔板,4℃包被过夜,PBS洗涤2次,加入上述分离得到的细胞(4 ×105/孔)和 CD28 单抗(1 μg/mL),37 ℃、5%CO2培养箱中共培养36 h,收集培养上清液,参照ELISA试剂盒说明书测定IL-17A、IFN-γ含量。
5.流式细胞分析
①F4/80与CD11b双标记肠系膜淋巴结巨噬细胞:收集2×106个肠系膜淋巴结细胞于FACS管中,FACS洗液(含2%FBS的PBS)洗涤一次,以小鼠 CD16/CD32 单抗(2.4G2)阻断 Fcγ 受体(FcγR)的非特异性结合后,加入 FITC-小鼠F4/80抗体、PE-小鼠CD11b抗体,冰上避光作用30 min,FACS洗液洗涤一次,加入800 μL FACS洗液,上流式细胞仪检测,BD CellQuest Pro软件分析检测结果。
②肠系膜淋巴结CD4+T细胞内IL-17A、IFN-γ含量检测:取4×106个肠系膜淋巴结细胞,与PMA(50 ng/mL)、ionomycin(750 ng/mL)、brefeldin A(10 μg/mL)混合,37 ℃、5%CO2培养箱中孵育4 h,收集细胞,FACS洗液洗涤2次,加入5 μL小鼠2.4G2单抗,4℃作用30 min以封闭FcγR,FACS洗液洗涤一次,加入 PE-CyTM5-小鼠 CD4抗体,4℃作用30 min,FACS洗液洗涤一次,固定液中固定,FACS洗液洗涤一次,将细胞悬于穿膜液中,同时加入PE-小鼠IL-17A抗体、FITC-小鼠IFN-γ抗体,4℃作用30 min,上流式细胞仪检测,BD CellQuest Pro软件分析检测结果。
三、统计学分析
结 果
一、一般情况和结肠炎症程度
造模过程中两组均无小鼠死亡。结肠炎模型组小鼠实验第2 d开始出现软便,第5 d出现糊状便、液态血便和明显消瘦,此种情况一直持续至实验结束,第6 d、第7 d体质量与正常对照组相比差异有统计学意义(见图1A);该组DAI亦随实验进程而逐渐增加,于第7 d达峰值(见图1B)。第8 d时(处死后),正常对照组小鼠结肠外观平滑,长度较长,无节段性坏死和脓性黏液,结肠炎模型组小鼠结肠红肿、缩短并有节段性坏死,黏膜糜烂且有多量黏液(见图1C),结肠炎模型组结肠长度显著短于正常对照组(见图1D)。上述结果表明DSS小鼠急性结肠炎模型诱导成功。
二、结肠组织IL-1β蛋白表达和肠系膜淋巴结巨噬细胞浸润程度
结肠炎模型组结肠组织IL-1β蛋白表达较正常对照组显著上调(见图2A);该组肠系膜淋巴结细胞中的巨噬细胞标记物F4/80+CD11b+双阳性细胞比例显著高于正常对照组(见图2B),表明模型小鼠肠系膜淋巴结巨噬细胞浸润增加。
三、肠系膜淋巴结Th1、Th17细胞因子表达
ELISA检测结果显示,结肠炎模型组肠系膜淋巴结淋巴细胞经CD3/CD28单抗诱导活化,分泌的Th17细胞因子IL-17A水平显著高于正常对照组(见图3A),Th1细胞因子IFN-γ分泌水平略高于正常对照组,但组间差异无统计学意义(见图3B);进一步以流式细胞术检测活化肠系膜淋巴结CD4+T细胞内的IL-17A、IFN-γ含量,结果显示结肠炎模型组两者表达均较正常对照组显著上调(见图3C)。

图1 正常对照组与结肠炎模型组小鼠一般情况和结肠炎症程度比较
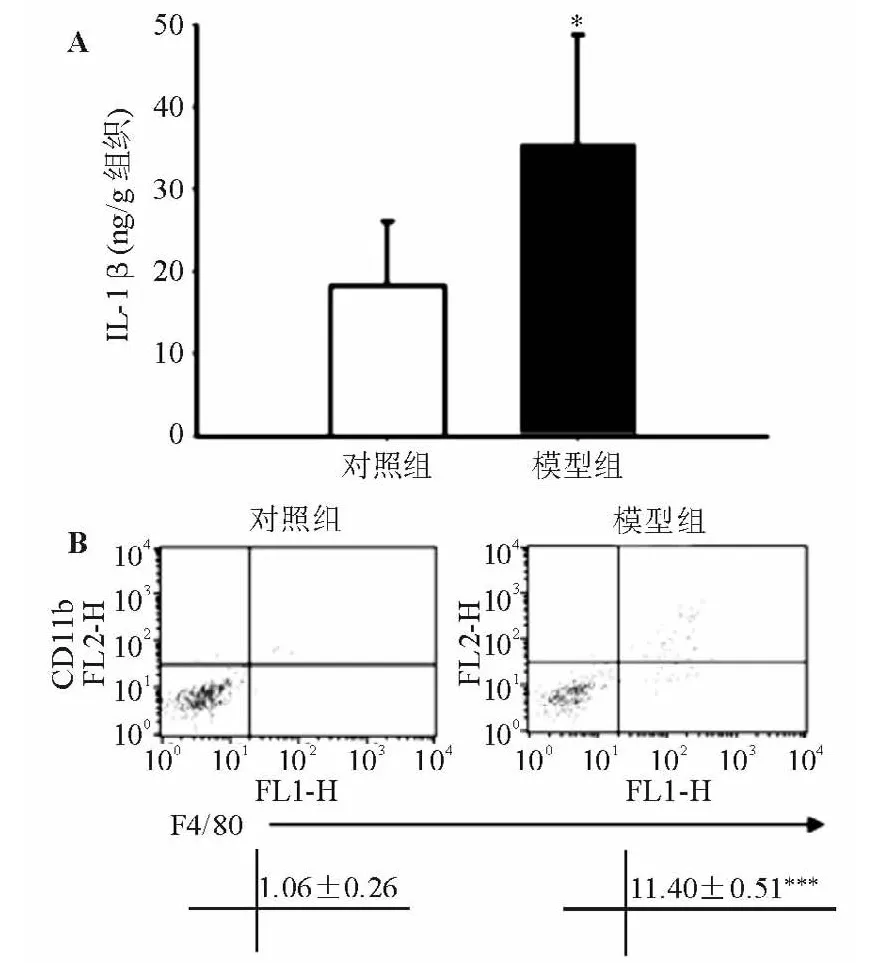
图2 正常对照组与结肠炎模型组结肠组织IL-1β蛋白表达和肠系膜淋巴结巨噬细胞浸润程度比较
讨 论
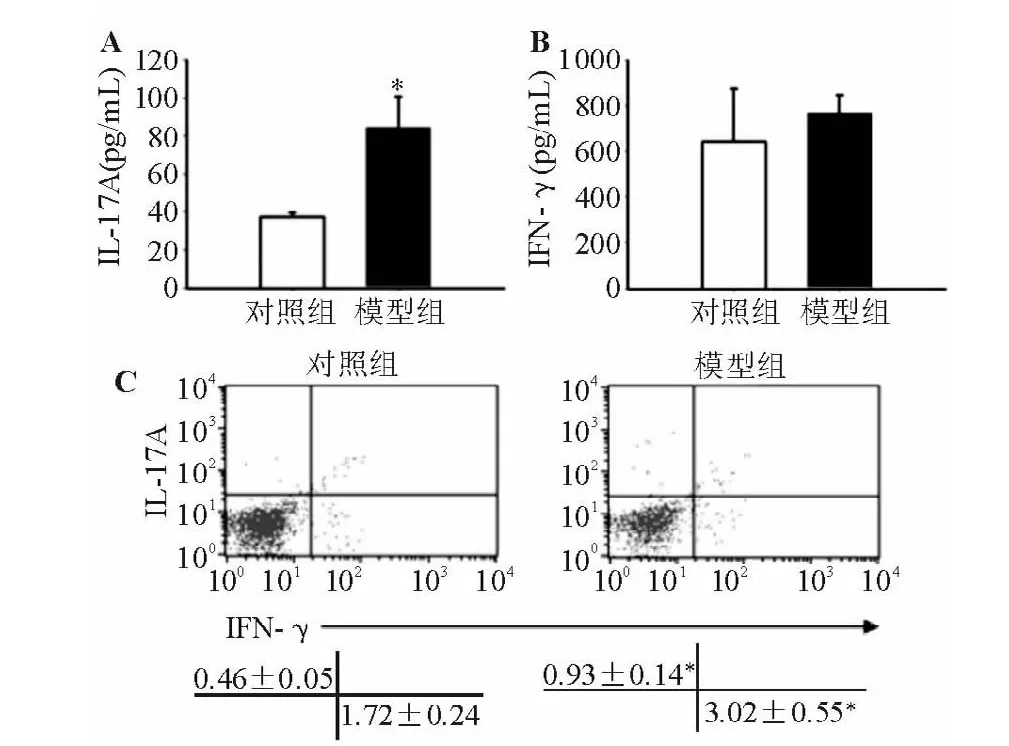
图3 正常对照组与结肠炎模型组肠系膜淋巴结Th1、Th17细胞因子表达比较
UC和CD是IBD的两种主要类型,在病理学上均表现为肠黏膜慢性非特异性炎症。IBD属于自身免疫性疾病,其具体发病机制虽尚未阐明,但已知其发病与遗传、免疫、环境因素以及肠黏膜屏障功能障碍密切相关,肠黏膜免疫系统异常是造成IBD时肠道炎症和组织损伤的关键因素[3]。未致敏的CD4 T细胞经抗原刺激活化后成为CD4+T细胞,后者在不同因素的作用下进一步向 Th1、Th2、Th17、Treg等功能性细胞类型方向分化。Th1细胞主要分泌 IFN-γ、IL-2、IL-12,在细胞介导的免疫应答中起重要作用;Th2细胞主要分泌 IL-4、IL-5、IL-6、IL-10、IL-13,其功能为促进B细胞增殖并产生抗体,主要介导体液免疫反应;Th17细胞是近年发现的一种由IL-23诱导分化、能分泌促炎细胞因子IL-17的新的Th细胞亚群,其主要作用是介导炎症反应[4]。
大量研究表明细胞因子平衡调控网络在IBD的肠黏膜先天和获得性免疫应答调控中起重要作用。活动期IBD患者炎症黏膜和血清Th17细胞因子IL-17均呈高表达,并与肠黏膜免疫、炎症反应异常有关[5],阻断IL-17的作用能改善急性结肠炎模型小鼠的肠道炎症和促炎细胞因子、趋化因子产生[6],抑制巨噬细胞过度激活可通过抑制其NF-κB活化而抑制下游促炎细胞因子产生,改善结肠炎模型小鼠的肠道炎症和组织学损伤[7]。然而,IBD不同发病阶段以及不同类型IBD(UC或CD)的细胞因子平衡调控网络存在很大差异。研究[8]发现,在三硝基苯磺酸(TNBS)诱导的CD样结肠炎模型中,Th1-Th17型免疫应答随疾病的慢性化而逐渐增强(IL-12、IL-17表达上调);而DSS诱导的UC样结肠炎模型则表现为由Th1-Th17细胞介导的急性炎症反应(TNF-α、IL-17等表达上调)向主要由Th2细胞介导的慢性炎症反应(IL-4、IL-10表达上调,伴TNF-α、IL-17等表达下调)转化,根据细胞因子表达谱可鉴别IBD及其类型。然而另有研究报道,CD中可见Th2细胞因子(IL-5)高表达,UC中亦可存在Th1 细胞因子(TNF-α、IFN-γ)高表达[8,9],可见在不同类型IBD以及不同种类IBD动物模型中,肠道炎症反应以何种T细胞亚群占主导地位尚不能定论。
目前细胞因子平衡调控网络在IBD中作用的研究主要集中于肠黏膜,关于肠系膜淋巴结免疫功能状态及其细胞因子调控的研究开展甚少,本研究旨在阐明肠系膜淋巴结Th1、Th17细胞及其效应细胞因子在DSS诱导的小鼠UC样结肠炎发病中的作用。分离小鼠肠系膜淋巴结细胞,并在体外以CD3/CD28单抗诱导淋巴细胞活化,结果显示结肠炎模型小鼠活化肠系膜淋巴结淋巴细胞分泌的Th17细胞因子IL-17A水平显著高于正常对照组,Th1细胞因子IFN-γ分泌水平亦呈增高趋势,且流式细胞分析证实模型小鼠活化肠系膜淋巴结CD4+T细胞内IL-17A、IFN-γ表达显著上调。上述结果表明UC样结肠炎模型小鼠肠系膜淋巴结中的Th1、Th17细胞数量显著增多。
大量研究表明,UC患者和UC样结肠炎模型小鼠的肠黏膜中浸润有大量巨噬细胞及其产生的促炎细胞因子(TNF-α、IL-1β、IL-6),参与介导结肠黏膜病理损伤。IL-1β主要由活化的单核巨噬细胞产生,参与包括细胞增殖、分化、凋亡等在内的多种细胞生物学功能,并可介导炎症反应,在IBD的肠黏膜病理损伤中发挥重要作用[10]。本实验发现结肠炎模型小鼠结肠组织IL-1β蛋白表达较正常对照组显著上调,提示模型小鼠肠黏膜巨噬细胞浸润明显,与既往研究结果相符。本实验还观察了结肠炎模型小鼠肠系膜淋巴结中的巨噬细胞浸润程度。F4/80抗原是小鼠巨噬细胞最为常用的标记物之一,另一个广泛使用的巨噬细胞标记物为 Mac-1(CD11b),目前一般采用F4/80与Mac-1(CD11b)双标记巨噬细胞[11],本研究亦采用此法标记巨噬细胞,结果显示结肠炎模型小鼠肠系膜淋巴结细胞中的F4/80+CD11b+双阳性细胞比例显著高于正常对照组,提示在UC发病过程中,除肠黏膜巨噬细胞浸润外,肠系膜淋巴结亦浸润有大量巨噬细胞。
IL-17A是Th17细胞的主要效应因子,与受体结合后,通过激活NF-κB以及调节MAPK信号通路活性发挥生物学效应,具有强大的募集和激活中性粒细胞的能力,能诱导活化T细胞以及刺激成纤维细胞、上皮细胞、巨噬细胞产生多种炎症介质,如IL-1β、IL-6、TNF-α、一氧化氮合酶-2(NOS-2)、IL-8、单核细胞趋化蛋白-1(MCP-1)、金属蛋白酶等而诱导炎症反应[12,13]。而 IFN-γ 是 Th1 细胞分泌的主要细胞因子,在UC肠黏膜免疫应答中起重要作用。基于本实验和既往研究结果可以推测,在DSS诱导的小鼠UC样结肠炎模型中,毗邻肠黏膜的肠系膜淋巴结Th1、Th17细胞过度激活,释放大量效应细胞因子如IL-17A、IFN-γ,诱导巨噬细胞、中性粒细胞浸润、活化,活化的巨噬细胞产生大量炎症因子如IL-1β,作用于临近靶组织——结肠黏膜,参与介导黏膜炎症反应和病理损伤。T-bet、STAT4作为Th1细胞转录因子,可诱导T细胞向Th1细胞方向分化,而转录因子RORγt则在Th17细胞的产生和分化过程中起重要调控作用。在DSS诱导的小鼠UC样结肠炎模型中,T-bet、STAT4和 RORγt如何调控肠系膜淋巴结中的T细胞向Th1、Th17细胞方向分化,进而介导肠黏膜病理损伤,有待进一步研究。
1 Papadakis KA,Targan SR.Role of cytokines in the pathogenesis of inflammatory bowel disease[J].Annu Rev Med,2000,51:289-298.
2 Bai A,Yong M,Ma AG,et al.Novel anti-inflammatory action of 5-aminoimidazole-4-carboxamide ribonucleoside with protective effect in dextran sulfate sodium-induced acute and chronic colitis[J].J Pharmacol Exp Ther,2010,333(3):717-725.
3 Strober W,Fuss I,Mannon P.The fundamental basis of inflammatory bowel disease[J].J Clin Invest,2007,117(3):514-521.
4 Weaver CT,Murphy KM.T-cell subsets:the more the merrier[J].Curr Biol,2007,17(2):R61-R63.
5 Fujino S,Andoh A,Bamba S,et al.Increased expression of interleukin 17 in inflammatory bowel disease[J].Gut,2003,52(1):65-70.
6 Zhang Z,Zheng M,Bindas J,et al.Critical role of IL-17 receptor signaling in acute TNBS-induced colitis[J].Inflamm Bowel Dis,2006,12(5):382-388.
7 Andou A,Hisamatsu T,Okamoto S,et al.Dietary histidine amelioratesmurine colitis by inhibition of proinflammatory cytokineproduction from macrophages[J].Gastroenterology,2009,136(2):564-574.
8 Alex P,Zachos NC,Nguyen T,et al.Distinct cytokine patterns identified from multiplex profiles of murine DSS and TNBS-induced colitis[J].Inflamm Bowel Dis,2009,15(3):341-352.
9 Tsukada Y,Nakamura T,Iimura M,et al.Cytokine profile in colonic mucosa of ulcerative colitis correlates with disease activity and response to granulocytapheresis[J].Am J Gastroenterol,2002,97(11):2820-2828.
10 McAlindon ME,Hawkey CJ,Mahida YR.Expression of interleukin 1 beta and interleukin 1 beta converting enzyme by intestinal macrophages in health and inflammatory bowel disease[J].Gut,1998,42(2):214-219.
11 Hou LF,He SJ,Li X,et al.SM934 treated lupus-prone NZB×NZWF1micebyenhancingmacrophage interleukin-10 production and suppressing pathogenic T cell development[J].PLoS One,2012,7(2):e32424.
12 Awane M,Andres PG,Li DJ,et al.NF-kappa B-inducing kinase is a common mediator of IL-17-,TNF-alpha-,and IL-1 beta-induced chemokine promoter activation in intestinal epithelial cells[J].J Immunol,1999,162(9):5337-5344.
13 Aggarwal S,Ghilardi N,Xie MH,et al.Interleukin-23 promotes a distinct CD4 T cell activation state characterized by the production of interleukin-17[J].J Biol Chem,2003,278(3):1910-1914.

