白芍提取物及其有效成分抗氧化活性的研究
夏 颖 殷志爽 石 晨 王 桥 宋学英
(1.首都医科大学化学生物学与药学院实验中心,北京100069;2.北京双鹤药业股份有限公司产品开发部,北京100012;3.首都医科大学医学实验与测试中心,北京100069)
自由基是人体生命活动中多种生物化学反应的中间代谢产物。正常情况下,人体内的自由基处于不断产生和不断消除的动态平衡中,适量自由基的存在对维持机体的正常代谢是必不可少的。但是当自由基产生过多或消除过慢时,体内累积过多的自由基会造成机体在分子水平、细胞水平及组织水平的损伤而诱发疾病[1-2]。
白芍是一种常用的中药材,有文献[3]报道显示白芍提取物具有抗氧化清除自由基的活性,但并未确定提取物中抗氧化有效成分。在前期的研究[4]中发现,白芍中含有一种生物活性成分,五没食子酰基葡萄糖(pentagalloylglucose,PGG),其化学结构见图1。
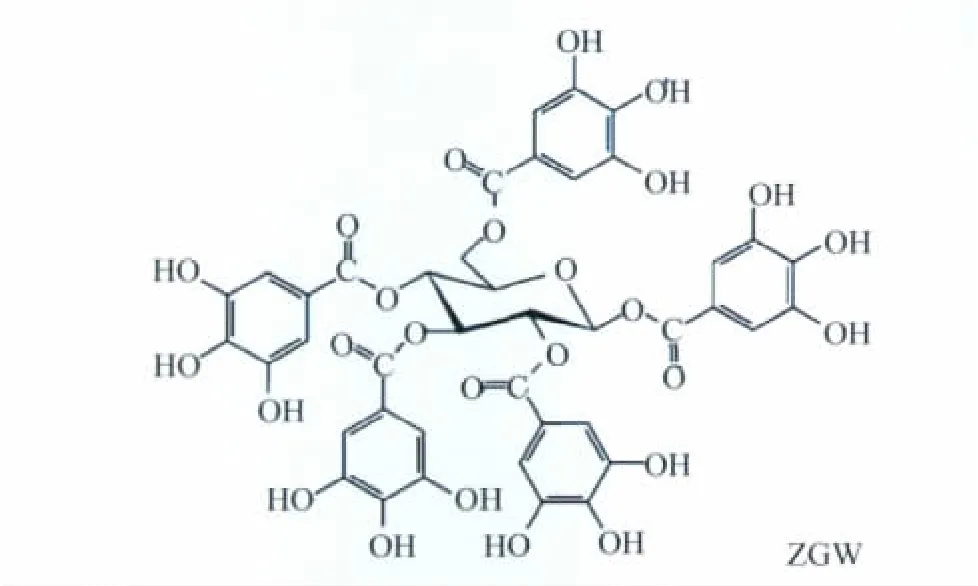
图1 五没食子酰基葡萄糖的化学结构Fig.1 Chemical structure of pentagalloylglucose
PGG分子中含有多个酚羟基的结构赋予了它一系列独特的理化性质和生理活性,根据其结构特点,提示PGG将可能成为一种天然抗氧化剂而具有潜在的广泛应用前景。
1,1-二苯基 -2-苦基苯肼自由基法(1,1-diphenyl-2-picrylhydrazyl,DPPH)和 Fe3+-三吡啶三吖嗪法(ferric reducing-antioxidant power,FRAP)法是常用的2种检测物质抗氧化活性方法。
DPPH· 是一种稳定的以氮为中心的自由基。其作用模式为AH+DPPH→·DPPH·H+A·其中,AH代表自由基清除剂(抗氧化剂)。通过物质对DPPH·自由基的清除情况,可以评价其抗氧化能力[5-7]。通常抗氧化能力用残留率来表示,残留率越小,抗氧化能力越强。DPPH·残留率计算公式如下:

其中,[DPPH·]REM为 DPPH·残留率,[DPPH·]T为自由基清除过程中某一时刻DPPH·的质量浓度,[DPPH·]T=0为DPPH的原始质量浓度。在一定的浓度范围内,当自由基清除剂与DPPH·反应达到平衡时,自由基清除剂的浓度越大,则DPPH·的残留率越小,即DPPH·的残留率与自由基清除剂浓度成反比。故测定不同浓度的自由基清除剂与DPPH·反应达到平衡时DPPH·的残留率,即可得到残留率与清除剂浓度的线性回归方程。由方程计算残留率为50%所对应的清除剂浓度即为清除剂的半抑制浓度IC50。IC50越小,表明清除剂清除自由基抗氧化能力越强。自由基的清除能力(antiradical efficiency,AE)可以用IC50的倒数来表示AE=1/IC50。根据AE可以判断抗氧化剂清除自由基的能力大小,AE越大表示其清除自由基能力越强,抗氧化活性越强。DPPH·法测定简便、快速,而且由于DPPH·有较长的半衰期而使此方法具有良好的重现性,可用于有效地评价抗氧化剂的活性,因而此方法被广泛用于评价清除自由基物质的抗氧化能力及天然抗氧化剂的筛选。
由Benzie等[8]建立的 FRAP 法是通过 Fe3+-三吡啶三吖嗪[Fe(III)-TPTZ]在酸性溶液中可以被样品中的还原性物质还原成Fe(Ⅱ)呈现明显的蓝色,在593nm处具有最大吸收。样品溶液的吸光度值越大,表明生成Fe(Ⅱ)越多,样品还原能力越强,故可以用样品与Fe(III)-TPTZ作用生成Fe(Ⅱ)的多少来评价样品抗氧化活性的强弱。用FRAP值表示样品抗氧化活性的强弱,FRAP在数值上等于样品与Fe(III)-TPTZ反应后在593nm处的产生的吸光值所相当的标准FeSO4溶液的浓度(μmol/L)。FRAP值越大,表示样品抗氧化活性越强[7],显示出较强的抗氧化能力,而使机体内免受Fe3+等氧化剂的损伤。该方法原理明确,操作简便,易于标准化。FRAP法常用于测定不同抗氧化物质、食物与生物样品的抗氧化活性。
本文采用高速逆流色谱(high-speed current chromatography,HSCCC)方法,从白芍中提取分离得到其抗氧化有效成分PGG固体粉末。通过DPPH法和FRAP法2种体外抗氧化检测方法对白芍提取物及其有效成分PGG的抗氧化活性进行体外评价。
1 材料和方法
1.1 仪器与材料
2695型高效液相色谱系统(包含四元梯度泵、2996型二极管阵列紫外检测器、empower色谱工作站,美国Waters公司);液相色谱-质谱联用仪(包含Quattro microTMAPI质谱、2695型四元梯度泵、2487型紫外检测器、氦气脱气机、Masslynx 4.0质谱工作站,美国Waters公司);HSCCC-TBE 300A型高速逆流色谱仪(包含8823B型紫外检测器、TBP-50A型泵,上海同田生化技术有限公司);UV-2550型紫外分光光度计(日本 SHIMADZU公司);真空干燥仪(美国Labconco公司)。
白芍(产地安徽亳州)购自北京同仁堂药店;PGG(纯度>98%)购自中山康之源生物科技有限公司;三吡啶三吖嗪(2,4,6-tripyridyl-s-triazine,TPTZ;Alfa Aesar,德国),DPPH·,Alfa Aesar,德国),乙腈(色谱纯,Fisher公司德国),维生素C(Vitamin C,Vc;北京化工厂),其他试剂均为市售分析纯试剂。
1.2 实验方法
1.2.1 白芍粗提物的制备及PGG的分离纯化
采用本实验室前期建立的HSCCC方法从白芍中分离纯化PGG[9],即将白芍粉碎后用50%乙醇-水溶液超声提取,将提取液减压旋干后用水溶解,用乙酸乙酯萃取,将萃取液减压旋干得到白芍粗提物。然后,将粗提物用HSCCC方法进行分离纯化,主机转速为800 r/min,流动相的流速为2.0 mL/min,洗脱方式为从头至尾的方式,用紫外检测器在280 nm处在线监控。先采用一种溶剂体系(正己烷-乙酸乙酯-甲醇-水,0.5 ∶5∶1 ∶5)进行洗脱,根据 HSCCC 谱图收集含有目标化合物PGG的吸收峰的洗脱液,减压旋干得到初分物。然后,再用另一种溶剂体系(正己烷-乙酸乙酯-甲醇-水,0.5∶5∶0.5∶5)将初分物用HSCCC进一步分离,根据HSCCC谱图收集PGG的吸收峰,减压旋干得到棕色PGG粉末。PGG的检测分析方法采用本实验室前期建立的HPLC方法进行[10]。
1.2.2 白芍粗提物及PGG清除DPPH·活性的测定
1)标准曲线的绘制:准确称取DPPH· 2.5 mg,用乙醇配制成质量浓度为25 μg/mL的标准储备液。分别取 0、2.0、4.0、6.0、8.0 和 10.0 mL,用乙醇定容到10 mL,配制 DPPH·质量浓度分别为 0、5、10、15、20和25 μg/mL系列标准溶液。以乙醇为空白,测定上述标准溶液在517 nm波长处的吸光度。以DPPH·浓度为横坐标,以吸光度为纵坐标绘制标准曲线,其回归方程为 y=0.0319x+0.040,r2=0.9994。
2)DPPH·清除率的测定:选用Vc作为阳性对照药,用乙醇为溶剂,分别将白芍粗提物、PGG和Vc配成一系列待测溶液(浓度分别为 0、25、50、100 μg/mL)。分别取上述各溶液0.10 mL,加入质量浓度为25 μg/mL的DPPH·标准液3.90 mL,摇匀混合液。以乙醇为空白,用紫外-可见分光光度计在517 nm处测定其在不同时间的吸光值。根据标准曲线换算成相应的DPPH· 的质量浓度,计算DPPH· 残留率。以时间t为横坐标,DPPH· 残留率为纵坐标绘制白芍粗提物、PGG及Vc清除DPPH·的曲线,得到不同浓度样品的残留率随时间变化的曲线。
1.2.3 用FRAP法测定白芍粗提物及PGG的抗氧化活性
1)FRAP标准曲线的绘制:参照Benzie等[8]的方法并进行了进一步修改。按照体积比为10∶1∶1的比例,精确量取醋酸钠缓冲液(0.3 mol/L,pH3.6)、TPTZ溶液(10 mmol/L)及标准FeSO4溶液,混匀,即得 FeSO4标准系列溶液(浓度分别为10、25、100、150、200、400、500 μmol/L)。
分别取4.0 mL各FeSO4标准溶液,在37℃反应30 min,然后测定溶液在593nm处吸光度。以FeSO4浓度为纵坐标(表示为FRAP值),吸光度为横坐标,绘制FRAP标准曲线,其回归方程为 y=524.67x-2.0301,r2=0.999 9。
2)抗氧化活性(FRAP值)的测定:TPTZ工作液的配制:TPTZ工作液由0.3 mol/L醋酸钠缓冲液(pH 3.6),10 mmol/L TPTZ 溶液和 20 mmol/L FeCl3·6H2O溶液组成,三者按体积比为10∶1∶1混合而成。TPTZ工作液需要现用现配[8]。
用乙醇为溶剂,分别将白芍粗提物、PGG和Vc配制成一系列待测溶液(浓度分别为10、25、50和100 μg/mL),分别取0.20 mL各浓度的待测溶液,加入3.80 mL新鲜配制的TPTZ工作液,混匀。在37℃反应30 min后,测定波长为593 nm处吸光度。每份溶液平行操作3次,取平均值。依据FRAP标准曲线计算各溶液的抗氧化活性(FRAP值)。
2 结果
2.1 白芍粗提物经HSCCC分离纯化得到PGG
将白芍粉碎经乙醇提取得到粗提物,通过HSCCC分离纯化得到棕色PGG固体粉末,经HPLC检测该固体粉末为单一组分(图2A),用归一化法测定其纯度为95.7%;将其HPLC谱图与对照品PGG的HPLC谱图比较,表明该化合物为PGG;用ESI-MS检测其质荷比m/z为939.5(图2B),其相对分子量与PGG分子式C41H32O26吻合,进一步证明该化合物为PGG。

图2 PGG的HPLC谱图(A)和质谱图(B)Fig.2 HPLC chromatogram(A)and ESI-MS spectrum(B)of the PGG extracted from Radix Paeoniae Alba
2.2 清除DPPH·活性的研究
2.2.1 PGG和白芍粗提物清除DPPH·能力大于Vc
从白芍粗提物、PGG及Vc清除DPPH·的残留率曲线图(图3)可以看到,在相同浓度下,白芍粗提物及PGG均表现出较强的清除DPPH·自由基的能力,DPPH·残留率明显低于同浓度Vc,说明白芍粗提物及PGG的抗氧化效果良好,其活性超过阳性对照Vc。

图3 PGG(A)、白芍粗提物(B)及Vc(C)DPPH·残留率Fig.3 DPPH· residual rates of PGG(A),crude extract from Radix Paeoniae(B)and Vc(C)
图3显示,随着抗氧化物质浓度的增大,DPPH·残留率逐渐降低,清除DPPH·自由基的作用增强。表明抗氧化物质的抗氧化能力随浓度增大而增强,即白芍粗提物及PGG清除DPPH·的作用呈一定的量-效关系。当反应到30 min时,各样品溶液基本达到平衡。在PGG、白芍粗提物及Vc浓度同为100 μg/mL时,DPPH·残留率分别为27.2%、33.8%、52.7%,即PGG<白芍粗提物<Vc。这说明抗氧化能力PGG>白芍粗提物>Vc。
此外,从图3还可见以看到,在DPPH·溶液中加入Vc溶液后,开始DPPH·残留率迅速下降,但在5 min左右即达到稳定,此后随着时间的延长DPPH·残留率几乎不再发生变化,也就是说,5 min以后Vc不再使DPPH·减少;而PGG和白芍粗提物可以维持较长的时间清除DPPH·直到约30 min残留率才达到稳定。
2.2.2 白芍粗提物及PGG与Vc清除能力的比较
由图 3可知,当白芍粗提物、PGG和 Vc与DPPH·反应30 min时,各反应体系基本达到平衡状态。分别计算各溶液在与DPPH·反应30 min(即平衡)时DPPH·的残留率,以残留率y对浓度x做线性回归,计算IC50和AE(表1)。

表1 白芍粗提物和PGG对DPPH·的清除能力Tab.1 Antiradical efficiency of scavenging DPPH·of the samples
表1给出DPPH·残留率y与样品浓度x关系的线性回归方程、半抑制浓度IC50和自由基清除能力AE。由表1可以看出,清除DPPH·能力AE的大小顺序为PGG>白芍粗提物>Vc,且PGG的IC50不足Vc的1/2,提示PGG的抗氧化能力高于Vc,将可能成为一种潜在的高效抗氧化剂。
2.3 样品抗氧化/能力检测
FRAP值可以表示样品抗氧化能力的强弱,白芍粗提物、PGG和Vc在不同浓度下的FRAP值详见表2。

表2 不同浓度下白芍粗提物、PGG的FRAP值Tab.2 RAP values of the samples in the different concentrations(μg/mL)
从表2可以看到:①对于同一物质(如PGG、白芍粗提物或Vc),随着样品浓度的增大,溶液FRAP值增大,说明其抗氧化活性随着样品浓度的增大而增加。②在同一样品浓度下,PGG的FRAP值最大,抗氧化能力最强;其次是白芍粗提物,其FRAP值也大于Vc。这说明PGG和白芍粗提物的抗氧化活性均高于阳性对照Vc,抗氧化能力顺序为PGG>白芍粗提物>Vc。③当样品浓度较低(如 10 μg/mL)时,Vc的FRAP远小于PGG和白芍粗提物,可是随着样品浓度的增大,各物质抗氧化能力均有所增强,而Vc抗氧化能力增加得更为显著。当浓度达到100 μg/mL时,Vc的FRAP已经达到420.8 μmol/L,接近白芍粗提物(421.3 μmol/L),但 PGG的抗氧化能力仍最强(FRAP值为576.1 μmol/L),即在样品浓度为100 μg/mL时,抗氧化能力为PGG>白芍粗提物≈Vc。
3 讨论
通过DPPH法和FRAP法两种检测体系,研究白芍粗提物及其有效成分PGG的抗氧化作用。实验结果表明,与阳性对照Vc相比,白芍粗提物和PGG均具有较强的抗氧化活性,且在一定的范围内,浓度越大抗氧化能力越强,其抗氧化作用与浓度呈量效关系。在DPPH·清除实验中,白芍粗提物和PGG均显示了良好的清除自由基的能力,在浓度为10~100 μg/mL范围内,其抗氧化活性均高于Vc;在FRAP抗氧化实验中,白芍粗提物和PGG同样显示了较强的抗氧化能力,但FRAP实验结果与DPPH法所得结果稍有差别的是当样品浓度较大时(如100 μg/mL时),Vc的抗氧化活性接近白芍粗提物,但仍低于PGG。
总之,本实验对白芍粗提物及其有效成分PGG的抗氧化作用的研究结果表明,在中药白芍中含有抗氧化有效成分PGG。与阳性对照Vc相比,白芍粗提物和PGG具有较强的清除自由基及抗氧化活性,且PGG的抗氧化作用远大于阳性对照药Vc。研究结果提示PGG将有可能成为一种潜在的天然高效低毒的抗氧化剂广泛地应用于临床。
[1]Halliwell,B.Free radicals in biology and medicine[M].Clarendon:Oxford University Press,2007.
[2]崔剑,李兆陇,洪啸吟.自由基生物抗氧化与疾病[J].清华大学学报:自然科学版,2000,40(6):9-12.
[3]徐晓燕,吴兆喜,张星,等.不同极性白芍提取物的抗氧化活性研究[J]. 食品与药品,2011,13(9):322-325.
[4]王维聪,王潮,宋学英,等.44 种中药中1,2,3,4,6-五-O-倍酰-D-葡萄糖含量的测定[J]. 中国中药杂志,2008,33(6):656-659.
[5]Deng J,Cheng W Y,Yang G Z.A novel antioxidant activity index(AAU)for natural products using the DPPH assay[J].Food Chem,2011,125(4):1430-1435.
[6]Milardovic S,Ivekovic D,Grabaric B S.A novel amperometric method for antioxidant activity determination using DPPH free radical[J].Bioelectrochem,2006,68(2):175-180.
[7]Müller L,Fröhlich K,Böhm V.Comparative antioxidant activities of carotenoids measured by ferric reducing antioxidant power(FRAP),ABTS bleaching assay(aTEAC),DPPH assay and peroxyl radical scavenging assay[J].Food Chem,2011,129(1):139-148.
[8]Benzie I F F,Strain J J.The ferric reducing ability of plasma as a measure of“antioxidant power”:the FRAP assay[J].Anal Bioehem,1996,239:70-76.
[9]宋学英,殷志爽,赵逸松,等.高速逆流色谱法从白芍中分离纯化五没食子酰基葡萄糖[J].天然产物研究与开发,2012,24(3):303-306.
[10]殷志爽,赵文华,宋学英,等.HPLC法测定白芍和赤芍中 1,2,3,4,6-五-O-倍酰-D-葡萄糖含量[J]. 首都医科大学学报,2008,25(5):601-604.

