荧光法检测鸭肉中新霉素残留的研究
徐 将,刘木华,袁海超,肖海斌,赵进辉,2*
(1.江西农业大学 工学院/生物光电及应用重点试验室,江西 南昌330045;2.华南农业大学 南方农业机械与装备关键技术省部共建教育部重点实验室,广东 广州510642)
新霉素(Neomycin,NEO)是一种氨基糖苷类抗生素,在畜牧、水产养殖业中,已经被严禁使用。但是,部分养殖户为了追求较高的利润,还是大量使用新霉素来预防和治疗家禽、家畜的疾病。但是新霉素与同类抗生素类似,具有肾毒性和内耳毒性,在家禽体内大量地积聚,通过餐桌进入消费者的体内,危害人们的身体健康。因此,对禽肉中新霉素残留的检测是十分重要的。许多国家和地区对新霉素残留限量均有规定,欧盟规定所有食品生产用肌肉中新霉素的残留限量为5 μg/mL[1]。现在对新霉素的检测方法有很多,主要有微生物法[2-4],HPLC[5-6],ELISA[7-8],光度法[9-12],离子色谱法[13],荧光显微成像法[14-15]和荧光法[16-18]等。近年来,荧光法因为其灵敏度高,精确度好,操作简便等特点,引起研究人员的特别关注。李锋等[19]以邻苯二甲醛(OPA)为衍生化试剂进行柱前衍生化测定发酵液中硫酸新霉素的含量取得了满意的结果。本研究中,采用荧光法来检测鸭肉中残留的新霉素。在乳化剂OP -10存在的环境下,利用新霉素中的氨基键与邻苯二甲醛、巯基乙醇反应,形成具有强荧光性的吲哚取代衍生物体系,在激发波长为340 nm,发射波长为440 nm 处取得最佳的检测峰值,结果令人满意。实验证明,应用荧光法检测鸭肉中新霉素残留量的方法是可行有效的,并且操作过程简单方便,为动物源食品中氨基糖苷类抗生素的快速检测奠定了基础。
1 实验部分
1.1 仪器与试剂
Cary Eclipse 型荧光分光光度计(美国WARIAN 公司);JK-50B 型超声波清洁器(合肥金尼克机械制造有限公司);FA1004 型电子天平(上海上平仪器有限公司);JJ-2B 型组织捣碎机(金坛市金南仪器厂);RE-52AA 型旋转蒸发器和SHZ-ⅢD 型循环水真空泵(上海亚荣生化仪器厂)。
新霉素(购自江西省食品药品检验所);邻苯二甲醛;乳化剂OP-10(化学纯);巯基乙醇;磷酸氢二钠;柠檬酸;乙二胺四乙酸二钠(Na2EDTA);乙醇(液相色谱纯)。实验用水为超纯水。
1.2 标准品与样品制备
1.2.1 标准品制备 称取25 mg 的NEO 标准样品,放入250 mL 棕色容量瓶中,用超纯水定容,配制成100 mg/L 的标准储备液。使用时,用超纯水稀释至所需的不同浓度。称取13.4 mg 邻苯二甲醛溶于1 000 mL容量瓶中,得到13.4 mg/L 的邻苯二甲醛溶液;吸取140 μL 浓巯基乙醇溶液于100 mL 容量瓶中,用超纯水稀释,得到0.02 mol/L 的巯基乙醇溶液;取100 mL 容量瓶,吸取10 mL 乳化剂OP-10 胶状液体,用70 mL 乙醇稀释,放入超声振荡器中振荡30 min,取出等其温度降低后,再用乙醇定容,得到乳化剂OP-10 溶液。分别取不同浓度的NEO 标准溶液1 mL 于10 mL 棕色容量瓶中,依次加入13.4 mg/L的邻苯二甲醛溶液1.5 mL,乳化剂OP-10 溶液1 mL,0.02 mol/L 的巯基乙醇溶液2.5 mL,用超纯水定容,摇匀,反应90 min 后,检测其荧光强度。
1.2.2 样品制备 将1 000 mL 0.1 mol/L 柠檬酸溶液与625 mL 0.1 mol/L 的磷酸氢二钠溶液混合,得到Mcllvaine 缓冲溶液;称取60.5 g 乙二胺四乙酸二钠(Na2EDTA)溶于Mcllvaine 缓冲溶液中,加热、摇匀,使其充分混匀,制成Mcllvaine-Na2EDTA 缓冲溶液。称取2 g 绞碎的鸭肉样品,置于25 mL 离心管中,加入8 mL 的Mcllvaine-Na2EDTA 缓冲溶液,摇匀,超声振荡10 min 后,以8 000 r/ min 的速度离心10 min,取上清液置于另一支25 mL 离心管中,残渣再加入4 mL 缓冲溶液重复提取一次,合并上清液,摇匀,加入5 mL 超纯水,超声振荡15 min。然后以8 000 r/ min 的速度离心10 min,取出上清液,残渣再重复提取一次,合并上清液,旋转蒸发-水浴烘干,加入1 mL 超纯水。将样品溶液通过滤膜过滤后,置于10 mL 棕色容量瓶中,依次加入13.4 mg/L 的邻苯二甲醛溶液1.5 mL,乳化剂OP-10 溶液1 mL,0.02 mol/L 的巯基乙醇溶液2.5 mL,用超纯水定容,摇匀,反应90 min 后,检测其荧光强度。
1.3 实验装置和原理
如图1 所示,整个实验装置主要由荧光分光光度计和显示器两大部分组成。实验时,将样品倒入比色皿中,再将比色皿放入荧光分光光度计的样品池中;如图2 所示,仪器中的光路采用的是90°角透射进行检测,激发光直接照射在液体样品上,调节激发光的波长,使其达到可以激发被测样品产生荧光的最佳强度,荧光检测器在其直角方向检测激发出来的荧光;通过Cary Eclipse 的分析软件,在显示器上显示检测样品的光谱图。

图1 实验装置图Fig.1 Experimental apparatus
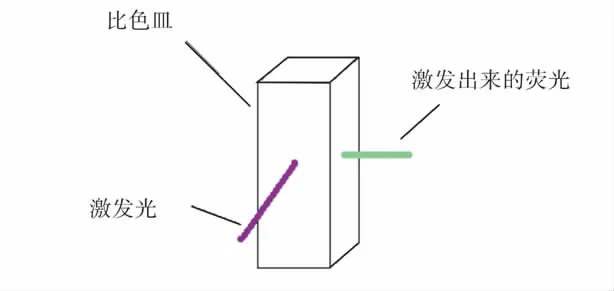
图2 样品池原理图Fig.2 The sample cell diagram
1.4 仪器测定条件
检测液载体为1 cm×1 cm 的石英比色皿,激发和发射光狭缝为5 nm,以激发波长为340 nm 的激发光扫描发射波长为270 ~600 nm 段的荧光光谱,取荧光强度最强处的波长为最佳发射波长,新霉素的最佳发射波长为445 nm。
2 结果与讨论
2.1 激发波长和发射波长
如图3 所示,新霉素准品溶液的主要荧光峰在波长400 ~500 nm 范围内,实验证明,新霉素的发射波长为445 nm。为了得到最佳的荧光激发波长,分别用320、330、340、350 和360 nm 的激发光进行检测,在相同的浓度下,激发的荧光强度越强,说明激发效果越好。结果显示在发射波长400 ~500 nm 范围内,用340 nm 的激发光去激发样品时得到的荧光强度最佳。因此,本研究中激发光的最佳激发波长为340 nm。
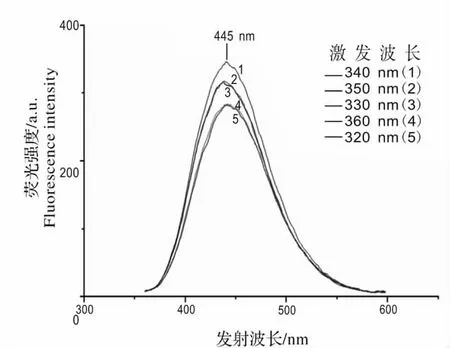
图3 新霉素标准品溶液的发射光谱图Fig.3 The emission spectrum of neomycin

图4 荧光发射光谱图:1.NEO;2.NEO 和邻苯二甲醛、巯基乙醇反应的反应物;3.在乳化剂OP-10 环境下的反应物Fig.4 Fluorescent emission spectra:1.NEO;2.the reactant of NEO,OPA and thioglycol;3.in the environment of Emulsifier OP-10
2.2 NEO 及其反应物的荧光光谱
如图4 中光谱曲线1 所示,NEO 自身几乎不产生荧光,其和邻苯二甲醛、巯基乙醇发生化学反应后,生成的反应物可以产生荧光,如图4 中光谱曲线2 所示,其荧光强度较弱,最佳激发波长λex和发射波长λem分别为340 nm 和436 nm;但是,在乳化剂OP-10 环境下,如图4 中光谱曲线3 所示,该反应物的荧光强度增强近15.4 倍,同时λem位移到440 nm。
2.3 邻苯二甲醛对荧光强度的影响
NEO 与邻苯二甲醛反应,是该实验中最主要的过程,对荧光的强度有很大的影响。为考察其影响程度,取6 支10 mL 的容量瓶,依次加入除邻苯二甲醛以外的各种试剂,100 mg/L 的新霉素标准样品溶液100 μL,0.02 mol/L 的巯基乙醇溶液2.5 mL,乳化剂OP-10 溶液1 mL,然后分别加入0.5、1.0、1.5、2.0、2.5 和3.0 mL 的13.4 mg/L 的邻苯二甲醛溶液。用超纯水定容,反应90 min 后,检测其荧光强度。在同等浓度下,荧光强度最大的为最佳。如图5 所示,邻苯二甲醛的加入量为1.5 mL 的时候,荧光强度达到最大值。因此在本次实验中,邻苯二甲醛的最佳加入量为1.5 mL。
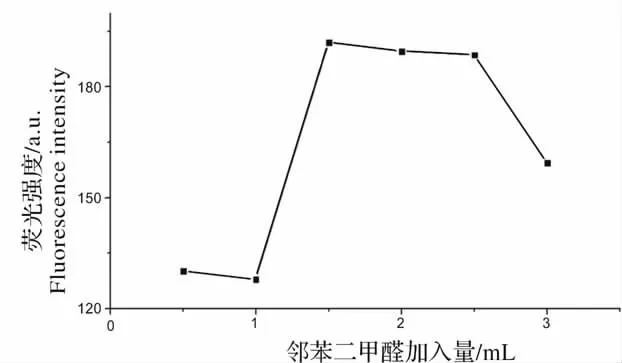
图5 邻苯二甲醛对荧光强度的影响Fig.5 Effect of OPA on fluorescence intensity
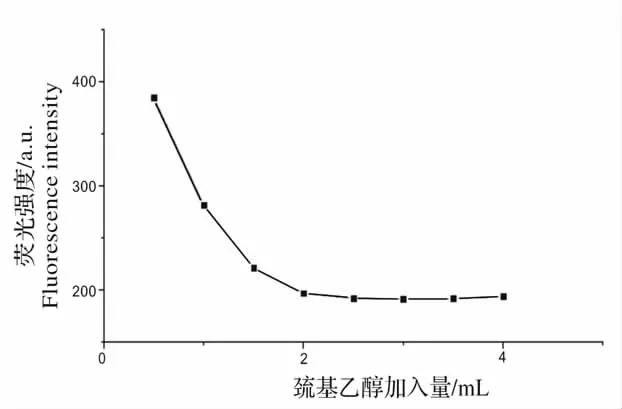
图7 巯基乙醇对荧光强度的影响Fig.7 Effect of thioglycol on fluorescence intensity

图6 乳化剂OP-10 对荧光强度的影响Fig.6 Effect of Emulsifier OP-10 on fluorescence intensity

图8 反应时间对荧光强度的影响Fig.8 Effect of reaction time on fluorescence intensity
2.4 乳化剂OP-10 对荧光强度的影响
乳化剂OP-10 的存在可以减少荧光分子之间的相互碰撞,抑制其猝灭[20]。取4 支10 mL 容量瓶,依次加入100 mg/L 的新霉素标准品溶液100 μL,0.02 mol/L 的巯基乙醇溶液2.5 mL,13.4 mg/L 的邻苯二甲醛溶液1.5 mL,然后分别加入0.5、1.0、1.5 和2.0 mL 的乳化剂OP-10溶液。用超纯水定容,反应90 min 后,测其荧光强度,取荧光强度最大的为最佳条件。如图6 所示,当加入1 mL 乳化剂OP-10溶液后,荧光强度处于最大值,因此在实验中乳化剂OP-10 溶液的加入量为1 mL。
2.5 巯基乙醇的浓度对荧光强度的影响
巯基乙醇的浓度对NEO 和邻苯二甲醛反应物的稳定性有很大的影响。取8 支10 mL 容量瓶,依次加入100 mg/L 的新霉素标准样品溶液100 μL,13.4 mg/L 的邻苯二甲醛溶液1.5 mL,乳化剂OP-10溶液1 mL,然后分别加入0.5、1.0、1.5、2.0、2.5、3.0、3.5 和4.0 mL 的0.02 mol/L 的巯基乙醇溶液。用超纯水定容,反应90 min 后,检测其荧光强度。当荧光强度趋于稳定的时候,实验条件为最佳。如图7 所示,加入巯基乙醇溶液后,荧光强度明显降低了,呈下降趋势,在加入量为2.5 mL 时达到稳定,因此在实验中,巯基乙醇溶液的取量为2.5 mL。
2.6 反应时间对荧光强度的影响
取1 支10 mL 的容量瓶,依次加入100 mg/L 的新霉素标准品溶液100 μL,13.4 mg/L 的邻苯二甲醛溶液1.5 mL,乳化剂OP-10 溶液1 mL,0.02 mol/L 的巯基乙醇溶液2.5 mL。用超纯水定容,反应10 min,检测其荧光强度,每隔10 min 对该样品检测一次,取荧光强度最大的反应时间为最佳反应时间。如图8 所示,在反应时间为90 min 的时候,荧光强度达到最大值,因此在本次实验中,样品的反应时间取90 min。
2.7 工作曲线、检测限、精密度
按照最佳的条件检测NEO 标准样品溶液。如图9 所示,随着新霉素标准品浓度的增大,荧光强度增强,并且呈良好的线性关系,得到工作曲线为:F =45.3C +9.7(R =0.984 9),线性范围为1.00 ~8.00 μg/mL,检测限为1.0 μg/mL。配制10 份同一浓度的NEO 标准溶液,按照最佳条件进行平行测定,其RSD 为1.31%。

图9 新霉素标准品曲线Fig.9 The curve of neomycin standard

图10 真实值与预测值的关系图Fig.10 The diagram of true value and predictive value
2.8 实际样品测定结果和加标回收率
根据1.2 处理鸭肉样品,对含有不同浓度新霉素残留的鸭肉提取液进行检测。鸭肉提取液中新霉素含量的真实值和预测值的关系如图10 所示,其横坐标是鸭肉提取液中新霉素含量的真实的浓度,纵坐标是鸭肉提取液中新霉素含量的预测的浓度。在浓度为1.00 ~8.00 μg/mL 范围内,真实值和预测值之间的关系方程为:y=0.976 9x+0.068 9,相关系数为0.999 8。实验证明,该方法可以用于鸭肉中新霉素残留的检测,且效果较好。鸭肉提取液的模型是由残留量的真实值和预测值所建立的,并且建立模型的样品数相对较少;而新霉素标准样品的模型是由荧光强度值和相对应的浓度值建立的。所以和新霉素标准样品的模型相比,鸭肉提取液的效果更佳,这进一步说明了该方法是正确可靠的。
取市售鸭肉样品,按实验方法1.2 制备样品,检测样品后未发现NEO 残留。对样品进行8 个浓度水平的加标回收率测定,结果如表1 所示,回收较完全,该方法是准确可靠的。

表1 加标样品回收率Tab.1 Recoveries of spiked sample %
3 结论
通过对新霉素标准品溶液和鸭肉提取液中新霉素残留的荧光光谱进行实验研究,得出新霉素最佳的激发波长为340 nm 和发射波长为445 nm;对新霉素溶液发射荧光光谱的实验原理及检测新霉素溶液荧光强度的最佳实验条件进行了分析研究,结果表明,当加入1.5 mL 邻苯二甲醛溶液,1 mL乳化剂OP-10 溶液和2.5 mL 巯基乙醇溶液,并且反应90 min 后,荧光强度达到最佳;发现发射波长在400 ~500 nm 范围内,含有新霉素残留的鸭肉提取液比空白鸭肉提取液有明显的变化,且在浓度为1.00~8.00 μg/mL 范围内,荧光强度随新霉素残留量的增大而增强,得到线性相关系数为0.984 9;对含不同浓度新霉素的鸭肉提取液进行检测,得到加标回收率的平均值为99.69%,检测限为1.00 μg/mL,达到了欧盟规定的食品生产用肌肉中新霉素的残留限量。本实验利用荧光法来检测鸭肉中新霉素的残留具有便捷、灵敏性好的特点,该方法可为进一步研究氨基糖苷类抗生素在动物源食品中残留的检测提供帮助。
[1]欧盟食品中农兽药残留限量标准.兽药残留限量查询[EB/OL].2010 -08 -01.
[2]农业部畜牧兽医局.动物源食品中新霉素残留检测方法—微生物学检测法[J].中国兽药杂志,2002,36(11):11-12.
[3]王苏华,周杨.鸡蛋中新霉素残留的微生物学检测方法[J].中国兽药杂志,2003,37(2):16 -19.
[4]曹雨辰,田淑琴,韦田,等.微生物法检测成都地区动物源性食品的新霉素残留[J].西南民族学院学报:自然科学版,2005,31(2):244 -248.
[5]陈蓉,付丽娟.HPLC 法柱前衍生法测定复方新霉素滴耳液中新霉素的含量[J].中国药品标准,2004,5(3):48 -50.
[6]宋洁,王伟利,姜兰,等.柱前衍生HPLC 法检测罗非鱼肌肉中的硫酸新霉素[J].广东农业科学,2011,38(3):142-147.
[7]商艳红,陈义强,吴小平,等.鸡组织中新霉素残留的ELISA 检测方法的研究[J].中国兽医杂志,2007,43(7):90-91.
[8]刘沙洲,桑小雪,欧阳华学,等.新霉素ELISA 检测方法的建立[J].食品科学,2011,32(14):227-231.
[9]赖晓欣,梁纯光,韩德忠.分光光度法测定硫酸新霉素滴眼液含量[J].江西中医学院学报,1998,10(4):182 -182.
[10]柳玲宝,屠一峰.荧光广度法测定抗生素氧氟沙星[J].苏州大学学报:自然科学版,2000(2):800 -802.
[11]高红,赵一兵,郭祥群.一种测定四环素类抗生素的光谱新方法[J].光谱学与光谱分析,2006,26(3):488 -490.
[12]倪永年,葛成相.多元校正分光光度法同时间测定兔血清中内的β-内酰胺类抗生素[J].光谱学与光谱分析,2007,27(2):355 -359.
[13]官斌,袁东星.牛奶样品中新霉素残留量的离子色谱法测定[J].分析试验室,2007,26(7):1 -4.
[14]刘颖,冯金朝,李丹,等.自组装成环荧光显微成像技术在抗生素残留量检测中的应用[J].光谱学与光谱分析,2009,29(8):2217 -2221.
[15]刘颖,杨乐.镁敏化美他环素荧光显微成像技术应用于北京市密云县养殖场生鲜乳抗生素残留量的检测[J].光谱学与光谱分析,2010,30(5):1279 -1283.
[16]温利锋,马天仲,荣举,等.一种简便的绿色荧光蛋白和新霉素抗性质粒转染细胞后克隆筛选方法[J].汕头大学医学院学报,2011,24(2):110 -115.
[17]刘保生,闫潇娜,种宝红,等.利用铕(Ⅲ)-诺氟沙星-十二烷基硫酸钠的光致发光及稀土敏化荧光法测定硫酸新霉素的浓度[J].发光学报,2012,33(4):453 -457.
[18]王良,闫永胜,李华明,等.TCS-Fe(Ⅲ)体系离子液体气浮浮选荧光光谱法分离/富集四环素类抗生素残留的研究[J].光谱学与光谱分析,2010,30(2):391 -394.
[19]李锋,邱小明,石贤爱,等.OPA 柱前衍生法测定硫酸新霉素的含量[J]. 福州大学学报:自然科学版,2007,35(1):130 -132.
[20]梁榕源,林竹光,苏兴平,等. 乳化剂OP/水-氯化银体系光散射光谱应用研究[J]. 福州大学学报:自然科学版,1999,27(Z1):142 -143.

