CYP3A4高表达肝细胞株建立及其对三氯乙烯毒性的影响
毛侃琅,徐新云,何晓阳,毛吉炎,张 然,谢 杏,秦逍云
(1.深圳市疾病预防控制中心卫生毒理学重点实验室/深圳市现代毒理学重点实验室,广东 深圳 518055;2.深圳大学生命科学学院细胞生物学实验室/深圳市海洋生物资源与生态环境重点实验室,广东 深圳 518060)
工业上三氯乙烯常用于金属的脱脂剂和脂肪、油及石蜡等的萃取剂,也用于冷冻剂、杀菌剂及衣服干洗剂等。近年来三氯乙烯引起部分接触者严重的皮肤和肝损害甚至死亡的报道日益增多[1-3]。三氯乙烯接触者的发病存在明显的个体差异,这可能与不同个体通过肝代谢三氯乙烯后的产物不同有关。细胞色素P450酶(cytochro me P450,CYP)是一类重要的肝氧化代谢酶,很多药物、环境毒物和职业毒物等都是通过CYP进行代谢。其中CYP3 A4占总CYP酶的30%~40%,参与多种环境污染物和药物的代谢过程[4-5]。本实验室在前期研究中发现,三氯乙烯可引起CYP3A4表达明显改变,CYP3 A4可能在三氯乙烯代谢中起重要作用[3]。因此,本实验通过慢病毒载体技术构建CYP3 A4高表达肝细胞株,并观察其对三氯乙烯毒性的影响。
1 材料与方法
1.1 试剂、质粒和细胞
限制性内切酶XmaⅠ和T4 DNA连接酶,购自美国Fer mentas公司;DNA胶回收试剂盒和RNeasy Mini试剂盒,购自德国Qiagen公司;Premix Pri me STAR HS、Ex Taq酶、Pri meScript RT试剂盒,SYBR Pri mescript RT-PCR试剂盒和核酸共沉剂,购自大连Ta Ka Ra公司;p GM-T载体和Top10感受态细菌,购自北京天根公司;质粒小量提取和无内毒素质粒小量提取试剂盒,购自美国OMEGA Bio-Tek公司;p LVX-ac GFP1-C1质粒(以下简称p LVX载体)和该质粒对应的慢病毒包装试剂盒,购自美国Clontech公司;用于慢病毒包装的293FT细胞,购自美国Invitr ogen公司;RPMI1640培养基和10%胎牛血清,购自美国Gibco公司;正常人L02肝细胞,购自中国上海细胞库。CYP3 A4一抗购于美国Santa Cruz公司,兔抗小鼠二抗购于美国Ther mo Scientific公司。
1.2 CYP3A4 c DNA的扩增及其TA克隆载体构建
根据Gen Bank的CYP3 A4基因序列对所需引物进行设计,正向:CATCCCAGACTT-3′, 反 向:按照Premix Pri meSTAR HS的使用说明配置反应体系,以带CYP3 A4基因的p Fast Bac-3 A4载体为模板进行PCR,退火温度为62℃。PCR完成后进行琼脂糖凝胶电泳鉴定,然后用DNA胶回收试剂盒回收PCR产物,并再用Ex Taq酶进行加A尾反应。按照p GM-T载体的说明书,将加A尾产物与p GM-T载体连接,转化Top10感受态细菌。常规筛选鉴定,挑取小量培养的PCR鉴定阳性克隆的细菌菌液,由上海生工测序。
1.3 慢病毒载体构建与包装
挑取测序正确的重组T载体,先进行XmaⅠ酶切,用核酸共沉剂回收酶切产物后,再用XhoⅠ酶切。电泳鉴定后,用DNA胶回收试剂盒回收第二步的酶切产物,然后将其与经过相同处理的p LVX载体连接,转化Top10感受态细菌。小量培养筛选出来的细菌,提取重组质粒进行PCR鉴定,并将菌液送至上海生工测序。挑取测序正确的重组p LVX载体,用p LVX载体对应的慢病毒包装试剂盒将p LVX载体和包装载体共转染到293FT细胞中,37℃,5%CO2培养48 h后将上清培养基用0.45 μm滤膜过滤,收集病毒上清,用慢病毒包装试剂盒内的Lenti-X GoStix金标试纸条对病毒的滴度进行测定,试纸条的C条带和T条带均出现,说明病毒滴度>5×109IFU·L-1,足够感染L02细胞。该病毒上清用于转染L02肝细胞。
1.4 慢病毒转染L02肝细胞
将L02细胞(约4×105个)接种于25 c m2的细胞培养瓶中,18 h后细胞融合度达到50%左右,取病毒上清2.5 ml,加入RPMI1640完全培养基2.5 ml(按1∶1稀释),再加入聚凝胶至终浓度6~10 mg·L-1。去除培养瓶中的完全培养基,用PBS洗2次后加入上述含慢病毒的RPMI1640完全培养基。转染24 h,去除含慢病毒的RPMI1640完全培养基,加入正常的RPMI1640完全培养基再培养24 h,用嘌罗霉素0.5 mg·L-1对细胞进行筛选,筛选时间为7 d。细胞培养条件是37℃,5%CO2,每2 d更换培养基。连续培养该细胞株20代再进行PCR和Wester n蛋白质印迹鉴定,细胞仍然稳定表达即作为CYP3 A4高表达肝细胞株。
1.5 CYP3A4高表达肝细胞株的鉴定
1.5.1 荧光定量PCR检测CYP3A4基因mRNA
分别接种正常L02细胞和1.4所述重组慢病毒转染并经嘌罗霉素7d处理后的存活细胞至6孔板(约1×105个),培养细胞约20 h至融合度80%。按照产品指南,用RNeasy Mini试剂盒提取细胞总RNA,用Pri meScript RT试剂盒将总RNA逆转录为c DNA。分别取正常细胞和高表达肝细胞的c DNA各1μl为模板进行荧光定量PCR,检测CYP3 A4基因的表达量变化。以2-ΔΔCt表示目的基因的相对表达水平。
1.5.2 Wester n蛋白质印迹法检测CYP3A4蛋白表达量
将正常L02细胞、CYP3 A4高表达肝细胞分别接种到两个25 c m2的细胞培养瓶中(约1×106个)。培养约20 h,待细胞融合度达90%后去除培养基,吸弃细胞培养液,用冷PBS洗3次,加入细胞裂解液200μl,在冰上孵育3 min后用细胞刮将细胞快速刮下,收集到500μl管中,然后置于冰上继续裂解20 min,16 000×g,4℃离心30 min,取上清,用BCA法测定蛋白质浓度,蛋白质上样量30μg,最后加入5×SDS-PAGE 上样缓冲液,100℃变性5 min。样品随后进行10%SDS-PAGE电泳分离,接着将蛋白电转至PVDF膜上,5%脱脂奶粉(TBST溶解)室温封闭2 h。根据标志物和相对分子质量将膜上含GAPDH(37 ku)、CYP3 A4蛋白(58 ku)的部分分别切下,加入 CYP3A4一抗(1∶200),室温孵育过夜。第2天用TBST洗膜3次(每次10 min),再加入兔抗小鼠二抗(1∶3000),室温孵育1 h,TBST洗膜3次(每次10 min)后,加入Western蛋白质印迹实验化学发光试剂光后用GE冷CCD成像系统对其进行曝光拍照,所得图像用ImageJ软件进行条带灰度定量分析。以GAPDH为内参,计算目的蛋白的相对表达量。
1.6 三氯乙烯处理CYP3A4高表达肝细胞
将正常L02肝细胞和CYP3A4高表达肝细胞分别接种到6孔板上,待细胞融合度达80%进行三氯乙烯染毒。三氯乙烯染毒浓度分别为0(溶剂对照),0.25,0.5,1.0,2.0和4.0 mmol·L-1。染毒12 h,将6孔板中的染毒液去除干净,用PBS清洗细胞2次。提取细胞总RNA,用分光光度计(A260nm/A280nm)测定RNA浓度,逆转录后进行荧光定量PCR。
1.7 实时荧光定量PCR检测CYP3A4高表达肝细胞中各凋亡基因和癌基因mRNA表达水平
提取1.6所述细胞总RNA,按照Ta Ka Ra的Pri me ScriptTMRT试剂盒配制逆转录反应体系20μl:5×Pri meScript®缓冲液4μl,Pri meScript®RT Enzy me Mix I 1.0μl,1.0μl Oligo d T 引物50μmol·L-1,Rando m 6 mers(100μmol·L-1)1.0μl,总RNA 1μg,加水至20μl。37℃15 min,85℃5 s,4℃10 min,进行逆转录。-20℃冰箱保存逆转录样品。
基因的PCR引物由Ta Ka Ra生物公司合成(表1)。实时荧光定量PCR反应按照试剂盒说明书配制PCR反应体系20μl:SYBR®Pre mix Ex Taq T M (2×)10μl,PCR引物(10μmol·L-1)0.4μl,ROX Reference Dye(50×)0.4μl,c DNA 模板 1 μl,d H2O 7.8μl。凋亡基因(bcl-2,胱天蛋白酶3,胱天蛋白酶8和胱天蛋白酶9)实时荧光定量PCR反应条件如下:95℃预变性5 s,1个循环;接着95℃变性5 s,58℃退火延伸30 s,共40个循环;癌基因(c-fos、c-myc、k-ras和 p53)的 PCR 反应条件为:95℃预变性5 s,1个循环;接着95℃变性5 s,54℃退火延伸30 s,共40个循环。

Tab.1 RT fluorescent quantitative PCR pri mers of target genes
以GAPDH的Ct值为内参,目的基因Ct值采用2-△△Ct法计算各基因的相对表达量,此步骤由ABI 7900 HT分析软件自动计算并直接给出结果。
1.8 统计学分析
2 结果
2.1 CYP3A4慢病毒重组载体构建与病毒包装鉴定
应用琼脂糖凝胶电泳分析CYP3A4基因的PCR扩增产物,可见非常明显条带,大小约1500 bp,与预期相符。将含PCR产物的重组p GMT载体经上海生工测序,与Gen Bank上该基因的序列完全相符。将该片段从T载体上切下,与p LVX载体连接后进行测序,也与预期完全相符。
2.2 CYP3A4高表达肝细胞株中CYP3A4基因的表达
将正常L02细胞的CYP3 A4基因表达量作为对照,数值设为1,CYP3 A4高表达肝细胞的CYP3 A4基因表达量比正常L02细胞提高94倍。
2.3 CYP3A4高表达肝细胞株中的CYP3A4蛋白表达水平
以GAPDH蛋白为内参,检测正常L02细胞和CYP3 A4高表达肝细胞CYP3A4蛋白表达水平,经归一化处理后的灰度分析结果显示(图1),高表达肝细胞CYP3 A4蛋白含量是正常L02肝细胞的2.36倍。
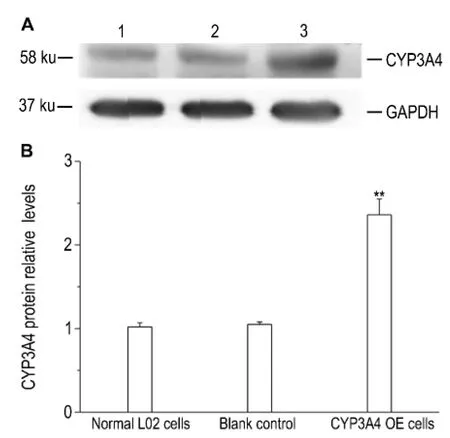
Fig.1 CYP3A4 protein expression in CYP3A4 overexpressed hepatocytes detected by Wester n blotting.Lane 1:L02 cells;lane 2:blank control;lane 3:CYP3 A4 overexpressed hepatocytes.±s,n=3.**P<0.01,co mpared wit h nor mal L02 cells.
2.4 三氯乙烯对CYP3A4高表达肝细胞中凋亡基因mRNA表达的影响
如图2所示,与正常L02细胞相比,三氯乙烯0.25和0.5 mmol·L-1使CYP3 A4高表达肝细胞中的bcl-2 mRNA表达水平明显升高(P<0.01),但随着三氯乙烯剂量的升高与正常细胞无明显差异。与正常肝细胞相比,三氯乙烯0.5,1.0,2.0和4.0 mmol·L-1使CYP3 A4高表达肝细胞中胱天蛋白酶3、胱天蛋白酶8和胱天蛋白酶9的mRNA表达 都 显 著 升 高 (P<0.05), 但 三 氯 乙 烯0.25 mmol·L-1虽使胱天蛋白酶3、胱天蛋白酶8和胱天蛋白酶9的mRNA的表达有所升高,但与正常对照组无显著差异。
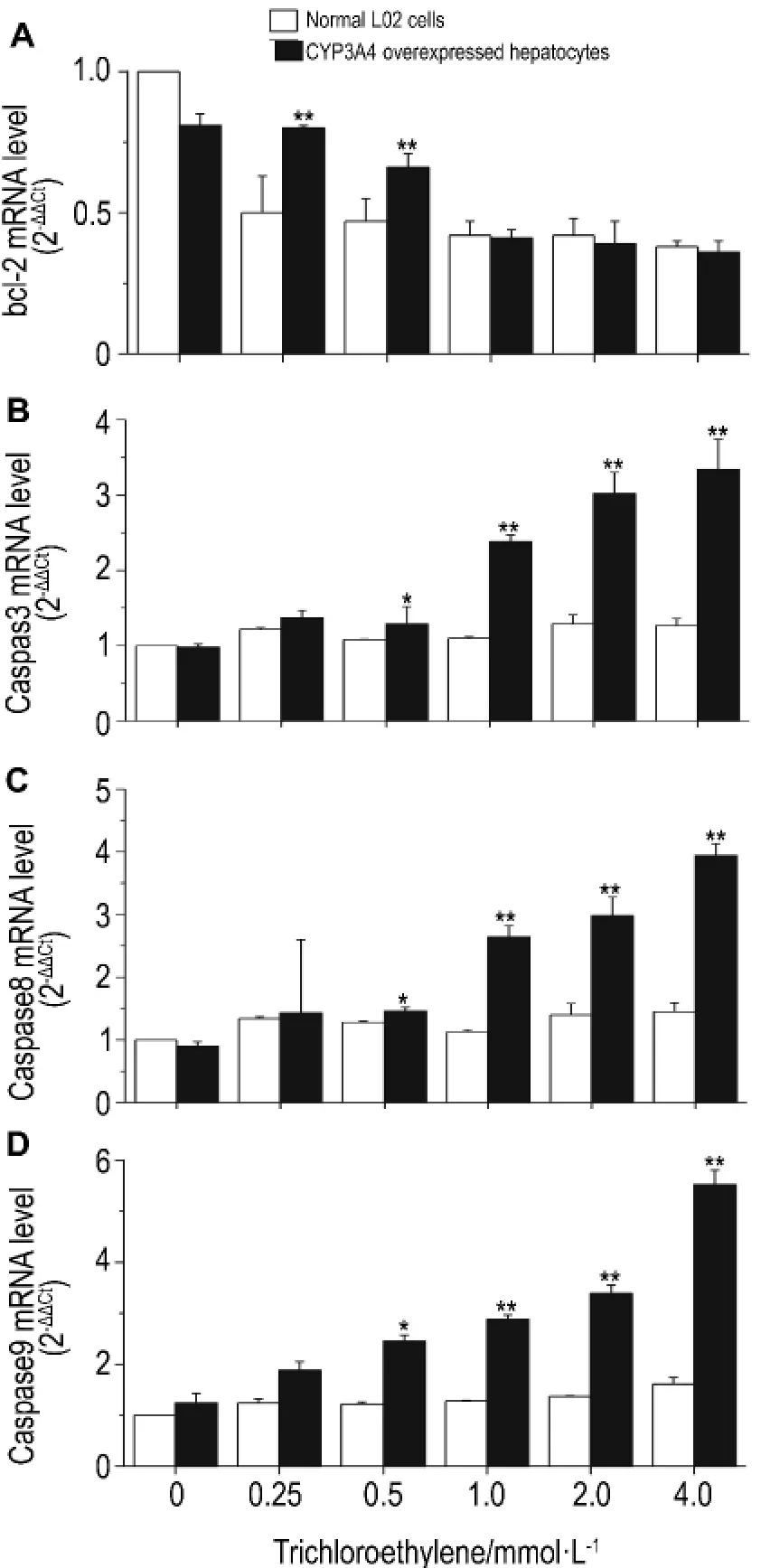
Fig.2 Effect of trichloroethylene on apoptosis gene expression in CYP3A4 overexpressed hepatocytes.The cells were treated wit h TCE f or 12 h.±s,n=3.*P<0.05,**P<0.01,co mpared wit h nor mal L02 cells at t he sa me trichloroet hylene concentration.
2.5 三氯乙烯对CYP3A4高表达肝细胞癌基因mRNA表达的影响
与凋亡基因转录水平变化类似,三氯乙烯对CYP3 A4高表达肝细胞的癌基因转录亦产生明显影响。与正常肝细胞相比,三氯乙烯0.25,0.5,1.0,2.0和4.0 mmol·L-1使k-ras基因 mRNA 表达明显升高(P<0.05),p53 mRNA 表达明显下降(P<0.05);三氯乙烯0.5,1.0,2.0和4.0 mmol·L-1使CYP3 A4高表达肝细胞中的c-f os和c-myc基因的mRNA表达明显升高(P<0.05),但三氯乙烯0.25 mmol·L-1处理无显著变化(图3)。
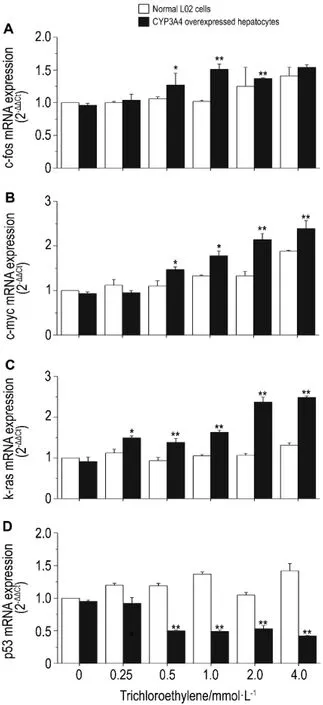
Fig.3 Effect of trichloroethylene on oncogene expression in CYP3A4 overexpressed hepatocytes.See Fig.2 f or cells treatment.±s,n=3.*P<0.05,**P<0.01,co mpared wit h nor mal L02 cells at t he sa me trichlor oet hylene concentration.
3 讨论
本实验的实时荧光定量PCR和Wester n蛋白质印迹结果表明,CYP3 A4高表达载体构建非常成功,可以应用到三氯乙烯毒性研究中。
本实验结果显示,CYP3 A4高表达肝细胞中抗凋亡基因bcl-2的表达水平随三氯乙烯浓度增加而降低,胱天蛋白酶3,胱天蛋白酶8和胱天蛋白酶9基因表达水平则随三氯乙烯浓度增加而升高。bcl-2在细胞凋亡的调控中起重要作用,其表达可以起到抑制细胞凋亡的作用,从而使细胞的存活率提高,因此,bcl-2基因表达水平下降预示着细胞凋亡水平的增高。本研究结果显示,当三氯乙烯染毒剂量增至中等剂量以上时,CYP3 A4高表达肝细胞和正常肝细胞bcl-2表达水平基本接近,而CYP3 A4高表达肝细胞胱天蛋白酶3、胱天蛋白酶8和胱天蛋白酶9的mRNA表达水平显著高于正常肝细胞,说明低剂量三氯乙烯可以促进CYP3 A4高表达肝细胞中的抗凋亡基因bcl-2表达,而高剂量时主要是促进胱天蛋白酶3,胱天蛋白酶8和胱天蛋白酶9基因的表达,推测其原因可能是三氯乙烯在CYP3 A4高表达肝细胞中具有促进凋亡基因活化的作用。胱天蛋白酶是一组在凋亡中发挥起始和执行作用的蛋白[6],其中胱天蛋白酶3是最重要的凋亡执行者之一,是凋亡的主要效应因子,其活化意味着凋亡进入不可逆阶段[7]。胱天蛋白酶8和胱天蛋白酶9则是凋亡的启动因子,在自我活化后能激活凋亡执行。因此,4种凋亡基因表达水平的变化表明,三氯乙烯染毒对CYP3 A4高表达肝细胞凋亡基因有明显影响,并且与正常肝细胞相比,三氯乙烯引起对CYP3 A4高表达肝细胞的细胞凋亡有明显促进作用,是三氯乙烯在肝细胞代谢中的重要因素之一。
三氯乙烯染毒CYP3 A4高表达肝细胞后癌基因c-f os,c-myc和k-ras表达水平随三氯乙烯浓度增加而升高,p53表达水平随三氯乙烯浓度增加而降低。c-fos,c-myc和k-ras基因均为编码关键性调控蛋白的正常细胞基因,c-myc和c-fos参与了胞外生长信号转导至基因水平的过程,在调控细胞分裂的过程中是否从G0期转向G1期中起重要作用[8];而kras则作为一个“分子开关”起作用[9],一旦其处于“开启”状态,就会招募并激活传播生长因子和其他受体信号所必需的蛋白。当受到理化等因素作用而活化时,这些基因表达异常,可导致细胞的增殖、分化或癌变,k-ras属于原癌基因。p53基因的主要功能是维持细胞基因组的稳定,是一种抑癌基因。
目前,动物实验已经证明三氯乙烯具有致癌性[10-12],由于当时人群流行病学资料不足,国际癌症研究机构(IARC)于1995年将三氯乙烯定为“对人类可能致癌物”[13]。2011年9月,IARC在进行了充分的资料收集,之后美国环保署发布了针对三氯乙烯的最终健康风险评估报告,将其确认为致癌物质,并且还指出了其对人类的中枢神经系统、肾、肝、男性生殖系统以及胎儿发育都有一定的危害[14]。本实验结果显示,三氯乙烯具有明显的促进癌基因表达的生物学作用,而且CYP3 A4高表达肝细胞比正常肝细胞的癌基因表达水平更高,提示三氯乙烯可能经过肝代谢酶活化,增加了三氯乙烯对癌基因的活化水平,为深入研究三氯乙烯的致癌作用提供了理论依据。
[1]Xu XY,Wu PQ,Ke YB,Zhou L,He C,Yuan JH,et al.Oxidative stress and inducible nitric oxide synt hase expression in hu man hepatocytes treated wit h trichlor oet hylene[J].Toxicol Envir on Chem,2010,92(4):801-811.
[2]Xu X,Yang R,Wu N,Zhong P,Ke Y,Zhou L,et al.Severe hypersensitivity der matitis and liver dysf unction induced by occupational exposure to trichloroethylene[J].Ind Health,2009,47(2):107-112.
[3]Xu XY,Liu YF,Ke YB,Mao JY,Yuan JH,Zhou L,et al.mRNA Expression of hepatic metabolic enzy me genes and apoptosis genes in L02 cells treated wit h trichloroet hylene[J].Carcinog Terat og Mutag(癌变.畸变.突变),2011,23(5):349-352.
[4]Jiang M,Xiong YQ.The cytochr o me P450 3 A4 and dr ug metabolis m[J].Pract Clin Med(实用临床医学),2006,7(11):199-201,204.
[5]Rendic S.Summary of inf or mation on hu man CYP enzy mes:hu man P450 metabolis m data[J].Dr ug Metab Rev,2002,34(1-2):83-448.
[6]Fulda S.Caspase-8 in cancer biology and t herapy[J].Cancer Lett,2009,281(2):128-133.
[7]Sharifi A M,Esla mi H,Larijani B,Davoodi J.Involvement of caspase-8,-9,and-3 in high gl ucose-induced apoptosis in PC12 cells[J].Neur osci Lett,2009,459(2):47-51.
[8]Vamvakas S,Bittner D,Köster U.Enhanced expression of t he pr ot ooncogenes c-myc and c-f os in nor mal and malignant renal growt h[J].Toxicol Lett,1993,67(1-3):161-172.
[9]Friday BB,Adjei AA.K-ras As a target f or cancer therapy[J].Biochi m Biophys Acta,2005,1756(2):127-144.
[10]Elfarra AA,Krause RJ,Last AR,Lash LH,Par ker JC.Species-and sex-related differences in metabolis m of trichlor oet hylene to yield chloral and trichloroet hanol in mouse,rat,and hu man liver microso mes[J].Dr ug Metab Dispos,1998,26(8):779-785.
[11]Brüning T,Bolt H M.Renal t oxicity and carcinogenicity oftrichloroet hylene:key results,mechanis ms,and controversies[J].Crit Rev Toxicol,2000,30(3):253-285.
[12]Bull RJ.Mode of action of liver tu mor induction by trichlor oet hylene and its metabolites,trichlor oacetate and dichlor oacetate[J].Environ Health Perspect,2000,108(Suppl 2):241-259.
[13]Stewart BW.Trichlor oet hylene and cancer:a carcinogen on trial[J].Med J Aust,2001,174(5):244-247.
[14]USEPA.EPA Releases Final Healt h Assessment f or TCE[OE/BL]. (2011-09-28) htt p://www.yose mite.epa.gov/opa/ad mpress.nsf/03dd877d6f1726c28525735900404443/b8d0e4d8489ad991852579190058d6c3

