重金属盐溶解-沉淀反应的吉布斯自由能变的定量估算
郭亚平,谢练武
(中南林业科技大学,湖南 长沙 410004)
目前已开发应用的重金属污染废水处理方法主要有物理法[1]、化学法[2]和生物法[3],其中90%以上使用化学方法,主要包括:化学沉淀法[4-5]、膜分离法[6]、离子交换法[7]、电解法[8]、吸附法[9-10]等. 吸附法处理金属离子的吸附理论研究较为全面,很多研究涉及了吉布斯自由能变(ΔG)的计算[11-13],有研究者认为应该采用ΔG而不是标准吉布斯自由能变(ΔG⊖)来判断吸附反应的自发性[14-15]. 化学沉淀法是先后向重金属废水中加入碱、硫化物或铁盐[16-18],分别与重金属离子形成难溶重金属氢氧化物、硫化物或铁氧体复合晶粒而达到去除重金属的目的. 化学沉淀法具有成本低、操作简便等优点,但对废水化学组成要了解全面,防止生成的沉淀再次溶解,所以掌握沉淀溶解平衡显得尤为重要. 目前,对重金属沉淀-溶解反应中ΔG计算的研究很少. 测定重金属沉淀-溶解反应的ΔG不仅具有理论意义,而且具有实用价值. 通过计算ΔG可以描述反应的特性,了解沉淀-溶解反应中诸多影响因素中的决定性因素,从化学热力学的角度,为重金属污染处理中化学沉淀处理的可行性提供理论指导.
1 理论部分
一般地,对难溶盐AmBn在纯水中有以下沉淀-溶解平衡:

(1)
根据化学热力学有:ΔG=Q0(μQ-μQ0)
(2)
式中Q0为难溶盐的起始表观浓度,Q为反应体系中难溶盐的表观浓度,μ为化学势. 而组分i的化学势μi与其活度ai有关,关系式为:
(3)


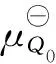
ΔG=Q0RTln(Qe/Q0)
(4)
Δμ=RTln(Qe/Q0)
(5)
当给定Q0值时,Qe可通过测定溶解出的阴阳离子的浓度而求算,由此可见,式(4)和式(5)在测定反应的ΔG和Δμ时具有现实应用价值. ΔG和Δμ可简单地通过反应物的浓度变化而求得.
2 实验部分
2.1 仪器与试剂
实验中采用乙炔火焰原子吸收光谱仪测定重金属离子的浓度. 为使难溶盐充分溶解使用了超声波和恒温振荡仪. 绘制标准曲线用的Pb(NO3)2、NiSO4为分析纯,锌粒为基准物质. 选用的3种难溶盐PbI2、NiCO3和ZnCO3均为分析纯. 使用的纯水为新制的二次蒸馏水.
2.2 试样制备
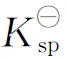
2.3 重金属离子浓度的测定
分别用Pb(NO3)2、NiSO4和锌粒制备5~100mg/L的标准系列溶液,测定吸光度A,确定线性范围并绘制标准曲线,每次测定样品时重新测定标准系列并绘制标准曲线. 然后测定滤液的吸光度A,根据标准曲线求算离子浓度c. 使用空白对照,平行测定3次. 利用Excel软件处理数据并作图分析.
3 结果与讨论
为了尽可能避免其他离子对反应的干扰,直接称量难溶盐溶于水而获得重金属离子沉淀-溶解平衡体系,不使用任何缓冲溶液调整pH. 通过探索性试验发现,难溶盐经过3h的超声破碎,24h的恒温振荡后测定吸光度基本不再改变,说明已经达到沉淀-溶解平衡. 通过测定平衡体系中重金属离子浓度,根据化学计量关系计算对应的阴离子浓度及未溶解难溶盐浓度Qe,将PbI2、NiCO3和ZnCO3的Q0分别对平衡浓度c(Pb2+)、c(Ni2+)和c(Zn2+)与相应的Qe作图,得沉淀-溶解曲线图(图1-3).
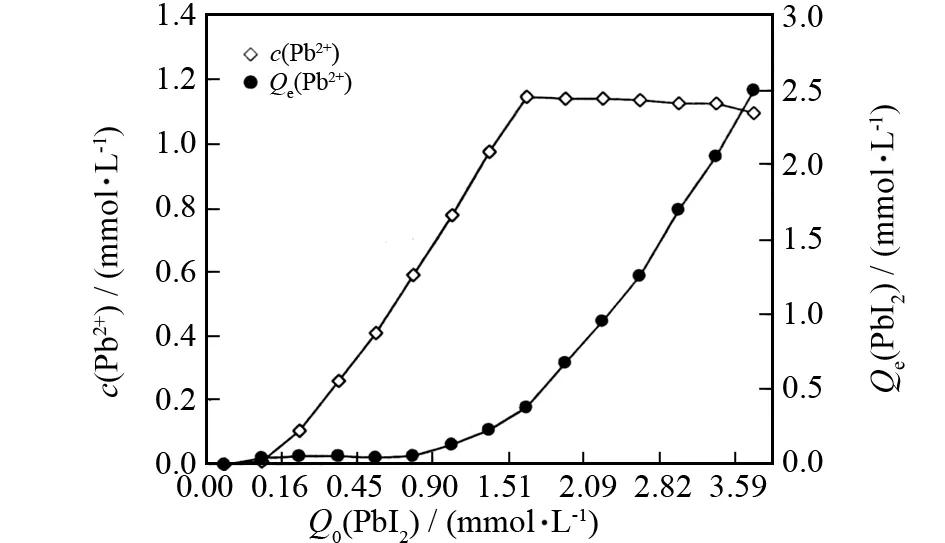
图1 PbI2的沉淀-溶解曲线Fig.1 The profile on the precipitation and dissolution reaction of PbI2

图2 NiCO3的沉淀-溶解曲线Fig.2 The profile on the precipitation and dissolution reaction of NiCO3
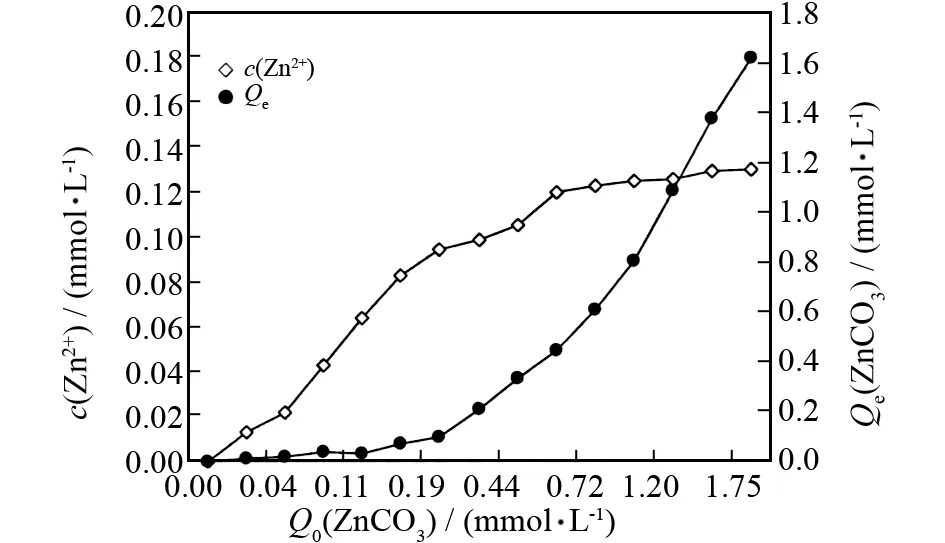
图3 ZnCO3的沉淀-溶解曲线Fig.3 The profile on the precipitation and dissolution reaction of ZnCO3
从图1-3可以看出,对三种难溶盐来说,平衡浓度Qe曲线和离子浓度曲线走势非常类似. 譬如在图1中,当PbI2加入量即Q0小于1.5mmol·L-1时,c(Pb2+)与Q0呈现正相关,似乎接近正比关系,而后随着Q0的增大,c(Pb2+)不再变化,说明这时体系成为过饱和溶液,加入更多的PbI2也不再溶解.NiCO3和ZnCO3的情况与此类似,只是NiCO3的 Q0约小于0.5mmol·L-1时,ZnCO3的Q0约小于0.6mmol·L-1时,对应的c(Ni2+)和c(Zn2+)与其Q0呈现一定的正相关. 另外,三种难溶盐的Qe随Q0的增加,最初变化不明显,呈现一个小平台,说明投加量较小时均能全部溶解;而后出现缓慢爬升,最后急剧增大,说明即使投加量再大,溶解的量也是有限的.

(6)
式中Kf在本文中暂且称为难溶盐的表观平衡常数.
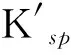
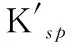
表1 PbI2沉淀-溶解平衡中Kf、ΔG及的变化(25 ℃)Table 1 Variations of Kf, ΔG and in the precipitation and dissolution reaction of PbI2 (25 ℃)
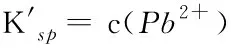
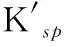
表2 NiCO3沉淀-溶解平衡中Kf、ΔG及的变化(25 ℃)Table 2 Variations of Kf, ΔG and in the precipitation and dissolution reaction of NiCO3 (25 ℃)
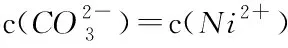
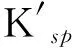
根据式(4),对于某个给定反应,只要知道反应物的始态与终态浓度就可方便地求得该反应的ΔG. 分别将3种难溶盐沉淀溶解反应的ΔG计算后列入表1-3,不难发现,所有数据点的Qe/Q0的比值均小于1,所以ΔG均为负值. 根据热力学定律,如果一个反应的ΔG<0,则能自发进行,3种难溶盐的ΔG均为负值,说明难溶盐在水中的溶解反应是自发的. 另外,从ΔG的变化趋势来说,其绝对值开始与Q0呈正相关,而后趋于最大值,并保持相对稳定. 这是因为,G是系统的状态函数,它的大小与真正参与反应的反应物的物质的量密切相关,参与反应的反应物的物质的量越大,则系统自由能下降得越多.
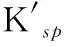
表3 ZnCO3沉淀-溶解平衡中Kf、ΔG及的变化(25 ℃)Table 3 Variations of Kf, ΔG and in the precipitation and dissolution reaction of ZnCO3 (25 ℃)
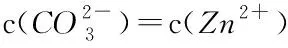
结论:实验结果表明沉淀-溶解反应同样遵守热力学定律,推导出的吉布斯自由能函数可以方便地定量估算该反应体系的ΔG并判别反应的自发性. 应该指出的是,本文出现的自由能变表达式仅仅适用于没有任何缓冲剂或pH调节剂的单个重金属离子体系. 推导公式时没有考虑其他离子的影响,否则不能用浓度代替活度参与计算. 但是我们可以预测,如果讨论的体系是混合离子体系,或者加入了缓冲剂,判断反应能否发生,则需计算整个体系的ΔG,而且反应物对整个体系ΔG的贡献将发生变化.
参考文献:
[1] 王 韬, 李鑫钢, 杜启云. 含重金属离子废水治理技术的研究进展[J]. 化工环保, 2008(4): 323-326.
[2] 刘绍忠. 电化学法处理重金属废水的应用研究[J]. 工业水处理, 2010(2): 86-88.
[3] 沈 杰, 张朝晖, 周晓云, 等. 生物法去除水中重金属离子的研究[J]. 水处理技术, 2005(3): 5-8.
[4] 许根福. 处理高砷浓度工业废水的化学沉淀法[J]. 湿法冶金, 2009(1): 12-17.
[5] 张志军, 李 玲, 朱 宏, 等. 化学沉淀法去除电镀废水中铬的实验研究[J]. 环境科学与技术, 2008(7): 96-97.
[6] 陈红盛, 叶裕才, 白庆中, 等. 聚合物辅助陶瓷膜处理重金属废水[J]. 膜科学与技术, 2005(6): 45-50.
[7] 李春华. 重金属污染控制中的离子交换特点[J]. 水处理技术, 1992(3): 193-198.
[8] 林 丹, 曾光明, 黄瑾辉, 等. 电解法回收胶团强化超滤(MEUF)浓缩液中的Cd2+[J]. 环境科学, 2009(11): 3347-3352.
[9] 赵 芳, 吴晓芙, 张艳丽, 等. 固液相离子吸附体系中吸附剂浓度效应与Langmuir方程的适用性[J]. 环境化学, 2007(3): 335-338.
[10] 黄君涛, 熊 帆, 谢伟立, 等. 吸附法处理重金属废水研究进展[J]. 水处理技术, 2006(2): 9-12.
[11]GHIACIM,KALBASIRJ,KHANIH,etal.Free-energyofadsorptionofacationicsurfactantontoNa-bentonite(Iran):inspectionofadsorptionlayerbyX-rayspectroscopy[J].JChemThermodyn, 2004, 36(8): 707-713.
[12]GUPTASS,BHATTACHARYYAKG.RemovalofCd(II)fromaqueoussolutionbykaolinite,montmorilloniteandtheirpoly(oxozirconium)andtetrabutylammoniumderivatives[J].JHazardMater, 2006, 128(2/3): 247-257.
[13]HAYESMHB,PICKME,TOMSBA.Theinfluenceoforganocationstructureontheadsorptionofmono-andofbipyridiniumcationsbyexpandinglatticeclayminerals:II.AdsorptionbyNa+-vermiculite[J].JColloidInterfSci, 1978, 65(2): 266-275.
[14] CHATTORAJ D K, MAHAPATRA P K, BISWAS S C. A generalized scale for free energy of adsorption from Gibbs adsorption equation[J]. Colloids and Surfaces A: Physicochem Eng Aspects, 1999, 149(1/3): 65-80.
[15] WU Xiao Fu, ZHAO Fang, CHEN Ming Li, et al. A simple way of calculating the change in the Gibbs' free energy of ion adsorption reactions[J]. Adsorpt Sci Technol, 2009, 27(1): 1-17.
[16] 杜 军. 石灰中和法处理含重金属离子废水[J]. 工业水处理, 1987, 7(4): 23-24.
[17] 杨 彤. 化学法处理重金属离子废水的改进[J]. 电镀与精饰, 1999, 21(5): 38-42.
[18] 常军霞, 王三反, 陈 霞. 铁氧体共沉淀法处理含Ni2+废水的研究[J]. 工业水处理, 2011(3): 46-48.

