青岛啤酒酵母与高浓酵母筛选高浓酿造酵母融合亲株100L发酵分析
易庆平,李居宁
(荆楚理工学院生物工程学院,湖北荆门448000)
啤酒质量的关键是发酵菌种,酵母是啤酒的灵魂[1]。酵母菌种的优化、培育、筛选工作都被啤酒生产厂家放在非常重要的位置。选育一株耐高酒精度、耐高糖度、高渗透压,同时分泌良好风味物质的酵母菌是高浓酿造啤酒的核心工作。国外部分研究者利用酵母融合技术选育酿酒菌种,取得了较理想的效果[2]。通过原生质体融合,得到的菌株遗传了亲本的许多优良性状,啤酒酵母原生质体融合菌株在实验室的研究较多[3-9],工业上的应用鲜有报道[9-11]。在啤酒酿造中,菌种代谢产生的酶催化一系列生化反应产生的双乙酰、乙醛和高级醇等物质会影响啤酒口感及质量。本研究以选育优良的啤酒高浓酿造生产菌株为目的,筛选出发酵度较高、双乙酰还原快、凝絮性较好、风味较好的酵母菌株为原生质体融合的亲株,为下一步原生质体融合提供理论依据。
1 材料与方法
1.1 材料与仪器
大米(粳米)、酒花、α-淀粉酶等酶制剂、乳酸、石膏 青岛啤酒五公司;澳大利亚大麦芽、加拿大大麦芽 青岛啤酒麦芽厂;自行研制大麦复合糖浆 大麦70%+玉米25%+5%麦芽,根据青岛啤啤酒酵母菌种库的档案数据,从中挑选S.cerevisiae属中的优质的青岛啤酒酵母和酒精酵母通过糖发酵实验、离子抗性实验、二氧化碳减重实验、供试菌株发酵后风味物质分析及品评,确定以下菌株作为融合亲株,见表1。
751分光光度计 上海分光光度计厂;电子天平、分析天平、制冰机、紫外分光光度计 上海仪器有限公司;啤酒全自动分析仪(Anton Paar)、酸度计、100L发酵罐 哈尔滨汉德酿造设备有限公司;生化培养箱 上海精宏实验设备有限公司。
1.2 主要分析方法
发酵度测定:参考文献[12]的方法;细胞的凝聚性的测定:参考文献[13]的方法;双乙酰含量的测定:参考文献[12]的方法;α-氨基氮的测定[14]:茚三酮法。
1.3 操作要点
1.3.1 糖化工艺 糖化工艺的设计原则在遵循青岛啤酒的生产工艺基础上提高原麦汁浓度到15°P,具体配方及工艺见表2。

表1 供试菌株一览表Table 1 The list of test strains

表2 糖化配方Table 2 Glycosylated formula
1.3.2 糖化工艺 糖化工艺的设计原则遵循青岛啤酒的生产工艺,在此基础上提高原麦汁浓度到15°P,糖化锅中澳大利亚大麦与加拿大大麦1∶1配比,糊化锅中投入25%的粳米,酒花分三次添加,总加入量为0.06%。糖化工艺为:50℃糖化30min,65℃糖化60min,75℃糖化15min,糖化曲线见图1。
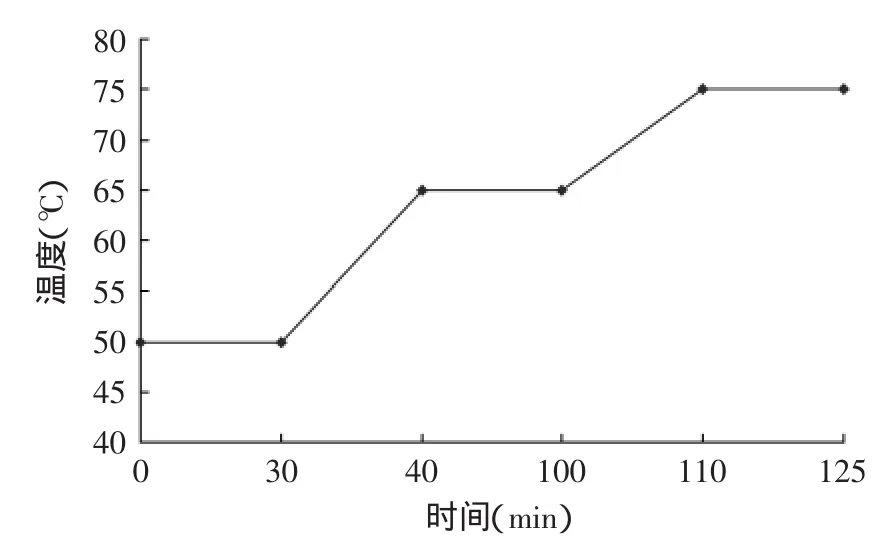
图1 糖化工艺曲线Fig.1 The curve of saccharification process
1.3.4 发酵工艺 麦汁冷却至(8.0±0.5)℃时进罐,满罐后24h内排渣一次;待麦汁自然升温至9.0~9.5℃发酵;发酵待糖度降至4.8~5.2°Bx,升温至12℃,还原双乙酰;继续糖度降至3.8~4.2°Bx,保持罐压0.8~1.0kg/cm2,封罐24~48h回收酵母,以后每2d排一次酵母;双乙酰降至0.05mg/L时降温,温度降至0℃后贮藏7d。
1.4 实验方法
糖化生产15°P麦汁,分别用供试菌株T1、T2、T3、G4、G6扩配后,接入100L发酵罐发酵,每天监测酵母菌数量,连续16d,每天取样测定双乙酰含量,连续14d,发酵完成后测定发酵度,测定pH、总酸、酵母凝聚性、α-氨基氮、α-氨基氮同化率。
2 结果与讨论
2.1 发酵过程酵母数跟踪
近代啤酒生产酵母使用代数低(<5代),为了缩短发酵前期酵母的增殖时间,一般选择繁殖速度较快的菌株。供试菌株发酵过程中酵母数量消长情况见图2。由图2可见,T2和G4大约5d时间达到最大酵母数,但是T2的酵母数只有约45×106个/mL,之后酵母数迅速下降。T1和T3的最大酵母数虽然也只有45×106个/mL,但是它们达到最大酵母数的时间要比T2迟。G6的最大酵母数也好于T1、T2和T3,在第8d达到约50×106个/mL。从图2可以看出,G4菌株高峰期酵母数量明显高、G6菌株次之。

图2 供试菌株发酵过程酵母数变化曲线Fig.2 The variation curves of yeast on fermentation process
2.2 供试菌株发酵实验双乙酰跟踪分析
双乙酰作为啤酒的一种风味物质,其含量多少会影响啤酒的风味与质量。双乙酰适量时将会赋予啤酒特殊风味,但是当啤酒中双乙酰含量超过阈值0.1mg/L时,严重影响啤酒的口感,使啤酒产生一种馊饭味[14]。控制啤酒中的双乙酰含量可以通过选育少生成双乙酰菌株和加速双乙酰的还原两种方式实现。在主发酵过程有双乙酰合成和还原的反应,选育在主酵期双乙酰生成量少、还原速度快的菌株,可加速啤酒成熟、缩短后酵期。由图3可见,G4和G6菌株的双乙酰生成峰值明显低于T1、T2和T3,而还原双乙酰的速度比T1、T2和T3菌株还原速度快。在T1、T2和T3中,T2菌株的双乙酰生成量最多而还原速度最慢。
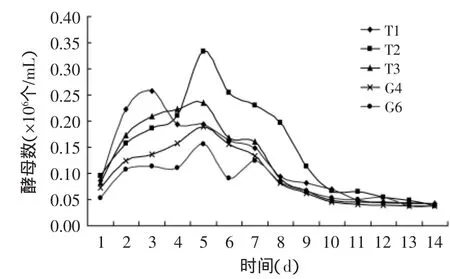
图3 供试菌株发酵实验双乙酰变化曲线Fig.3 The diacetyl curve of fermentation experiment of test strains
2.3 待滤酒发酵度
酵母菌种对糖利用通常用发酵度来衡量。发酵度的高低不但决定残糖含量和酒精度,同时会影响啤酒的口感和保存期。发酵过程中只有控制好发酵度,才能更好地控制影响风味的副产物。麦芽汁浓度相同时,发酵度低,啤酒爽口程度一般、有甜味;发酵度太高,啤酒口感淡薄、回味不够。优良菌株的真正发酵度应达65%~70%[16]。供试菌株发酵度见图4,G4和G6的发酵度在啤酒酵母适宜的发酵度范围内,其值高于T1、T2和T3,且在这些菌种中,T2的发酵度最低。
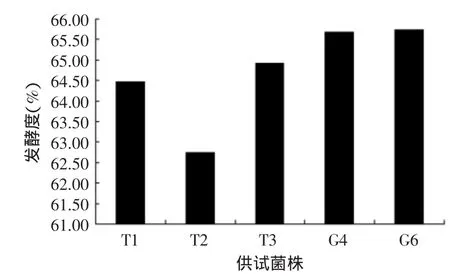
图4 供试菌株发酵实验发酵度比较Fig.4 The degree fermentation of test strains
2.4 供试酵母菌株发酵待滤酒分析
啤酒酵母具有凝聚性的特征,是由酵母凝聚基因和外界条件决定,菌种不同凝絮性差异很大。凝聚性好的酵母,主发酵结束时能迅速沉降在发酵罐底部而便于分离,降低分离酵母能耗,防止酵母长时间悬浮而自溶。酵母菌株凝絮性强可使后续工艺简化、提高酒的清亮度及口感[17]。凝聚性太强的酵母,酵母细胞沉淀快,发酵液中的细胞密度低,发酵慢导致发酵度低;酵母的凝聚性太弱,细胞沉淀慢,发酵液中的细胞密度高,发酵快,发酵度高,但酵母细胞难从酒液中分离。因此要求生产菌株的凝絮性适中,使发酵液既能达到较高的发酵度,菌体又易分离。表3中,T1和T2菌株凝聚性好于T3、G4和G6。五种菌株待滤酒的pH和总酸均在正常范围。
麦汁中α-氨基氮含量过低,必然会导致酵母增殖少,发酵缓慢,双乙酰含量增高,高级醇含量升高等一系列技术质量问题。酵母增殖必须有合成细胞的含氮物质存在。酵母对α-氨基氮同化的量随酵母品种、接种量、麦汁中α-氨基氮的含量及发酵条件不同而有较大差异。α-氨基氮同化快,同化多,则酵母繁殖多,酵母健壮,发酵力强。因此通过测定α-氨基氮的同化率可以间接了解酵母的生长发酵情况。表3表明,G4和G6的α-氨基氮同化率均高于T1、T2和T3,从而使发酵液中双乙酰的生成量要少于T1、T2和T3,这个结果恰好与图3结果相吻合。

表3 供试酵母菌株发酵实验品评结果Table 3 The results of fermentation taste of test strains
3 结论
用青岛啤酒酵母T1、T2、T3和高浓酵母G4、G6进行100L发酵,高浓酵母G4和G6发酵过程中酵母数变化、双乙酰变化、发酵度和α-氨基氮同化率指标好于青岛啤酒酵母T1、T2和T3。青岛啤酒酵母T2菌株凝聚性优于T1和T3菌株,其他指标都不如T1和T3。因此,确定T1、T3和G4、G6为融合亲株,下一步进行原生质体融合。
[1]梅丛笑,方元超,王富荣.啤酒酵母的改良途径[J].食品工业科技,2000,21(3):70-73.
[2]Venturini Filho W G,Cereda M P.Cassava starch hydrolysate as an adjunct in beer production:Chemical and sensory evaluation[J].Cienc Tecnol Aliment,1998,18(2):156-161.
[3]Javadekar V S,Sivaraman H,Gokhale D V.Industrial yeast strain improvement:construction of a highly floccu-lent yeast with a killer character by protoplast fusion[J].J Indus Microbiol,1995,15:94-102.
[4]邓红梅.利用原生质体融合提高酿酒酵母赖氨酸含量的研究[J].贵州大学学报:自然科学版,2002,19(3):227-231.
[5]孙君社,李雪,李军席.原生质体融合构建耐高温酵母菌株[J].食品与发酵工业,2002,28(5):1-5.
[6]陈海昌,唐屹,张岭花,等.原生质体融合技术提高啤酒酵母凝絮性的研究[J].微生物学通报,1994,21(4):213-217.
[7]周东坡,平文祥,孙剑秋,等.通过灭活原生质体融合选育啤酒酵母新菌株[J].微生物学报,1999,39(5):454-460.
[8]蔡车国,刘月英,戴玉聪,等.啤酒酵母融合株GR8发酵特性的初步研究[J].酿酒,2005,32(4):60-61.
[9]张宝国,国晓秋,王超,等.啤酒酵母融合株QSB-XI6生产性实验[J].酿酒,1998(2):29-30.
[10]全丽.啤酒酵母原生质体融合株GR8的中试研究[J].酿酒科技,2005(8):69-73.
[11]刘月英,王芬,由媛,等.啤酒酵母原生质体融合株HN3126的啤酒酿造中试研究[J].厦门大学学报:自然科学版,2006,45(6):855-858.
[12]中国食品发酵工业研究院,酿酒工程技术研究发展部,标准和信息技术研究发展部.啤酒工业国家标准与分析技术手册[M].北京:中国食品发酵工业研究院,2001.
[13]母茜.高SOD,低双乙酞啤酒酵母工程菌的构建[D].雅安:四川农业大学,2008.
[14]GuanDY.Handbook of Brewing Industry[M].Beijing:Ligt Industry Press,1982:467-470.
[15]刘杰璞.啤酒新产品的开发及风味研究[D].北京:北京化工大学,2006.
[16]董新篁.定向培育啤酒酵母的技术[J].中国酿造,2002,123:24-35.
[17]江慧修,张金玲,周坚,等.啤酒酿造用凝集性酵母融合育种的研究[J].微生物学报,1993,33(1):22-31.

