复合抗氧化剂对冻肉MPI蛋白凝胶的影响
潘君慧,康有馀,刘泽龙
(1.浙江省亚热带作物研究所,浙江温州 325005;2.中粮营养健康研究院,北京 100020)
对于需要长期储备及长途运输的肉类产品,一般采用冷冻方式延长其保存期。虽然微生物生长在冻藏中得到抑制,但肉制品的品质会发生不可逆转的劣变。近年研究显示,除了脂质的氧化,蛋白冷冻变性外,蛋白氧化也是导致冷冻肉品质劣化的重要原因[1]。在肉及肉制品中,肌原纤维蛋白作为主要蛋白质,对肉蛋白功能尤其是凝胶性起主要作用。而肌原维蛋白对活性氧的攻击非常敏感,后者会改变前者的结构,使其凝胶性质发生较大变化[2]。因此,寻找合适的措施控制冻藏过程的氧化,并且保持冻藏肉品质和蛋白功能具有重要意义。本研究主要探讨一种复合抗氧化剂对冷冻肉肌原纤维蛋白特性的影响。
1 材料与方法
1.1 材料
新鲜猪后腿肉 (屠宰后2 d)购于当地超市。
复合抗氧化剂为抗坏血酸、α-生育酚和茶多酚。
超纯水,美国Millipore公司产;5,5-二硫代双 (2-硝基苯甲酸)、三硝基苯磺酸,美国Sigma公司产;其他试剂 (分析纯),国药集团化学试剂有限公司产。
机械搅拌器,广州仪科实验仪器有限公司产;UV-2800H型紫外可见分光光度计,尤尼柯 (上海)仪器有限公司产;DS-1高速组织捣碎机,上海精科实业有限公司产;Avanti J-26 XP高速冷冻离心机,美国Beckman公司产;A-XT Plus质构仪,英国Stable Micro Systems公司产。
1.2 方法
猪肉经过剔除筋膜后切丁 (10 mm×10 mm×10 mm),混匀后取部分肉 (0周样品)作为阳性对照进行相关指标的测定,其余部分随机分为2份,一份作为阴性对照,另一份添加复合抗氧化剂(0.2%抗坏血酸、0.2% α-生育酚和0.2%茶多酚,m/m),分装后进行普通密封包装,分别记为1号、2号样品,并放于-18℃冰箱贮藏24周,期间按不同贮藏时间取样测定相关指标。
冻肉样品的脂质氧化程度 (硫代巴比妥酸反应产物/TBARS含量)测定参考Vyncke的方法[3]。肌原纤维蛋白的提取参考Xiong等[2]的方法,蛋白浓度用双缩脲法测定。
蛋白总巯基的测定使用Ellman试剂法[4],在412 nm测定其吸光值。巯基含量 (nmol·mg-1蛋白)使用摩尔吸光系数136 000 L·mol-1·cm-1。
蛋白溶解性的测定参考Xiong等[5]测定肌原纤维蛋白溶解性的方法,蛋白质溶解度为上清液中蛋白浓度占原样品中蛋白浓度的百分比。
蛋白凝胶的制备及凝胶强度测定。将5 g浓度为30 mg·mL-1肌原纤维蛋白溶液置于瓶底玻璃管中800 g,4℃离心1 min,然后置于水浴锅中,从20℃开始以1.2℃ ·min-1的速率升温,至75℃时取出迅速置于冰浴中冷却。在4℃冰箱中过夜后,使用文献[6]方法进行强度测定。
所有数据均为2次重复,3次平行。数据处理使用Statistix 9.0软件进行方差分析和显著性分析,显著性数据用字母标记,其中不含相同字母的任意2个样品间有显著差异 (P<0.05)。
2 结果与分析
2.1 脂质氧化
从图1所知,2种样品的脂质氧化在贮藏初期 (2~4周)没有显著的增加。随着贮藏时间的延长,普通包装的肉样经冻藏4周以后脂质氧化产物显著增加,8~24周变化平缓,该结果与文献 [7]较一致。虽然在冻藏阶段2号样品的脂质氧化产物有所增加,但由于复合抗氧化剂的作用,比1号样品所生成的脂肪初级氧化产物有明显减少。
2.2 巯基含量
从巯基测定结果 (图2)来看,2种冻藏肉的总巯基从贮藏初期就有显著下降,1号随后处于一个稳定阶段,而2号处理的总巯基含量在贮藏2周后已经明显少于1号处理。2号样品巯基的下降有2种可能:一是由于抗坏血酸的存在反而会生成脱氢抗坏血酸促进蛋白中巯基的氧化,降低巯基含量[8];二是茶多酚很可能直接与游离巯基相作用,降低了其检出含量[9]。而α-生育酚为脂溶性抗氧化剂可能难以有效保护蛋白巯基。
2.3 肌原纤维蛋白溶解性

图1 2种样品脂质氧化的比较
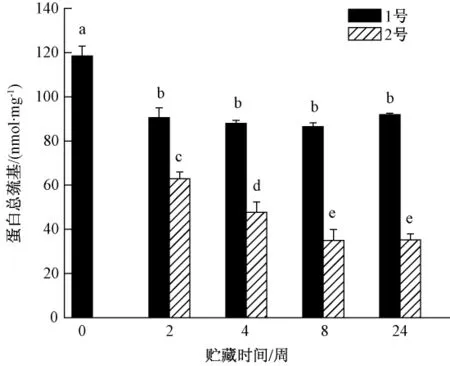
图2 2种样品蛋白总巯基含量的比较
图3 可以看出,肉样经冻结、化冻后肌原纤维蛋白在盐溶液中的溶解度显著下降,说明除冷冻因素外,蛋白氧化也影响蛋白的结构。2号样品随贮藏时间延长略有上升,这可能和抗氧化剂的氧化产物与肌纤维蛋白相互作用有关。

图3 2种样品肌原纤维蛋白溶解度的比较
2.4 肌原纤维蛋白凝胶强度
图4 可见,样品的凝胶强度相比原始样品有不同程度的降低,2号样品降低尤为显著。由于样品所含的酚类物质可能对巯基有封闭作用 (前期),该作用以及氧化后期形成的过多二硫键交联 (图2)都会影响蛋白凝胶网络的形成。另外,凝胶强度除受加热速率和成胶终点温度的影响外,也会受上述蛋白溶解度的影响[10-11]。

图4 2种样品肌原纤维蛋白凝胶强度的比较
3 小结与讨论
冻藏过程中会发生脂质与蛋白氧化,后者会影响蛋白的凝胶能力。抗氧化剂的选择对脂质和蛋白氧化有不同作用,对蛋白的功能也有明显影响。对比文献所报道的单一添加α-生育酚、L-抗坏血酸和绿茶提取物 (茶多酚为主)冻藏1周的结果,在本研究中,复合抗氧化剂可在4周内保持较低的氧化水平,抗氧化效果介于所报道的单一使用L-抗坏血酸和α-生育酚及茶叶提取物之间[8]。尽管α-生育酚可在其他抗氧化剂存在下 (比如抗坏血酸)氧化后再生而作为有效的抗氧化剂[12],但也会受到肉中生成的过氧化氢的影响。过氧化氢能够降解肌红蛋白,释放出铁离子,在金属离子的作用下转变为反应活性强的羟自由基[13-14],从而使复合抗氧化剂中的L-抗坏血酸反而参与氧化。而植物多酚也很有可能与蛋白中某些残基作用,影响其凝胶特性。总之,本研究结果是上述正、负面效应的综合表现。
抗氧化剂种类的选择与复配对抑制冷冻肉贮藏过程中的脂质与蛋白氧化,保持肌原纤维蛋白功能性质有很大影响,而其复配的有效策略还需要进一步探讨。
[1] Ooizumi T,Xiong Y L.Biochemical susceptibility of myosin in chicken myofibrilssubjected to hydroxylradicaloxidizing systems [J].Journal of Agricultural and Food Chemistry,2004,52:4303-4307.
[2] Xiong Y L,Park D,Ooizumi T.Variation in the cross-linking pattern of porcine myofibrillar protein exposed to three oxidative environments [J].Journal of Agricultural and Food Chemistry,2008,57:153-159.
[3] Vyncke W. Evaluation ofthe directthiobarbituric acid extraction method for determining oxidative rancidity in mackerel(Scomber scombrus L.) [J].Fette Seifen Anstrichm,1975,77:239-240.
[4] Ellman G L.Tissue sulfhydryl groups [J].Arch Biochem Biophys,1959,82:70-77.
[5] Xiong Y L,Lou X,Wang C,et al.Protein extraction from chicken myofibrils irrigated with various polyphosphate and NaCl solutions [J].J Food Sci,2000,65:96-100.
[6] Xiong Y L,Blanchard S P,Ooizumi T,et al.Hydroxyl radical and ferryl-generating systems promote gel network formation of myofibrillar protein [J].Journal of Food Science,2010,75:215-221.
[7] Allen J C,Hamilton R J.Ranken M D.Rancidity in Foods[M].New York:Chapman and Hall,1994:191-202.
[8] Haak L,Raes K,De Smet S.Effect of plant phenolics,tocopherol and ascorbic acid on oxidative stability of pork patties[J].Journal of the Science of Food and Agriculture,2009,89:1360-1365.
[9] Jongberg S,Skov S H,Tørngren M A,et al.Effect of white grape extract and modified atmosphere packaging on lipid and protein oxidation in chill stored beef patties [J].Food Chemistry,2011,128:276-283.
[10] Foegeding E A,Allen C E,Dayton W R.Effect of heating rate on thermally formed myosin,fibrinogen and albumin gels [J].Journal of Food Science,1986,51:104-108.
[11] Xiong Y L,Brekke C J.Protein extractability and thermally induced gelation properties of myofibrils isolated from pre-and postrigor chicken muscles [J].Journal of Food Science,1991,56:210-215.
[12] Papas A.Antioxidant status,diet,nutrition,and health[M].Papas A.Boca Raton:CRC Press,1999:72-79.
[13] Stief T W.The physiology and pharmacology of singlet oxygen[J].Medical Hypotheses,2003,60:567-572.
[14] Korycka-Dahl M,Richardson T.Activated oxygen species and oxidation of food constituents[J].CRC Crit Rev Food Sci Nutr,1978,10:209-241.

