1例成人神经母细胞瘤的临床诊治分析
曹嫣娜 闫 杰 王会娟
1 病历摘要
患者女,28岁,于入院前3个月妊娠6个月时开始自觉阵发性胸壁及背部疼痛,双下肢无力,无胸闷憋气、咳嗽、发热等不适,当地医院考虑为妊娠晚期子宫压迫所致,未予检查治疗。其后症状进行性加重,于2013年4月5日在当地医院行剖腹产手术,术后出现截瘫症状,大小便失禁,双下肢不能活动。至北京中日友好医院检查CT示T7水平椎管内及椎旁软组织肿物,右后纵隔、右侧胸腔软组织结节,考虑恶性肿瘤结节,右侧少量胸水,左侧胸膜局限性增厚,左侧锁骨上窝、纵隔内多发肿大淋巴结,左额顶叶占位,邻近骨质吸收破坏,双侧顶骨多发低密度影,考虑转移病变;肿瘤标记物神经元特异性烯醇化酶(NSE)128 ng/mL,于2013年4月15日CT引导下行右后纵隔肿物穿刺活检,病理诊断为结节性节细胞神经母细胞瘤,伴有部分出血、变性与灶性坏死。切片经本院病理科会诊考虑神经母细胞瘤(中度分化,图1)。遂以纵隔神经母细胞瘤4期收住入院,入院时查体患者一般情况尚好,体温不高,精神饮食好,卧床,双下肢无运动功能,肌力0级,痛温觉等浅感觉消失,位置觉等深感觉存在,皮温皮色正常,生理反射减弱,双侧病理反射阳性。入院后检查ECT可见颅骨、胸骨、胸椎5、10、两肋多处、双侧髋骨、左肱骨上段、右侧桡骨、右股骨下段异常放射性浓集,考虑多发骨转移(图2)。骨髓穿刺可见GD2染色阳性细胞占22%,N-MYC基因扩增阴性(图3),NSE 116.4 ng/L,VMA 51.13 mg/24 h,临床诊断纵膈神经母细胞瘤4期全身广泛转移。予全身化疗OPEC(DDP+CTX+VDS+VP-16)、OPAC(DDP+CTX+VDS+E-ADM)、高危 A(DDP+CTX+VDS+VP-16)、B(IFO+CBP+EADM)方案交替,共已完成9个疗程,同时予帕米磷酸二钠对抗骨转移灶治疗,治疗经过及复查结果(表1)。患者双下肢感觉功能恢复,肌力3级,连续监测肿瘤标记物NSE进行性降低至21.61 ng/L,骨髓穿刺GD2染色阳性细胞计数48/200万,复查强化CT左额顶部及左颞部占位有所减小,后纵隔及左前纵隔结节、肿物较前缩小,右侧胸腔积液较前减少,左锁骨上下淋巴结较前略缩小,余无显著变化。ECT示原右后10肋病灶区放射性摄取较前减低,左髋骨病灶放射性摄取较前增高,其余诸骨影响大致同前(图3)。

图1 纵隔肿物穿刺活检病理切片及免疫组化Figure 1 Pathologic and immunohistochemical examination of mediastinal tumor

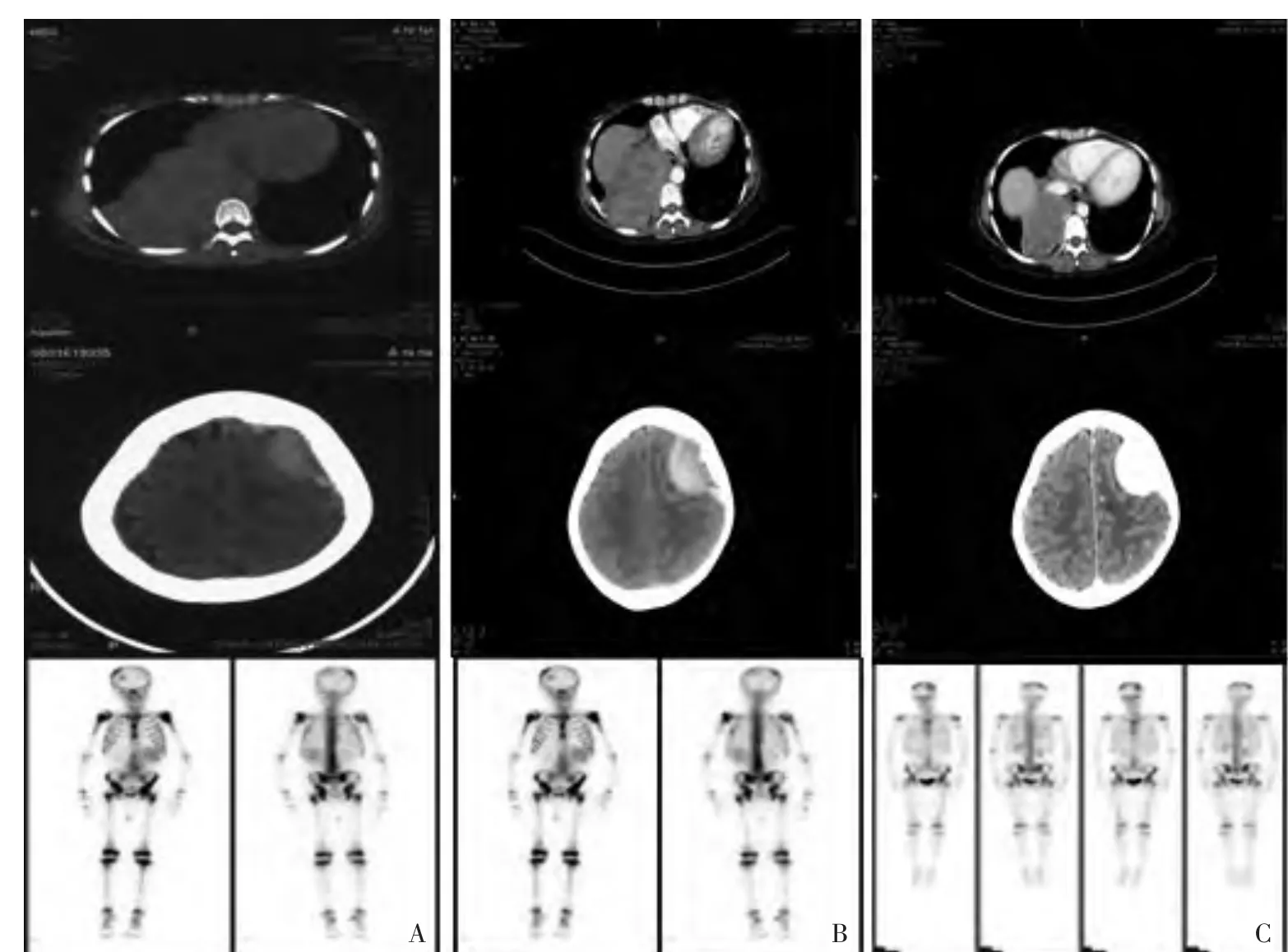
图2 影像学检查治疗前后效果对照Figure 2 Treatment effect comparison by imaging examination

图3 骨髓穿刺检查肿瘤细胞结果Figure 3 Results of bone marrow biopsy
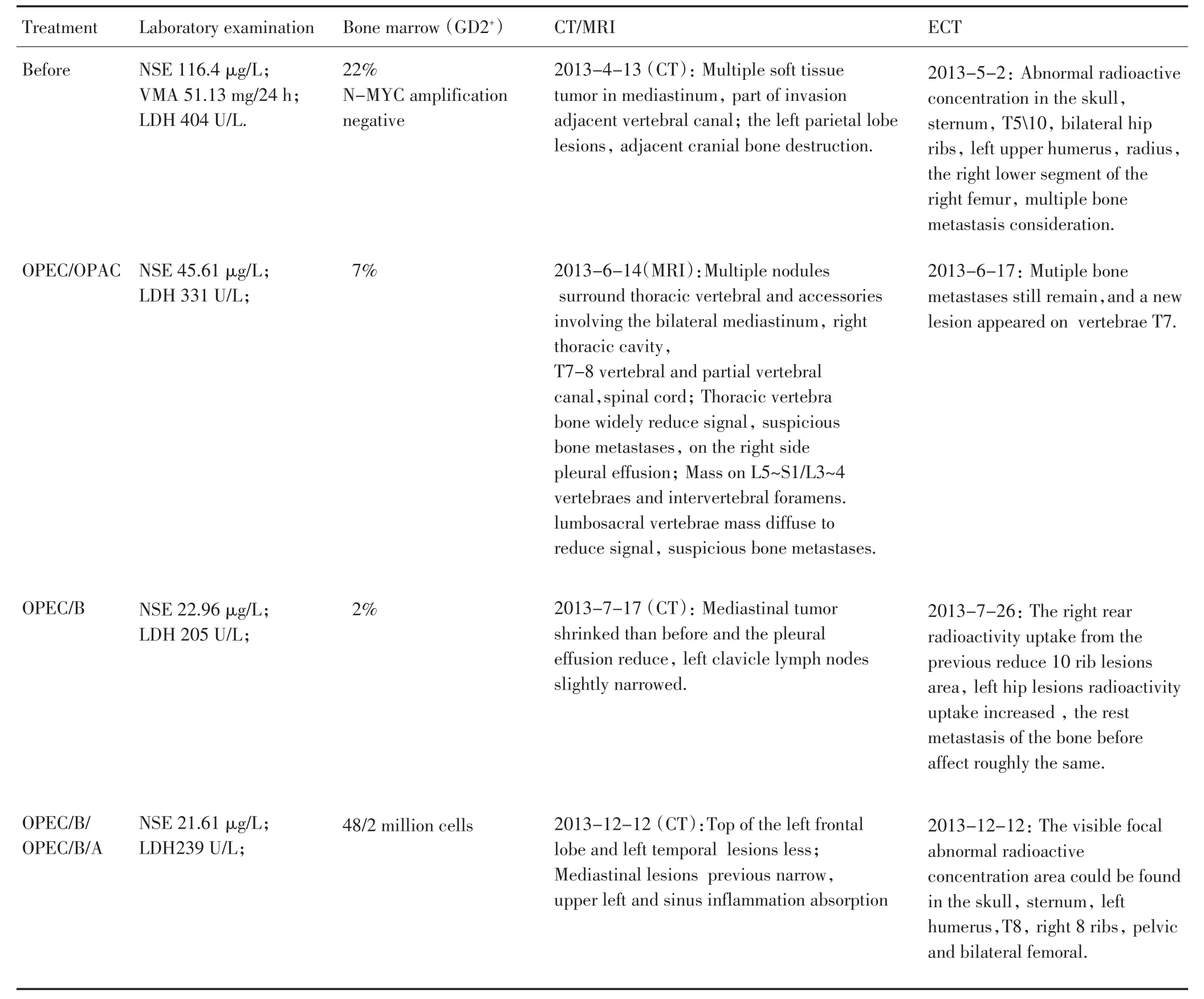
表1 患者治疗经过及临床效果评价Table 1 Treatment and clinical effect assessment of patients
2 讨论要点
1)结合该患者诊断、治疗情况分析成人神经母细胞瘤相关影像、病理、治疗等特征;2)多学科协作探讨后续治疗方案。
3 临床讨论
肖建宇主任医师(影像诊断科):神经母细胞瘤是儿童期常见恶性肿瘤,好发部位为肾上腺及交感神经链,肿瘤多为软组织密度实性肿块,增强扫描显示中到重度强化,可因内部出血、坏死而显示不均质,不均匀分布的沙砾样或斑片样钙化是其重要影像学特征。结合本病例为右后纵隔肿物,内部信号不均质,呈结节样堆积,伴有沙砾样钙化,有囊变表现,颅骨转移病灶显示明显骨质破坏,可见硬脑膜受挤压强化,而非脑实质受累。治疗后复查显示囊性变增多,提示化疗致肿瘤坏死,为治疗后好转表现。单从原发病灶影像特征看,成人病例首先鉴别诊断考虑为肉瘤,且以软骨肉瘤较多见,但后纵隔肿瘤常为神经来源,且结合临床及其他检查结果显示初诊时已有远处转移,特别是有骨转移和髓内转移,符合神经母细胞瘤诊断,伴全身广泛转移,治疗后缓解。
徐文贵主任医师(分子影像及核医学诊疗科):相对于传统影像检查,PET为全身显像,这一优势在骨髓、骨、淋巴结转移病灶的筛查中体现更为明显,为准确分期提供有力的依据,并对评估放化疗疗效、确定术后残留以及监测复发具有潜在价值。此外,131Ⅰ标记的MIBG核素扫描是神经母细胞瘤特异性的诊断和治疗方法,MIBG显像的局限性在于其难以检出细小病灶,且病灶的范围和定位可能难以精确划定[1]。若原发灶MIBG显像阴性,则需补加99mTc-MDP骨扫描评估有无骨骼转移。MIBG小剂量时用于显像诊断,大剂量时则可用于同位素治疗。此外,对于成人多发骨转移目前临床认为单纯应用帕米磷酸盐的作用仅为使钙沉积更多,使骨密度增加,减少临床发生外科风险,对肿瘤细胞杀伤没有更多作用,可以考虑与同位素89Sr协同序贯治疗,更好地发挥针对多发骨转移病灶的治疗作用。
战忠利主任医师(病理诊断科):纵隔肿瘤发生在成人时很难首先想到神经母细胞瘤诊断,如考虑为恶性肿瘤,恶性神经鞘瘤可能性更大。国际肿瘤组织将神经母细胞瘤按肿瘤组织分化程度和Schwannian间质的发育状态分为四种类型[2-3]:神经母细胞瘤(Schwannian,间质贫乏),这类肿瘤细胞分化很差,不分泌间质,根据肿瘤细胞分化程度又可以分为未分化型、分化差型和分化型三个亚型;节细胞神经母细胞瘤结节型即结节性经典型;节细胞神经母细胞瘤混合型(Schwannian,间质丰富)即结节性非经典型;节细胞神经瘤(Schwannian,间质优势),包括成熟中型和成熟型。神经母细胞瘤来源于神经嵴交感神经系统,镜下按国际分级标准分为未分化型,指细胞异形,可有Syn、N-MYC、CD56阳性,不产生神经源纤维,缺乏神经网;低分化型,5%以下神经母细胞同时向神经节细胞分化倾向;分化型,5%以上神经母细胞同时向神经节细胞分化。另一个评价指标为核碎裂指数,其评价标准<2%为低度,2%~4%为中度,>4%为高度。结合以上二项指标以及患儿年龄,评价不利和有利预后因素临床可将其分为低危、中危和高危组。但以上标准只适用于儿童,成人目前尚缺乏系统的评价标准,如按儿童标准划分18个月以上均为高危类型。该病例肿瘤组织镜下几乎全部为神经母细胞,有些部分可见大量代谢产物神经源纤维,提示有分化,部分缺乏神经源纤维提示低分化,其免疫组化染色NF、NSE、Syn、CgA等神经细胞产物均阳性,S-100可见少量阳性,Ki-67阳性>50%,提示肿瘤恶性程度较高,综上所述,该病例病理学诊断为(右后纵隔)中-低分化神经母细胞瘤。
苏延军主任医师(肺部肿瘤科):成人上皮来源恶性肿瘤发生多发骨转移及中枢神经系统转移,一般没有手术切除原发病灶机会。但神经母细胞瘤的综合治疗原则中手术切除原发病灶是很重要的一部分,即便是4期高危组病例仍可通过放、化疗等内科手段尽力争取手术参与机会,从而明显改善预后。该病例经全身化疗后影像学检查提示原发肿瘤明显缩小,有完整切除可能,而且神经源性肿瘤大部分与周围组织有分界,一些通过椎间孔向椎管内生长的哑铃形病灶在与神经外科合作下也可争取手术切除。特别是其生物学检测N-MYC基因扩增阴性,骨髓转移控制良好,LDH、NSE等肿瘤标记物水平治疗后明显降低,提示患者存在一些预后良好指标,且前期治疗效果明显,虽仍存在一定风险,但已具备手术完整切除原发病灶条件,可考虑下一步在患者一般情况允许时采取外科治疗,争取最大限度提高预后。
王鹏主任医师(脑系肿瘤科):该病例颅内诊断为神经母细胞瘤转移病灶,神经母细胞瘤颅内转移情况根据NCCN指南(2013版)分为1~3个转移灶和3个以上转移灶两种情况,判断任何颅内转移瘤有外科指征即“可切除”标准是指通过外科治疗能够保持或改善神经系统功能而不使其加重,虽临床尚有争议,但目前大多数观点认为即使是超过1个颅内转移性病灶,在原发肿瘤及全身情况控制良好情况下,如果通过放化疗不能有效控制颅内转移,为了改善患者生存质量延长生存时间,手术也不是绝对禁忌的。该病例化疗后椎管内肿瘤已明显缩小,而且肿瘤沿椎管壁生长未侵入脊髓,患者下肢瘫痪症状减轻也证明了这一点。目前中枢神经系统转移病灶仅为左额顶部和左颞部单发病变,伴有颅骨骨质破坏,根据影像学资料判断仍考虑为颅骨转移向内挤压硬脑膜,脑实质尚未受侵,因此存在手术切除机会,可考虑待纵隔原发灶切除后手术切除中枢转移病灶,并结合局部放疗巩固疗效。
王佩国主任医师(肿瘤放射治疗科):神经母细胞瘤的治疗原则仍然是以手术、放疗、化疗、生物治疗等相结合的综合治疗,其中尤以手术和化疗为主,放疗的意义主要在于提高局部控制率减少镜下残留病灶,进而提高生存率,但多数报道对肉眼残留病灶的治疗意义不大。放疗一般选择在诱导化疗及手术后或者干细胞移植时根据肿瘤手术切除及分期情况选择性实施。放疗的剂量以及射野范围尚有争议,一般多数认为神经母细胞瘤术后放疗原则为:如果肿瘤达到完整切除镜下无残留,放疗可以不做;如果为次全切除镜下有肿瘤细胞残留或区域淋巴结转移阳性,一般常规需要加行术后瘤床和淋巴结受累区域放疗。对于转移灶的放疗一般为姑息性治疗,目的为止痛、缓解症状。放疗技术方面常采取三维适形或调强放疗技术,可以通过计算机三维模拟达到使照射野高度符合肿瘤大小及形状的目的,并计算出肿瘤及周围脏器的受照射剂量是否符合要求。
张新伟主任医师(生物治疗肿瘤科):较为广泛认可与神经母瘤预后和治疗选择相关的指标主要包括:N-MYC基因扩增、1p36或11q14~23缺失和DNA倍性。N-MYC基因位于2p24,主要功能是促进细胞增殖、抑制分化和凋亡,在神经母细胞瘤中起致癌作用[4-7]。临床上发现N-MYC扩增与预后不良强烈相关,N-MYC扩增约占神经母细胞瘤的16%~25%[8],而本病例N-MYC检测扩增是阴性的。另外在无N-MYC基因扩增的NB中,常有遗传学节段性染色体异常,近35%的神经母细胞瘤存在1p杂合型丢失,而1p长臂丢失比1p短臂丢失预后更差,大约15%的神经母细胞瘤中存在11q丢失,荧光原位杂交技术显示1p或11q参与17q转位,结果导致1p或11q远端丢失,同时发生17q获得。这些染色体异常均提示预后较差[9-10]。DNA倍型也与神经母细胞瘤的预后相关,二倍体核型为预后不良型,超二倍体为预后良好型,提示临床不易复发。本病例FISH检测结果DNA为二倍体。对于该病例分子检测结果目前只有DNA倍型结果提示预后不良,但由于其年龄大,全身病变广泛,仍为高度危险级别病例,需给予高强度的综合治疗,在其他治疗手段无法进一步实施控制肿瘤情况下,一些生物学治疗方法也可考虑应用。
闫杰主任医师(儿童肿瘤科):目前临床诊断神经母细胞瘤是结合病理形态学、分子生物学、累及范围及预后的判定几个方面综合评价,根据临床分期并考虑不良预后因素的数量等指标按危险程度分级,并据此制定相应综合治疗方案。这些诊断资料的获得除了常规影像学检查、组织活检外,神经母细胞瘤特有的肿瘤标记物水平如儿茶酚胺代谢产物、神经元特异性烯醇化酶也能提示该病的诊断,此外神经母细胞瘤易侵犯骨髓,骨髓内微小残留病灶的存在是很多神经母细胞瘤患者复发的根源,目前对骨髓微小残留灶可以通过GD2免疫组化染色检测,其灵敏度可达到1/10万~1/20万。其他一些分子水平诊断指标比如N-MYC基因扩增情况的检测现在在本科也已常规开展。本科近年来按照国际国内通用危险度评级标准分级,采取常规化疗加手术加两次干细胞移植支持下的大剂量化疗加放疗的序贯疗法治疗极高危和部分高危神经母细胞瘤患者,取得了不错的疗效。此外患者直系亲属HLA半相合淋巴细胞治疗神经母细胞瘤的生物免疫治疗方法在部分患者中也获得了满意的疗效。结合该患者相关检查结果可以确定诊断纵隔神经母细胞瘤4期极高危组,广泛骨、骨髓转移,由于成人神经母细胞瘤治疗缺乏相应规范,成人骨髓造血干细胞活性较儿童差,对化疗强度的耐受低于儿童,而且患者病程较长,产后体质虚弱,开始仅给予OPEC等中等强度化疗方案,以后根据患者化疗反应及耐受程度将化疗强度提高,目前患者双下肢瘫痪症状明显缓解,各种实验室检查肿瘤标记物指标及骨髓肿瘤细胞均持续下降,考虑治疗有效,患者病情控制,有手术指征。下一步准备采取多学科协作,请苏主任、王主任帮助手术切除原发纵隔肿物和颅内转移病灶,争取最大限度地减少肿瘤残留,延长生存时间,提高生存质量。
赵强主任医师(儿童肿瘤科):根据临床经验以及相关文献报道,神经母细胞瘤患病年龄越大,预后越差,而且没有规范治疗方案可供借鉴,因此我们认为成人罹患儿童恶性肿瘤诊断明确基础上,按照儿童相关的治疗方案治疗可能会获得更好的效果,本病例的治疗也证实了这一想法。近年来从基因分子水平对儿童恶性肿瘤进行诊断、治疗成为研究新热点,也是我们深入研究攻克肿瘤的方向和思路[11-13]。从另一个角度讲,儿童肿瘤细胞较为原始,分化差,但正因为如此,其化疗敏感度较高,放化疗疗效优于成人多数恶性肿瘤,早期病例多预后很好,即便是临床晚期病例,经过放化疗、外科治疗、生物免疫治疗等多学科支持的综合治疗后也能获得较大多数成人恶性肿瘤好的治疗效果,因此儿科学对恶性肿瘤多采取积极治疗的态度。由于成人神经母细胞瘤临床罕见,其发病原因更难以确定,至于本病例是否与妊娠有关尚不得而知。
4 小结
神经母细胞瘤为儿童期常见恶性肿瘤,成人中该病罕见,发病率约0.2/100万人,诊断治疗缺乏相关规范资料报道,发病部位、组织来源与儿童近似,诊断依据同儿童神经母细胞瘤,但N-MYC基因扩增较儿童少见,大多数患者病情严重、进展迅速、预后差,无相关化疗方案供参考,可以参照儿童神经母细胞瘤方案治疗。多学科协作的综合诊疗模式是儿童恶性肿瘤最重要的治疗原则,对成人期病例同样适用,随着检查治疗手段的不断完善,发病机制基因水平的研究更加深入,临床诊断分期更加细化,治疗方案的制定更为精细并逐渐实现个体化,相信神经母细胞瘤患者的预后可以得到进一步的提高。
1 Vik TA,Pfluger T,Kadota R,et al.(123)I-MIBG scintigraphy in patients with known or suspected neuroblastoma:Results from a prospective multicenter trial[J].Pediatr Blood Cancer,2009,52(7):784-790.
2 Shimada H,Ambros IM,Detmer LP,et a1.The international neuroblastoma pathology classification(the shimada system)[J].Cancer,1999,86(2):364-372.
3 Peuchmaur M,d'Amore ES,Joshi VV,et al.Revision of the International Neuroblastoma Pathology Classification:confirmation of favorable and unfavorable prognostic subsets in ganglioneuroblastoma,nodular[J].Cancer,2003,98(10):2274-2281.
4 Petroni M,Veschi V,Gulino A,et al.Molecular mechanisms of MYCN-dependent apoptosis and the MDM2 p53 pathway:an Achille's heel to be exploited for the therapy of MYCN-amplified neuroblastoma[J].Front Oncol,2012,2:141.
5 Puissant A,Frumm SM,Alexe G,et al.Targeting MYCN in neuroblastoma by BET bromodomain inhibition[J].Cancer Disc,2013,3(3):308-323.
6 Faisal A,Vauqhan L,Bavetsias V,et al.The aurora kinase inhibitor CCT137690 downregulates MYCN and sensitizes MYCN-amplified neuroblastoma in vivo[J].Mol Cancer Ther,2011,10(11):2115-2123.
7 Ambros PF,Ambros IM,Brodeur GM,et al.International consensus for neuroblastoma molecular diagnostics:report from the International Neuroblastoma Risk Group(INRG)Biology Committee[J].Br J Cancer,2009,100(9):1471-1482.
8 Souzaki R,Tajiri T,Teshiba R,et al.Correlation between the number of Segmental chromosome aberrations and the age at diagnosis of diploid neuroblastomas without MyCN amplification[J].J Pediatr Surg,2011,46(12):2228-2232.
9 Carén H,Kryh H,Nethander M,et al.High-risk neuroblastoma tumors with 11q-deletion display a poor prognostic,chromosome instability phenotype with later onset[J].Proc Natl Acad Sci U S A,2010,107(9):4323-4328.
10 Castel V,Villamón E,Cañete A,et al.Neuroblastoma in adolescents:genetic and clinical characterization[J].Clin Transl Oncol,2010,12(1):49-54.
11 Molenaar JJ,Koster J,Zwijnenburg DA,et al.Sequencing of neuroblastoma identifies chromothripsis and defects in neuritogenesis genes[J].Nature,2012,483(7391):589-593.
12 Cheung NK,Zhang J,Lu C,et al.Association of age at diagnosis and genetic mutations in patients with neuroblastoma[J].JAMA,2012,307(10):1062-1071.
13 Molenaar JJ,Koster J,Zwijnenburg DA,et al.Sequencing of neuroblastoma identifies chromothripsis and defects in neuritogenesis genes[J].Nature,2012,483(7391):589-593.

