低剂量鱼藤酮持续灌胃处理致中脑多巴胺能神经元损伤
黄梦阳,江红,胡琦,康慧聪,许峰,刘晓艳,张存泰,朱遂强
低剂量鱼藤酮持续灌胃处理致中脑多巴胺能神经元损伤
黄梦阳a,江红a,胡琦a,康慧聪b,许峰b,刘晓艳b,张存泰a,朱遂强b
目的:探讨低剂量鱼藤酮持续灌胃致中脑多巴胺能神经元损伤的可能机制。方法:将50只老年雄性C57小鼠随机分为模型组和对照组各25只,2组均给予连续灌胃12周,模型组灌注0.01 mL/g鱼藤酮氯仿溶液,对照组灌注0.01 mL/g氯仿溶液。在灌胃前、灌胃6周、12周时对肠、胸段脊髓、中脑行α-突触核蛋白(α-Syn)、硫磺素S(ThS)、酪氨酸羟化酶(TH)等免疫组化染色。灌胃12周时采用透射电镜观察2组黑质神经元超微结构。结果:免疫组化染色提示灌胃6周时模型组小肠内、胸段脊髓处α-Syn的表达较对照组明显增加,且ThS表达比例增多,中脑处α-Syn及TH阳性细胞数无明显差异(>0.05);灌胃12周时,模型组中脑α-Syn的表达较对照组明显增多,TH阳性细胞数较对照组减少(=0.011)。灌胃12周后透射电镜显示模型组小鼠黑质部可见细胞膜、线粒体、内质网不规则肿胀,细胞核形态各异,部分神经元溶解坏死,数目减少,对照组未见明显改变。结论:持续鱼藤酮灌胃可能首先在小肠神经丛局部形成α-Syn多聚体,再通过类朊蛋白途径沿着神经传导通路播散至脑内而导致多巴胺神经元损伤。
帕金森病;鱼藤酮;α-突触核蛋白;多巴胺能神经元
帕金森病(Parkinson disease,PD)是一种常见的神经系统变性病,经典病理改变为多巴胺能神经元(dopaminergic neuron,DN)变性丢失,残留神经元出现以α-突触核蛋白(α-Synuclein,α-Syn)为主要成分的Lewy小体[1]。近年临床研究提示PD病理改变可能首先从胃肠神经节[2]、脊髓[3]等处出现,再逐渐播散至中脑等处。与此同时,国外研究提示低剂量鱼藤酮持续灌胃可导致中脑DN的损伤和减少[4],而目前国内尚未见相关报道。本研究拟予老年小鼠持续鱼藤酮灌胃处理,并在多水平对神经系统进行病理和超微结构研究,以初步探讨鱼藤酮持续灌胃后DN损伤的可能机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 12月龄清洁级健康雄性C57BL/6小鼠,体质量约28 g,由武汉大学动物实验中心提供,许可证号SCXK(鄂)2008-0004。
1.1.2 主要试剂 鱼藤酮、半胱氨酸、硫磺素 S(Thioflavin S,ThS)均购自美国Sigma公司;氯仿购自天津市化学试剂公司;羧甲基纤维素购自上海KaYon生物科技有限公司;乙醇和10%水合氯醛由武汉同济医院提供;抗α-Syn抗体购自美国Santa Cruz公司,抗酪氨酸羟化酶(tyrosine hydroxylase,TH)抗体购自美国Chemicon公司。鱼藤酮溶液的配制:将鱼藤酮粉末溶于 12.5%氯仿,配制成50 mg/mL鱼藤酮溶液,20℃避光保存,灌胃时再将鱼藤酮氯仿溶液与2%羧甲基纤维素溶液搅拌混匀,每只小鼠的鱼藤酮剂量为5 mg/kg,溶液体积为0.01 mL/g。同时,将氯仿、2%羧甲基纤维素按上述比例配制成空白对照溶液。
1.2 方法
1.2.1 灌胃处理 取小鼠50只,随机分为模型组和对照组各25只,每周灌胃5 d,休息2 d,均连续灌胃12周。模型组给予灌注0.01 mL/g鱼藤酮氯仿溶液,对照组则灌注0.01 mL/g的空白对照溶液。
1.2.2 免疫组化染色 对灌胃前、灌胃6周、12周小鼠(各3只)的肠、胸段脊髓、中脑行α-Syn免疫荧光及硫磺素染色:将小鼠用10%水合氯醛灌注,后断头,取空肠、胸段脊髓和脑,并置于4%多聚甲醛中在4℃后固定6 h,脱水、石蜡包埋、切片,行α-Syn免疫荧光染色,其后用50%酒精新鲜配制 0.05%ThS溶液孵育切片10~20 s,再分别用50%酒精、70%酒精各冲洗1次,每次5 min,最后加50 μg/mL的DAPI避光孵育15 min。同时,对两组小鼠中脑行TH免疫荧光染色。
1.2.3 TH阳性细胞计数 切片染色后荧光显微镜下观察,每个脑组织包块选5张连续切片观察黑质部分。每张切片先在低倍镜下选取TH阳性细胞密集区,然后在高倍镜下随机选取2个视野进行TH阳性神经元计数,对10个视野下所有阳性细胞数进行统计,计算出平均值。
1.2.4 电镜观察 灌胃12周(各2只)模型组和对照组在灌注固定后,取黑质约0.5 mm3,2.5%戊二醛、1%锇酸铅双重固定,脱水,Epon812包埋,LKB-Ⅲ切片机超薄切片,醋酸铀硝酸铅双重染色,IEM-1200EX透射电镜观察。
1.3 统计学处理
采用SPSS19.0软件对数据进行统计,独立样本 检验,<0.05为差异有统计学意义。
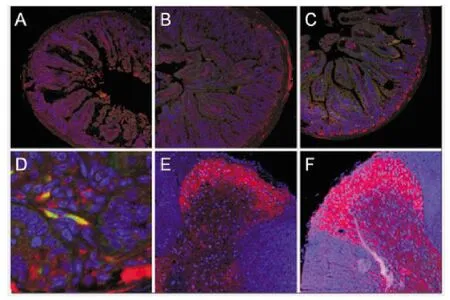
图1 2组肠道和脊髓免疫荧光
2 结果
2.1 2 组免疫组化染色
灌胃前2组小鼠小肠、胸段脊髓及中脑均可见α-Syn的表达,未见明显差异;灌胃6周后模型组小肠、胸段脊髓处α-Syn的表达较对照组明显增加,且ThS表达比例也明显增多,见图1,中脑黑质处α-Syn及TH阳性细胞数的表达均无明显差异;灌胃12周后,模型组中脑黑质处α-Syn的表达较对照组明显增多,TH阳性细胞数较对照组减少,见图2,模型组小肠、胸段脊髓处α-Syn的表达较对照组明显增加。
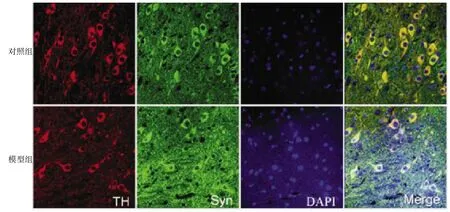
图2 2组灌胃12周后中脑黑质免疫荧光(×400)
2.2 TH阳性细胞计数
模型组灌胃前、灌胃6周及12周后TH阳性细胞分别为(25.60±3.03)个、(24.40±5.86)个、(18.80±2.35)个,对照组灌胃前、灌胃6周及12周后TH阳性细胞分别为(26.70±3.30)个、(25.10±4.73)个、(22.40±3.24)个。灌胃前及灌胃6周后模型组与对照组相比差异无统计学意义(>0.05);灌胃12周后,模型组较对照组减少,差异有统计学意义(=0.011)。
2.3 电镜结果
灌胃12周后模型组小鼠的黑质部可见细胞膜、线粒体、内质网不规则肿胀,细胞核形态各异,部分神经元发生溶解坏死,数目减少;对照组小鼠的大部分黑质神经元形态和结构正常,细胞核形状正常,细胞内的线粒体和内质网未见明显异常,见图3。
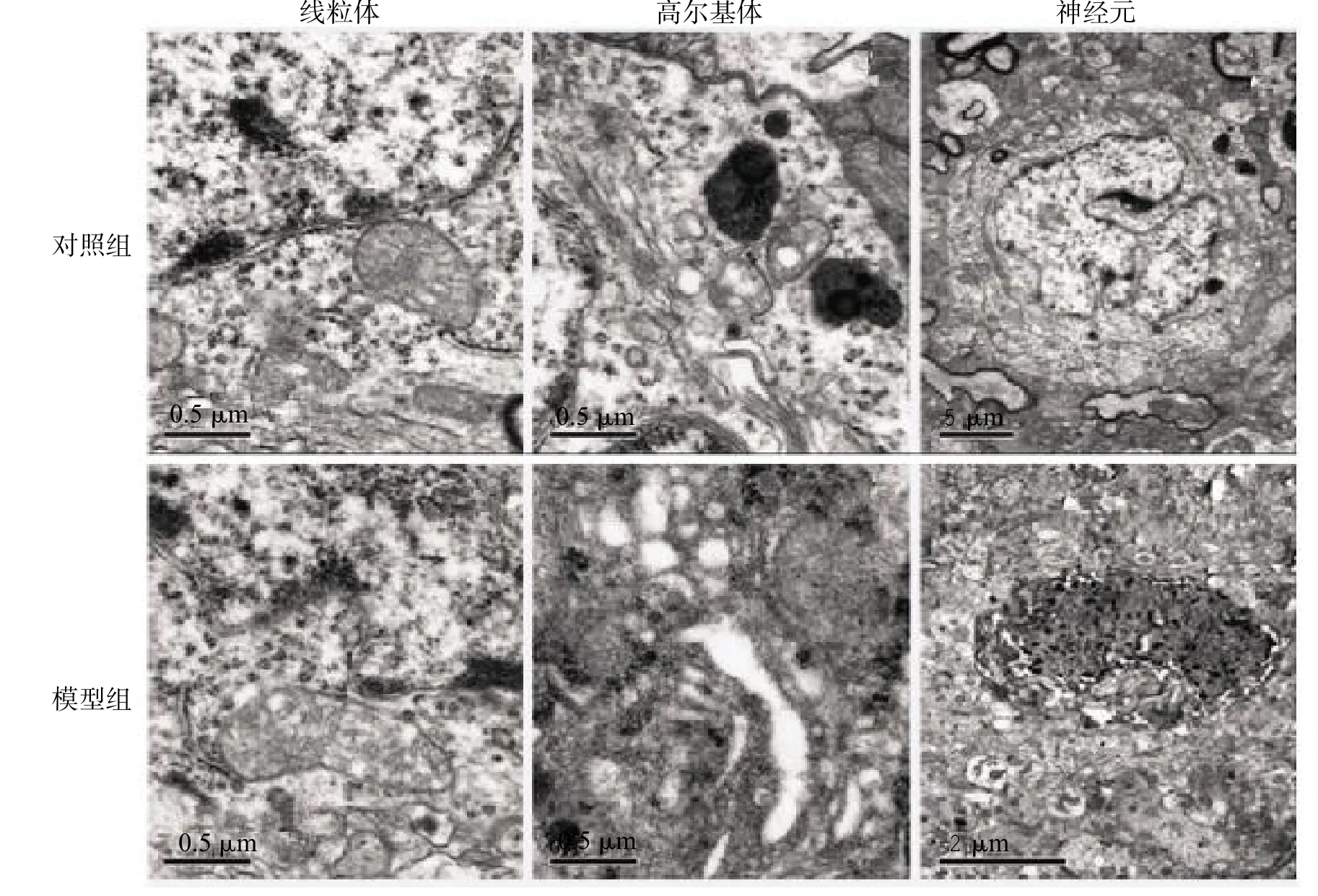
图3 灌胃12周2组中脑黑质超微病理
3 讨论
PD是一种常见的神经系统变性病,临床常表现为静止性震颤、运动迟缓等运动症状,经典病理改变为中脑DN变性丢失,但其发病机制现仍尚未完全明确。近年越来越多的临床研究显示PD患者在运动症状前常出现嗅觉减退[5]、抑郁[6]、睡眠障碍[7]等非运动症状。Braak等[8]的神经病理研究也证实,PD患者体内路易小体最初多始于嗅球等,后才逐渐进展至中脑和皮质等中枢神经系统。同时对接受胚脑移植10余年的PD患者进行尸检,发现其脑内的胚脑多巴胺能神经元形成新的路易小体[9];将绿色荧光蛋白标记的小鼠神经干细胞移植入表达人α-Syn的转基因小鼠脑内,4周后约15%的小鼠神经干细胞表达人α-Syn[10]。因此,上述证据提示α-Syn有可能先在胃肠神经节或嗅球等处形成寡聚体、多聚体等异常聚集体,而异常聚集体可再进入临近神经元并诱发细胞内α-Syn单体形成新的异常聚集体,进而通过此类朊蛋白机制导致PD病情的进展[11]。
为验证此类朊蛋白机制的可能,Pan-Montojo等[4]采取低剂量鱼藤酮持续灌胃的方法处理老年小鼠,实验结果显示中脑DN出现损伤和减少,行为学也呈现相应的改变,然而该PD模型目前国内尚未见报道。为此笔者尝试对C57老年小鼠进行持续灌注鱼藤酮,并对中脑神经元进行超微病理研究,透射电镜结果显示黑质部神经元的细胞膜、线粒体、内质网不规则肿胀,细胞核形态各异,部分神经元发生溶解坏死,且数目明显减少。同时,免疫组化结果显示鱼藤酮灌胃6周后α-Syn仅在小肠神经丛、胸段脊髓表达增加,至12周时才出现中脑α-Syn表达增加,并伴有中脑DN的减少,即随着鱼藤酮灌胃时间的增加,α-Syn在小肠神经丛、胸段脊髓和中脑的表达依次增多,最后才出现中脑DN的减少。
因此,经低剂量鱼藤酮持续灌胃处理后的老年小鼠表现出以下病理学特征:α-Syn聚集和神经元死亡由胃肠道神经丛逐渐播散至中脑黑质。为排除该剂量的鱼藤酮吸收入血后透过血脑屏障导致DN的损伤,Pan-Motonjo等[4]采用高效液相色谱法检测模型组小鼠血和脑标本,结果均未发现鱼藤酮成分,而且对脑内线粒体复合酶Ⅰ进行检测也未见改变。同时,在截断连接脑干和胃肠道的迷走神经干后再对小鼠持续灌注鱼藤酮,中脑则未再出现上述改变[12]。因此,上述中脑α-Syn异常表达和多巴胺能神经元的损伤和减少有可能是小肠神经丛局部的α-Syn多聚体通过类朊蛋白途径沿神经传导通路播散至中脑所致[13,14]。然而,鱼藤酮具有高度亲脂性,易穿过血脑屏障进入脑内,故还需更多的实验来进一步排除鱼藤酮直接到达脑内的可能。
因此,小剂量鱼藤酮持续灌胃后导致中脑DN损伤的现象初步提示了类朊蛋白途径存在的可能,并为研究PD发病机制和筛选延缓PD进展的药物提供了良好的模型,但仍需要更多的实验来重复证实,且DN损伤的详细机制还需进一步深入研究。
[1]Lees AJ,Hardy J,Revesz T.Parkinson's disease[J].Lancet,2009,373:2055-2066.
[2]Shannon KM,Keshavarzian A,Mutlu E,et al.Alpha-synuclein in colonic submucosa in early untreated Parkinson's disease [J].Mov Disord,2012,27:709-715.
[3]Del Tredici K,Braak H.Spinal cord lesions in sporadic Parkinson's disease [J].Acta Neuropathol,2011,124:643-664.
[4]Pan-Montojo F,Anichtchik O,Funk RH,et al.Progression of Parkinson's disease pathology is reproduced by intragastric administration of rotenone in mice[J].PLoS One,2010,5:e8762.
[5]Ponsen MM,Stoffers D,Booij J,et al. Idiopathic hyposmia as a preclinical sign of Parkinson's disease[J].Ann Neurol,2004,56: 173-181.
[6]Taylor A,Saint Cyr JA,Lang AE,et al. Parkinson's disease and depression:a critical re-evaluation[J].Brain,1986,109:279-292.
[7]Postuma RB, Lang AE, Massicotte-Marquez J,et al.Potential early markers of Parkinson disease in idiopathic REM sleep behavior disorder[J].Neurology,2006,66: 845-851.
[8]Braak H,Del Tredici K,Rüb U,et al. Staging of brain pathology related to sporadic Parkinson's disease[J].Neurobiol Aging,2003, 24:197-211.
[9]Li JY,Englund E,Holton JL,et al.Lewy bodies in grafted neurons in subjects with Parkinson's disease suggest host-to-graft disease propagation[J].Nature Med,2008,14:501-503.
[10]Desplats P,Lee HJ,Bae EJ,et al.Inclusion formation and neuronalcelldeath through neuron-to-neuron transmission of alpha-synuclein [J].Proc Natl Acad Sci U S A,2009,106: 13010-13015.
[11]Frost B, Diamond MI. Prion-like mechanisms in neurodegenerative diseases[J]. Nat Rev Neurosci,2010,11:155-159.
[12]Pan-Montojo F,Schwarz M,Winkler C,et al. Environmental toxins trigger PD-like progression via irrcreased alpha-synuclein release from enteric neurons in mice[J].Sci Rep,2012, 2:898.
[13]Brundin P,Melki R,Kopito R.Prion-like transmission of protein aggregates in neurodegenerative diseases[J].Nat Rev Mol Cell Biol,2010,11:301-307.
[14]Guerrero E,Vasudevaraju P,Hegde ML,et al.Recent advances inα-synuclein functions, advanced glycation,and toxicity:implications for Parkinson's disease[J].Mol Neurobiol,2013,47: 525-536.
Dopaminergic Neuron Damage induced by Constant Intragastric Administration of Low-dose Rotenone
Objective:To explore the mechanism of dopaminergic neuron damage induced by constant intragastric administration of low-dose rotenone.Methods:Fifty aged male mice were randomly divided into Parkinson disease(PD)model group and control group.The mice in PD model group were administrated 0.01 mL/g rotenone by gavage while the mice in control group were administrated 0.01 mL/g chloroform.Before treatment and 6 weeks,as well as 12 weeks after treatment,alpha-synuclein(α-Syn),Thioflavin S(ThS)and tyrosine hydroxylase (TH)were detected in neurons from gastrointestinal tract,thoracic spinal cord and midbrain of both the control and treated animals.Simultaneously,ultrastructural changes were observed by electron microscopy 12 weeks after treatment.Results:Six weeks after treatment,immunofluorescence demonstrated that α-Syn and ThS were increased in intestinal intramural plexus and thoracic spinal cord in the PD model group compared to the controls while the expression of α-Syn and number of TH positive neurons in midbrain did not show any significant changes(>0.05).However,12 weeks after treatment,immunofluorescence showed that there was an increase in α-Syn and an significant decrease in TH positive neurons in the midbrain(=0.011)in the model group compared with those in the controls.Moreover,electron microscopy showed a lot of abnormalities in the PD model group, such as the swollenness of cell membrane,mitochondria and endoplasmic reticulum,alterations of nuclei,and necrosis of neurons in the substantia nigra,in a sharp contrast to the normality in the.control group.Conclusion: Dopaminergic neuron damage was observed in mouse brain after constant intragastric administration of low-dose rotenone,probably mediated by the spread of synuclein aggregates formed in gastrointestinal plexues into brain by prion-like transmission.
Parkinson's disease;rotenone;alpha-synuclein;dopaminergic neuron
R741;R741.05
A DOI 10.3870/sjsscj.2014.03.008
华中科技大学同济医学院附属同济医院a.综合科 b.神经内科武汉 430030
国家自然科学基金青年基金(No.81102689)
2014-02-24
胡琦huqi@hotmail.com

