线粒体凋亡途经参与热应激后人脐静脉内皮细胞凋亡的研究
李莉 古正涛 刘志锋 苏磊

DOI:10.3760/cma.j.issn.1671-0282.2014.12.006
基金项目:国家自然科学基金(81071529,81101467);广东省自然科学基金(10151001002000001);广东省科技计划项目(2012B031800416);军队十二五医学科研基金重点项目(BWS12J018)
作者单位:510010广州,南方医科大学第三附属医院重症医学科(李莉、古正涛); 广州军区广州总医院重症医学科全军热区创伤救治与组织修复重点实验室(刘志锋、苏磊)
通信作者:苏 磊, Email: sulei_icu@163.com
【摘要】目的观察细胞色素C、caspase-9和caspase-3在热应激后人脐静脉内皮细胞的表达及相互关系,阐明热应激后人脐静脉内皮细胞凋亡的信号转导机制,探讨重症中暑所致血管内皮损害的发病机理。方法 建立人脐静脉内皮细胞热应激模型,对照组将细胞置于标准37 ℃、5%CO<sub>2</sub>细胞培养箱,热应激组将细胞置于39 ℃、41 ℃、43 ℃细胞培养箱中进行热应激2 h,热应激后继续在细胞培养箱孵育24 h。电子显微镜观察人脐静脉内皮细胞(3 7℃、43 ℃)线粒体改变,应用Annexin V-FITC/PI双染色方法检测不同温度热应激后细胞凋亡率、Western blot 检测细胞色素C、caspase-9、caspase-3蛋白表达。结果 电镜观察对照组(37 ℃)HUVEC细胞线粒体结构基本正常。热应激后(43 ℃)HUVEC细胞线粒体肿胀并出现结构改变;与对照组比较,39℃热应激对内皮细胞凋亡无明显影响(P>0.05),随着热应激温度的增加人脐静脉内皮细胞凋亡明显增多(41 ℃ 17.8%,4 3℃ 25.6%)并且细胞色素C、caspase-9、caspase-3蛋白表达明显增加(P<0.05)。结论线粒体通路的激活参与了热应激后人脐静脉内皮细胞凋亡的调控;血管内皮细胞凋亡可能与重症中暑的发病存在相关性。
【关键词】人脐静脉内皮细胞;凋亡;线粒体;热应激;重症中暑;细胞色素C;caspase-9、caspase-3
Mitochondrial apoptosis pathway involved in apoptosis of human umbilical vein endothelial cell after heat stress Li Li*, Gu Zhengtao,Liu Zhifeng,Su Lei. Department of Intensive Care Unit, The Third Affiliated Hospital of Southern Medical University, Guangzhou 510010, China
Corresponding authors: Su Lei,Email:sulei_icu@163.com
【Abstract】ObjectiveTo observe the expressions of cytochrome C, Caspase-9, Caspase-3 and their relationships, and investigate apoptosis signal transduction mechanism after heat stress-induction in human umbilical vein endothelial cell(HUVEC), and explore pathogenesis of vascular endothelial damage in the wake of severe heat stroke. Methods Human umbilical vein endothelial cell heat stress model was set up. Control group were incubated at 37°C, while heat stress group of cells were incubated at 39°C, 41°C, and 43°C for 2h, then all the cells were further incubated at 37°C for 24 h. Mitochondria of human umbilical vein endothelial cell were examined with electron microscopy.Apoptosis was analyzed by flow cytometry using Annexin V-FITC/PI staining, and protein levels of cytochrome C, caspase-9, caspase-3 were analyzed by western blot. Results In the control group (37°C), the structure of mitochondrial was intact in HUVEC under transmission electron microscope. In contrast, mitochondrial swelling was found in the group of 43°C heat stress. Compared with control group, as increasing in heat stress temperature, the rates of induced apoptosis were 17.8% at 41℃ and 25.6% at 43℃, and the levels of cytochrome C, Caspase-9, and caspase-3 were significantly increased(P<0.05).There was no obvious change at 39℃ heat stress (P>0.05).ConclusionsMitochondrial apoptosis pathway is involved in apoptosis of human umbilical vein endothelial cells in the wake of heat stress. The vascular endothelial cells apoptosis may be associated with the occurrence of severe heat stroke.
【Key words】Human umbilical vein endothelial cell;Apoptosis; Mitochondrial;Heat stress;Severe heatstroke;Cytochrome C;Caspase-9;Caspase-3
重症中暑(severe heatstroke)是一种高发病率和高病死率的急性重症疾病,主要表现为:中心体温>40 ℃,谵妄、抽搐或昏迷,常合并多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)<sup>[1-2]</sup>。随着对于重症中暑认识的不断深入,血管内皮细胞(vascular endothelial cells,VEC)在重症中暑发病中的作用越来越得到重视,其结构及功能损伤是引发MODS等严重并发症的重要因素<sup>[3-4]</sup>。目前的研究以描述重症中暑与VEC损伤表象之间的相关性为主,机制方面的研究报道较少。尽管,重症中暑发病机制并不完全明确,但越来越多的研究已经证实高热可诱导机体细胞出现大量凋亡<sup>[5-6]</sup>。本研究旨在通过观察热应激后细胞色素C、caspase-9和caspase-3在人脐静脉内皮细胞的表达及相互关系,阐明热应激后人脐静脉内皮细胞凋亡的信号转导机制,探讨重症中暑所致血管内皮损害的发病机理。
1材料与方法
1.1仪器
A200144 CO<sub>2</sub>孵箱 (中国 上海艾测电子科技有限公司);倒置相差显微镜(德国Leica)、荧光显微镜(德国Leica)、透射电子显微镜(FEI Tecnai G212, Holland)、数据处理系统( DMR) 图像分析(德国Leica);流式细胞仪为美国BD公司产品;酶标光度计为美国BIO-RAD产品;贝克曼GS-15R高速冷冻离心机( 美国)。
1.2人脐静脉内皮细胞株培养
人脐静脉内皮细胞株(HUVEC )为广州军区广州总医院医学实验科创建并保存。HUVEC细胞培养于含600 mg/mL葡萄糖的DMEM加10%胎牛血清、100 kU/L青霉素、100 mg/L链霉素的培养液中。将细胞置于37 ℃、体积分数5%CO<sub>2</sub>及饱和湿度条件的孵箱中培养。约2~3 d进行1次传代,传代按1∶2~1∶3的比例进行。细胞长至对数生长期后进行实验。
1.3热应激后细胞存活率测定
取对数生长期HUVEC细胞,按5×104/孔密度铺入96孔板,待细胞贴壁稳定后进行热应激处理。对照组将细胞置于标准37 ℃、5%CO<sub>2</sub>细胞培养箱2 h,热应激组分别置于39 ℃、41 ℃、43 ℃细胞培养箱中2 h,各组分别设置5个复孔。热应激后继续在37 ℃、5%CO<sub>2</sub>细胞培养箱孵育24 h后加入CCK8(碧云天)10 μL/孔,操作参考说明书。用酶联免疫检测仪于450 mm 处读取吸光度值,计算细胞存活率。实验分别独立重复3次。
1.4电子显微镜HUVEC细胞切片制备
热应激组为将细胞置于43℃ 孵育2h,对照组37℃孵育 2h,热应激后分别继续在细胞培养箱孵育24h。收集细胞,并用戊二醛固定,常规方法制作超薄切片(0.1μm),醋酸铀、柠檬酸铅染色,透射电子显微镜观察。
1.5Annexin V /PI流式细胞仪检测细胞凋亡
热应激组为将细胞置于39 ℃、41 ℃、43 ℃ 孵育2 h,对照组37 ℃孵育 2 h,热应激后分别继续在细胞培养箱孵育24 h。使用Annexin V/PI试剂盒(invitrogen),按说明书进行操作,调整待检测细胞浓度为1×106/mL,冰PBS润洗两次2次,将细胞重悬于100 μL含2 μL Annexin-V-FITC(20 μg/mL) 缓冲液中轻轻混匀,避光室温放置15 min,转至流式检测管,加入400 μLPBS,每个样品临上机前加入1 μL PI(50μg/mL),2 min后迅速检测。流式细胞仪检测激发波长Ex=488 nm;发射波长Em=530 nm。
1.6细胞色素C、caspase-9、caspase-3表达
收集对照组与热应激组的细胞,按细胞组分分离试剂盒说明书提取线粒体与细胞质。BCA法定量后,SDS聚丙烯酰胺凝胶电泳后,将蛋白转移至硝酸纤维素膜,5%脱脂奶粉室温封闭2 h,洗膜后加入一抗鼠来源细胞色素C抗体(1∶200,Cell Signaling Technology)、caspase-9兔来源激活型抗体(1∶1000,Cell Signaling Technology)、caspase-3兔来源激活型抗体(1∶1000,碧云天),4 ℃过夜,TBST洗三遍后,加入二抗结合有辣根过氧化物酶标记的羊抗鼠/兔抗体(1∶5000, 碧云天),室温孵育2 h后使用化学发光剂ECL(Amersham公司)进行反应、曝光。
1.7统计学方法
采用SPSS 13.0统计软件包进行分析。计量资料,在方差齐性的基础上应用单因素方差分析(one-way ANOVA), 组间差异用LSD法比较, P<0.05为差异具有统计学意义。
2结果
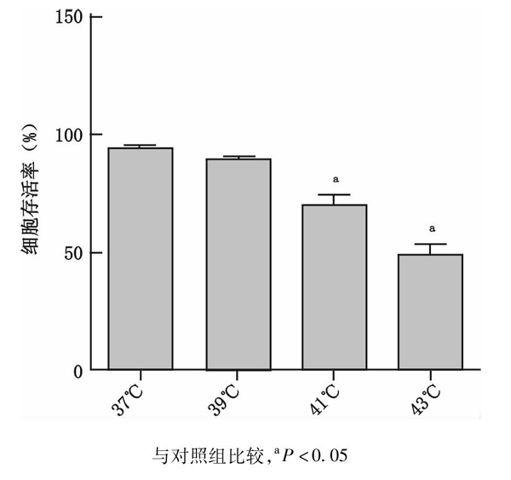
2.1热应激后HUVEC细胞活力下降
39 ℃(89.67±1.86)热应激对HUVEC细胞活力无影响(P=0.023),但随着热应激温度的不断提高(41 ℃:70.17±4.30,43 ℃:48.17±5.49),HUVEC细胞活力呈现出进行性下降趋势,与对照组(37 ℃:94.83±0.75)比较差异具有统计学意义(P=0.05),见图1。
与对照组比较,aP<0.05
图1不同温度热应激后HUVEC细胞存活率检测
Fig1Cell viability of HUVEC at different temperature during heat stress
2.2电子显微镜观察热应激后HUVEC细胞线粒体变化
对照组(37 ℃)HUVEC细胞线粒体结构基本正常。热应激后(43 ℃)HUVEC细胞线粒体肿胀,其双层膜和嵴结构消失,线粒体基质均质化改变(线粒体嵴溶解物、基质及含染色质物质相混合在一起形成致密均质团块物),见图2。
与对照组比较,aP<0.05
图2不同温度热应激后HUVEC细胞线粒体改变
Fig2Mitochondrial change in HUVEC at different temperature during heat stress
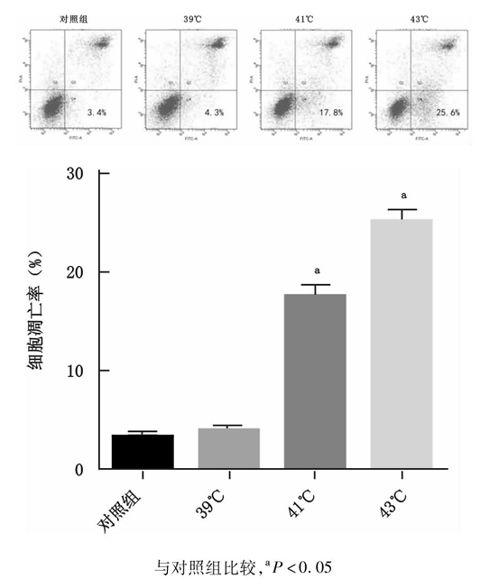
2.3热应激后HUVEC细胞凋亡增加
与对照组37 ℃(3.4±0.36)比较,39 ℃(4.3±0.40)热应激组并未发现细胞凋亡有明显增加(P=0.339),但在41 ℃、43 ℃热应激后细胞凋亡开始明显增加,细胞凋亡显示出热应激后温度依赖性增加(41 ℃:17.8±1.53,43℃:25.45±1.97),与对照组(37 ℃)比较差异具有统计学意义(P=0.05),见图3。
与对照组比较,aP<0.05
图3不同温度热应激后HUVEC细胞凋亡比较
Fig3Comparison of apoptotic HUVEC at different temperature during heat stress
2.4线粒体通路的激活参与了热应激后HUVEC细胞凋亡的调控
Western blot检测发现,39 ℃热应激组线粒体中细胞色素C蛋白水平无显著下降,胞质内细胞色素C、caspase-9、caspase-3表达无明显升高,与对照组37 ℃比较差异无统计学意义(P=0.356、P=0.180、P=0.069);而随着热应激温度增加(41~43 ℃)线粒体中细胞色素C蛋白水平下降明显,胞质内的细胞色素C、 caspase-9、caspase-3表达显著增高,与对照组37 ℃比较差异具有统计学意义(41 ℃:P=0.001、0.001、0.001,43 ℃:P=0.001、0.001、0.001,图4),其趋势与细胞凋亡趋势一致,推测线粒体通路的激活参与了热应激后HUVEC细胞凋亡的调控。
与对照组比较,aP<0.05
图4HUVEC细胞在不同温度热应激后细胞色素C、caspase-9、caspase-3蛋白比较
Fig2Comparison of cytochrome C ,caspase-9,caspase-3in HUVEC at different temperature during heat stress
3讨论
血管内皮细胞广泛分布于全身各个部位,对血管内环境稳定的维持和各组织器官正常功能的发挥起着重要作用。血管内皮细胞损伤可由多种刺激引起,其中凋亡是血管内皮损伤的重要机制之一<sup>[3]</sup>。重症中暑时内皮细胞损伤较早,其损伤可以启动弥散性血管内凝血、诱发微循环障碍,最终导致MODS<sup>[4,7-8]</sup>。研究发现,高温和热辐射可以诱导细胞凋亡,并在重症中暑病理生理过程中起着非常重要的作用<sup>[5]</sup>。本实验发现,随着热应激温度的增加(37~43 ℃),HUVEC细胞凋亡的发生不断增加,尤其是43 ℃热应激可导致HUVEC细胞发生大量凋亡,与笔者前期结果一致<sup>[9-10]</sup>,进一步研究发现,线粒体通路的激活与热应激诱导的HUVEC凋亡密切相关。
线粒体是真核细胞生命活动的中心,它不仅仅是细胞赖以生存的产能场所,同时也是调控细胞凋亡时重要的细胞器,在细胞凋亡中处于中心地位<sup>[11-12]</sup>。细胞色素C是线粒体中第一个被鉴定出来的细胞凋亡分子<sup>[13]</sup>,它从线粒体释放到胞浆,被认为是线粒体途径介导凋亡信号通路中的关键事件<sup>[14-17]</sup>。笔者的实验发现,随着热应激温度的增加(41~43 ℃),HUVEC细胞线粒体中细胞色素C逐渐降低,在43 ℃热应激时表达最低,而胞质中细胞色素C呈相反表达,表现为随着热应激温度的增加,细胞色素C表达不断增高,从而证实了HUVEC细胞经过热应激后可以将细胞色素C从线粒体释放到胞质,推测细胞色素C的释放参与诱导了热应激后HUVEC细胞凋亡的发生。
在哺乳动物中,caspase家族已发现14种同源分子caspase1-14,作为凋亡的中心执行者caspase家族在凋亡过程中大致分为启动caspase和效应 caspase 两类,其中caspase-9是细胞凋亡的启动者之一,caspase-3 是细胞凋亡的主要效应执行者,一旦活化,凋亡不可逆转<sup>[18-19]</sup>。当凋亡信号传至线粒体时,线粒体释放细胞色素C,胞浆中的细胞色素C与凋亡蛋白酶活化因子-1(apoptosis protease activating factor 1,APAF-1) 结合<sup>[20]</sup>,使其形成多聚体,并促使caspase-9 与其结合形成凋亡体(apoptosome),激活caspase-9。激活的caspase-9 激活凋亡的效应执行着caspase-3 ,从而诱导凋亡级联反应<sup>[21]</sup>。本实验发现HUVEC细胞经过热应激后,细胞色素C从线粒体释放至胞浆,随着热应激温度增加(41~43 ℃)caspase-9、caspase-3表达也随之增加,并与胞浆中细胞色素C表达相一致,提示线粒体途径参与了热应激后HUVEC细胞凋亡的发生。
随着全球气候变暖,以及世界范围内热浪强度和频度的增加,推测重症中暑的发病率及病死率将会进一步攀升,因此深入研究重症中暑的发病机制具有深刻的现实意义。本实验通过观察热应激后细胞色素C、caspase-9和caspase-3在人脐静脉内皮细胞的表达及相互关系,发现线粒体通路的激活参与了热应激后人脐静脉内皮细胞凋亡的调控;血管内皮细胞凋亡可能与重症中暑的发病存在相关性。本实验只研究了线粒体途径参与的热应激后HUVEC细胞凋亡的发生,并不排除其他非线粒体途径凋亡信号转导通路的存在。
参考文献
[1]Bouchama A,Knochel JP.Heat stroke [J].N Engt J Med,2002,346(25):1978-1988.
[2]苏磊.重症中暑防治回顾与启示[J].解放军医学杂志,2011,36(9):883-885.
[3]Winn RK,Harlan JM. The role of endothelial cell apoptosis in inflammatory and immune diseases [J].Thrombosis and Haemostasis,2005,3(8):1815-1824.
[4]耿炎,彭娜,苏磊,等.热打击对培养人脐静脉内皮细胞增殖能力的影响 [J].感染、炎症、修复,2013,14:7-10.
[5]Roberts GT, Ghebeh H, Chishti MA,et al. Microvascular Injury, Thrombosis, Inflammation, andApoptosis in the Pathogenesis of Heatstroke A Study in Baboon Model [J]. Arterioscler Thromb Vasc Biol ,2008,28(6):1130-1136.
[6]Pallepati P, Averill-Bates DA. Mild thermotolerance induced at 40 ℃ protects HeLa cells against activation of death receptor-mediated apoptosis by hydrogen peroxide [J]. Free Radical Bio Med ,2011,50(6): 667-679.
[7]Plumier JC, Robertson HA, Currie RW. Differential accumulation of mRNA for immediate early genes and heat shock genes in heart after ischemic injury [J]. Mol Cell Cardiol,1996,28(6):1251-1260.
[8]荣鹏,孟建中,陈宇.热射病的发病机制及防治策略的研究新进展[J].生物医学工程研究,2010,29(4):287-292.
[9]Gu ZT, Wang H, Li L, et al. Heat stress induces apoptosis through transcription-independent p53-mediated mitochondrial pathways in human umbilical vein endothelial cell [J]. Sci Rep,2014,4:4469.
[10]李莉,古正涛,刘志锋,等. Caspase-3在热打击诱导人脐静脉内皮细胞凋亡中的作用[J].实用医学杂志,2014,30(6):871-874.
[11]Zamzami N,HirschT,DallaportaB,et al. Mitochondrial implication inaccidental and programmedcell death: apoptosisandnecrosis [J].J Biomembranes,1997,29(2):185-193.
[12]An WW,Wang MW,Tashire S,et al. Norcantharidin induces human melanoma A375-S2 cell apoptosis througll mitoehondrial and caspase pathways [J].J Kaorean Med Sci,2004,19(4):560-566.
[13]Nakatsuka H,Ohm S,Tanaka J,et al.Cytochrome c release from mitochondria to the eytosol was suppressed in the ischemia-tolerance-induced hippocampal CAl region after 5-min forebrain ischemia in gerbils [J].Neuresc Lett,2000,278(1/2):53-56.
[14]Liu X, Kim CN, Yang J,et al. Inductionof apoptosis program in cel-free extracts: requirement for dATP and cytochrome c [J]. Cell,1996,90(86): 147-157.
[15]Arnoult D, Peron P, Martinou J,et al. Mitochondrial release of apoptosis-inducing factor occurs downstreamof cytochrome c release in response to several proapopto tic stimuli [J]. J Cell Biol,2002,159 ( 6) : 923-992.
[16]Liu LJ, Peng JX, Liu KY,et al. Influence of cytochrome C on apoptosis induced by Anagrapha ( Syngrapha) falcifera multiple nuclear polyhedrosis virus ( NPV) in insect Spodoptera litura cells [J]. Cell Biology International,2007,31 ( 4) : 996-1001.
[17]姜云龙,赵光举,应岚,等. 姜黄素对脓毒症小鼠淋巴细胞凋亡的作用及机制研究[J]. 中华急诊医学杂志,2014,23(7):781-785.
[18]焦俊霞,高维娟. 细胞凋亡的信号转导机制究进展[J].中国老年学杂志,2010,30(6):853-856.
[19]刘云松,邓旭斌,苏磊. 活性氧在热打击诱导神经元细胞凋亡中的作用[J]. 中华急诊医学杂志,2014,23(6):647-651.
[20]Yoshida H. Apaf-1 is required for mitochondrial pathways of apoptosis and brain development [J]. Cell,2002,94(6): 739-750.
[21]Oshitari T, Yamamoto S, Ham N, et al. Mitochondria and caspase-dependent cell death pathway involved in neuronal degeneration in diabetic retinopathy [J].Br J Ophthalmol,2008,92(4):552-556.
(收稿日期:2014-06-04)
(本文编辑:何小军)
p1322-1326

