γ-聚谷氨酸发酵液预处理及提取纯化工艺
贺杨扬,曾 伟,王青龙,陈桂光,梁智群,*
(1.广西大学,生命科学与技术学院,广西南宁530004;2.广西大学亚热带农业生物资源保护与利用国家重点实验室,广西南宁530004)
γ-聚谷氨酸发酵液预处理及提取纯化工艺
贺杨扬1,2,曾 伟1,2,王青龙1,2,陈桂光1,2,梁智群1,2,*
(1.广西大学,生命科学与技术学院,广西南宁530004;2.广西大学亚热带农业生物资源保护与利用国家重点实验室,广西南宁530004)
采用醇析和盐析结合的方法提取γ-PGA粗品。最佳稀释倍数为2倍,硅藻土和粉末活性炭(颗粒活性炭)用量分别定为10g/L和10g/L(15g/L),在室温下抽滤最佳pH为3.0。用5%NaCl和一倍体积乙醇提取γ-PGA,经过冷冻真空干燥可得到白色颗粒状γ-PGA粗品,提取率为95.21%,纯度可达96.89%,大大降低了乙醇用量,节约了生产成本。
γ-聚谷氨酸,预处理,硅藻土,活性炭,提取
γ-聚谷氨酸(poly-γ-glutamic acid,γ-PGA)是自然界中微生物来源的一种强水溶性多聚高分子化合物,具有良好的生物可降解性、生物相容性、可食用性、低免疫原性、保湿性等[1],对人体和环境无毒无公害,可广泛应用于工业、农业、食品、医药、化妆品等领域[2-3]。随着γ-PGA在很多新领域中的应用拓展,其相关研究越来越受到人们关注。国内许多学者研究提取制备γ-PGA的方法,但是发酵液粘度高,菌液分离难度大,发酵液成分复杂,纯化难度较大,以致纯化成本高。目前,常用的除菌方法主要有高速离心法、絮凝法和微孔滤膜法等。但每种方法都存在一定的局限性,不能有效应用于工业化生产中。要想得到纯度高的γ-PGA,菌液分离是关键步骤。γ-PGA提取方法主要有有机溶剂沉淀法、铜盐沉淀法和膜分离沉淀发,Do等[4]采用酸化、离心、微滤、超滤浓缩、醇析、真空干燥的方法有效提取γ-PGA,与传统的醇析相比,节省了乙醇用量,降低了生产成本。目前,常用的γ-PGA提取方法是乙醇提取法,一般添加2~4倍体积乙醇[5-7]。Jin人发现,乙醇用量的多少与γ-PGA浓度有关,γ-PGA浓度增加,乙醇用量将显著减少。采用超滤浓缩方法增加γ-PGA浓度[8],高浓度的γ-PGA有助于减少乙醇的用量及后期酒精回收的能耗,减少生产成本。因此,如何建立一条高效、经济的γ-PGA提取纯化工艺,是今后国内亟待解决的课题之一。
本实验对Bacillus subtilis GXA-28微生物发酵得到的发酵液进行预处理,利用稀释和酸化发酵液降低体系粘度,加入适量硅藻土和活性炭有效地除去发酵液中的菌体和杂蛋白等。采用醇析和盐析结合的方法提取γ-PGA,不仅能有效减少乙醇用量而且得到高纯度的γ-PGA粗品,建立了一条高效可行且经济的γ-PGA提取纯化工艺路线。
1 材料与方法
1.1 材料与仪器
枯草芽孢杆菌 本实验室自主筛选枯草芽孢杆菌GXA-28(B.subtilis GXA-28)[9],菌株保藏编号CCTCC M 2012347;种子培养基(g/L) 葡萄糖10,酵母膏5,谷氨酸钠5,KH2PO40.5,MgSO4·7H2O 0.1,蒸馏水1L,pH6.5±0.5;斜面培养基(g/L) 成分同种子培养基,加琼脂粉15,蒸馏水1L,pH6.5±0.5;发酵培养基(g/L) 葡萄糖30,酵母膏2.5,谷氨酸钠20,KH2PO40.5,MgSO4·7H2O 0.1,蒸馏水1L,pH6.5±0.5。
J2-21型高速冷冻离心机 美国BECKMAN公司;HH4-数显恒温水浴锅 国桦电器有限公司;HVE-50自动灭菌锅 日本HIRAYAMA公司;320pH Meter Merter Toledo 梅特勒-托利多仪器(上海)有限公司;NDJ-8S型旋转粘度计 上海平轩科学仪器有限公司;SKY-211C型摇床 上海苏坤实业有限公司;SHB-III型抽滤真空泵 郑州长城科工贸有限公司。
1.2 实验方法
1.2.1 培养方法
1.2.1.1 种子培养 取一环斜面菌种接于种子培养基中,42℃,160r/min,恒温振荡培养16h。
1.2.1.2 发酵培养 按2%接种量吸取种子液接于发酵培养基中,42℃,160r/min,恒温振荡培养22h。
1.2.2 发酵液的预处理
1.2.2.1 温度和pH的选择 温度对发酵液粘度有一定的影响,因此,在20、30、40℃下分别考察pH为2.0、3.0、4.0、5.0、6.0、7.0、8.0时,温度和pH对发酵液粘度的影响。
1.2.2.2 稀释体积的选择 将γ-PGA发酵液(初始体积为V),加入不同体积去离子水稀释,稀释倍数依次为2、3、4、5、6、7,分别将稀释液进行离心和抽滤,比较离心和抽滤对发酵液预处理的影响。
1.2.2.3 pH的选择 pH对γ-PGA发酵液粘度影响很大,发酵液粘度不宜过高,否则不利于抽滤,也不宜过低,否则会破坏γ-PGA分子结构。因此,分别调pH为2.0、2.5、3.0、3.5、4.0、4.5。
1.2.2.4 硅藻土添加量的确定 在等体积γ-PGA发酵酸化液中分别加入5、10、15、20、25、30g/L硅藻土,充分搅拌,在相同条件下抽滤,将没有添加硅藻土的发酵液作为对照,取少量发酵液12000r/min,离心20min,除菌体和杂质得到上清液,比较抽滤和离心除菌和除杂蛋白的效果,同时比较两种方法对γ-PGA回收率的影响。
1.2.2.5 活性炭浓度的确定 脱色剂种类和浓度对发酵液预处理有重要影响,因此通过比较粉末活性炭和颗粒活性炭对菌体量、杂蛋白含量及γ-PGA回收率的影响,从而选出最佳浓度的脱色剂。粉末活性炭浓度为1、5、10、15、20、25g/L,活性炭颗粒浓度依次为5、10、15、20、25、30g/L。
1.2.2.6 硅藻土和活性炭用量比例的确定 将硅藻土的浓度定为10g/L,粉末活性炭和颗粒活性炭的用量依次为:5、10、15、20、25、30g/L。通过抽滤除菌、除杂蛋白等,硅藻土用量相同的条件下,比较不同用量活性炭对发酵液预处理的影响。
1.2.3 γ-PGA的提取 将预处理的发酵液直接醇析得到的是酸型的γ-PGA,将发酵液回调pH至6~7后再醇析得到的是钠盐型γ-PGA。本实验采用NaCl和乙醇共同提取γ-PGA的方法,取20mL预处理发酵液,通过控制NaCl和乙醇的用量,经冷冻真空干燥后,可得到颗粒状γ-PGA粗品。比较NaCl浓度为0%、1%、2%、3%、4%、5%、6%、7%条件下,得到不同分子形态的γ-PGA需要乙醇的用量。
1.2.4 测定方法
1.2.4.1 γ-PGA浓度测定 参考文献[10]。
1.2.4.2 多糖含量测定 硫酸苯酚法[11]。
1.2.4.3 杂蛋白含量的测定 考马斯亮蓝G-250法[12]。
1.2.4.4 菌体量测定 发酵液经蒸馏水稀释10倍,660nm下测定吸光度。
1.2.4.5 粘度测定 取400mL发酵液至于500mL烧杯中,采用NDJ-8S型旋转粘度计,4号转子,转速60r/min。
1.2.4.6 细胞干重测定 称重法。将真空干燥后得到的粗品用万分之一克电子天平称重并减去离心管质量即得到γ-PGA粗品质量。
1.2.5 计算公式 如下所示:
除菌率(%)=(原发酵液OD660-除菌后发酵液的OD660)/原发酵液的OD660×100
除杂蛋白率(%)=(原发酵液杂蛋白浓度-除菌后发酵液杂蛋白浓度)/原发酵液杂蛋白浓度×100
γ-PGA回收率(%)=除菌后发酵液γ-PGA浓度/原发酵液γ-PGA浓度×100
γ-PGA提取率(%)=γ-PGA干重/发酵后γ-PGA产量×100
γ-PGA纯度(%)=0.1g烘干的γ-PGA复溶后OD216测得的浓度/100μg/mL×100
2 结果与讨论
2.1 发酵液的预处理
2.1.1 温度和pH对γ-PGA发酵液粘度的影响 初始发酵液为淡黄色粘稠状液体,pH在5.6左右,发酵液中γ-PGA产量较高(约19g/L),由于初始发酵液粘度很高,分离纯化困难。Jin[4]在35℃下,将发酵液pH调至3.0,粘度下降,有利于提取分离γ-PGA。实验结果如图1所示。
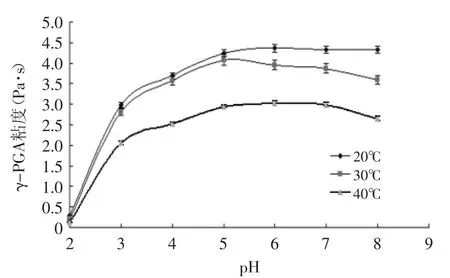
图1 温度和pH对发酵液粘度的影响Fig.1 Effect of temperature and pH on liquid viscosity
由图1可知,随着pH的降低,发酵液粘度显著减少,20℃,pH2.0时,发酵液的粘度仅为0.29Pa·s。这是由于在酸性溶液中,γ-PGA的分子构象为规则的β片层结构,在中性环境中为无规则卷曲状,而在碱性环境中为卷曲螺旋的随机构造[13]。在较低pH下,细胞间的电荷排斥作用减少,γ-PGA与水分子相互作用减弱发生聚集,从而实现菌液分离,缩短离心时间,降低能耗[14]。同一pH条件下,随着温度升高,发酵液粘度降低,这是由于水分子获得了较高的热能,消弱了γ-PGA分子间的束缚作用,同时温度升高使得γ-PGA分子长链发生断裂造成的。提高温度或调节pH可以有效地降低发酵液粘度,有利于离心除菌体,温度过低或者pH过低破坏了γ-PGA的分子结构,通过实验结果可知,在室温下酸化处理即能满足有效降低发酵液粘度。pH<3.0时,γ-PGA分子易发生自身降解,实验中采用稀盐酸调pH至3.0,室温静置60min[15],得到酸化液,用于后续工艺提取。
2.1.2 稀释倍数对发酵液预处理的影响 比较离心和抽滤对菌体量、蛋白含量的影响,实验结果见图2~图4。

图2 抽滤和离心对发酵液中菌体量的影响Fig.2 Effect of suction filter and centrifugal bacterium on the bacteria volume
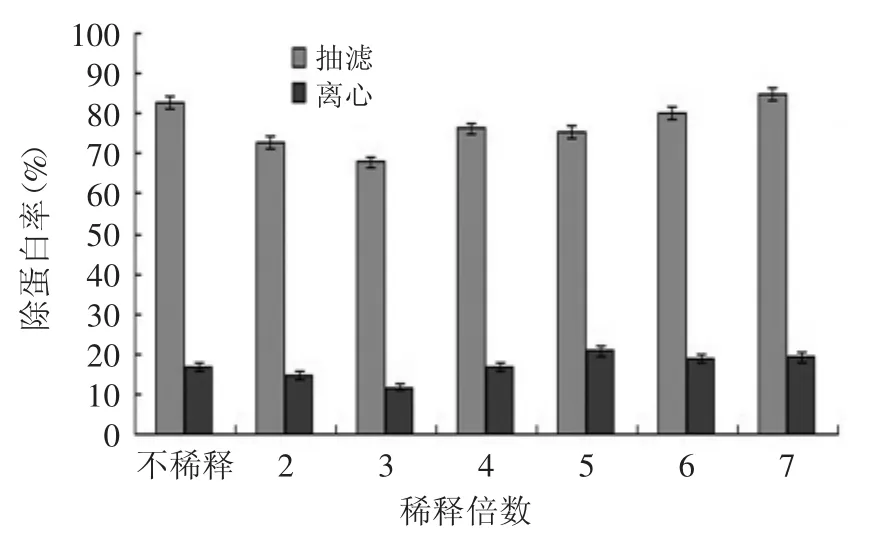
图3 抽滤和离心对发酵液中蛋白含量的影响Fig.3 Effect of suction filter and centrifugal on protein content in the fermented liquid
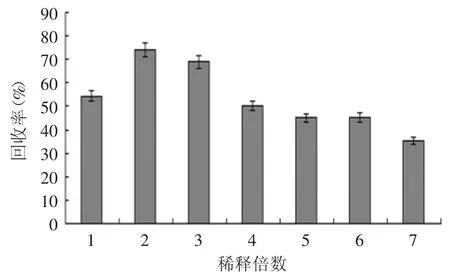
图4 不同稀释倍数对γ-PGA回收率的影响Fig.4 The influence of different diluted multiples of γ-PGA recovery rate
由图2可知,不稀释或稀释倍数较小时,抽滤除菌率比离心除菌率要高很多,因为发酵液较粘稠,致使菌体和γ-PGA缠绕在一起,离心时,菌体不易被离心。但当稀释体积超过原体积4倍时,发酵液粘度下降,抽滤和离心除菌的效果相差不大。
从图3可知,用涂有硅藻土涂层的抽滤装置进行抽滤时,能够除去发酵液中大部分蛋白,而离心仅能除去一小部分蛋白,并且离心不适合用于工业化大规模生产,难以实现彻底的菌液分离且杂蛋白很难有效被除去,因此,我们将选用抽滤来进行发酵液预处理。
由图4可知,发酵液不稀释时,γ-PGA浓度较高,分子间容易相互缠绕,容易被截留在硅藻土涂层上,导致回收率较低,随着稀释倍数的增加,发酵液粘度降低,虽有利于菌液分离,但是γ-PGA回收率不高。发酵液酸化后再进行稀释,为原体积2倍时,回收率达到最高为74.1%,因此最佳稀释倍数为原体积两倍。
2.1.3 pH对抽滤的影响 随着pH降低,发酵液粘度逐渐下降。由图5可知,除菌率和除杂蛋白率随pH下降而逐渐上升,这是因为粘度低的发酵液有利于菌液分离,彻底的除去菌体和杂蛋白。pH<3.0时,γ-PGA的损失较多,回收率较低,γ-PGA的等电点为3.47附近,pH<3.0时,γ-PGA分子结构遭到破坏。而pH>3.5时,回收率也下降,一方面是因为在γ-PGA的等电点附近,其溶解度小,容易被硅藻土吸附,另一方面是因为发酵液粘度较大,γ-PGA分子容易缠绕而易被截留在硅藻土涂层上。因此,最佳pH为3.0,γ-PGA回收率为87.89%。

图5 pH对γ-PGA发酵液预处理的影响Fig.5 The impact of pH on the pretreatment of gamma-PGA fermented liquid
2.1.4 硅藻土用量对发酵液预处理的影响 硅藻土是常用的吸附剂,能有效除去发酵液中菌体和杂蛋白。由表1可知,离心虽然能分离菌体,降低发酵液浊度,但经过镜检发现除菌并不彻底,并且离心不能有效除去发酵液中的杂蛋白。加入硅藻土作为吸附剂显著降低了发酵液浊度和杂蛋白含量,因为硅藻土在搅拌过程中充分与发酵液接触且容易沉积形成密实的硅藻土涂层,有利于发酵液中菌体截留和杂蛋白吸附。从结果上看,随着硅藻土浓度增加,对菌体和杂蛋白的影响并不是很显著,基本处在较低的恒定的水平。但是硅藻土浓度增加对γ-PGA回收率有一定影响,添加过多,将引起回收率下降,因此选择10g/L硅藻土作为吸附剂,γ-PGA回收率可达99.1%。

表1 不同浓度的硅藻土对发酵液预处理的影响Table.1 The influence of different concentrations of diatomite in fermented liquid pretreatment
2.1.5 粉末活性炭和颗粒活性炭对发酵液预处理的影响 活性炭种类和浓度对菌体量吸附、杂蛋白去除及γ-PGA回收率的影响,实验结果见表2。
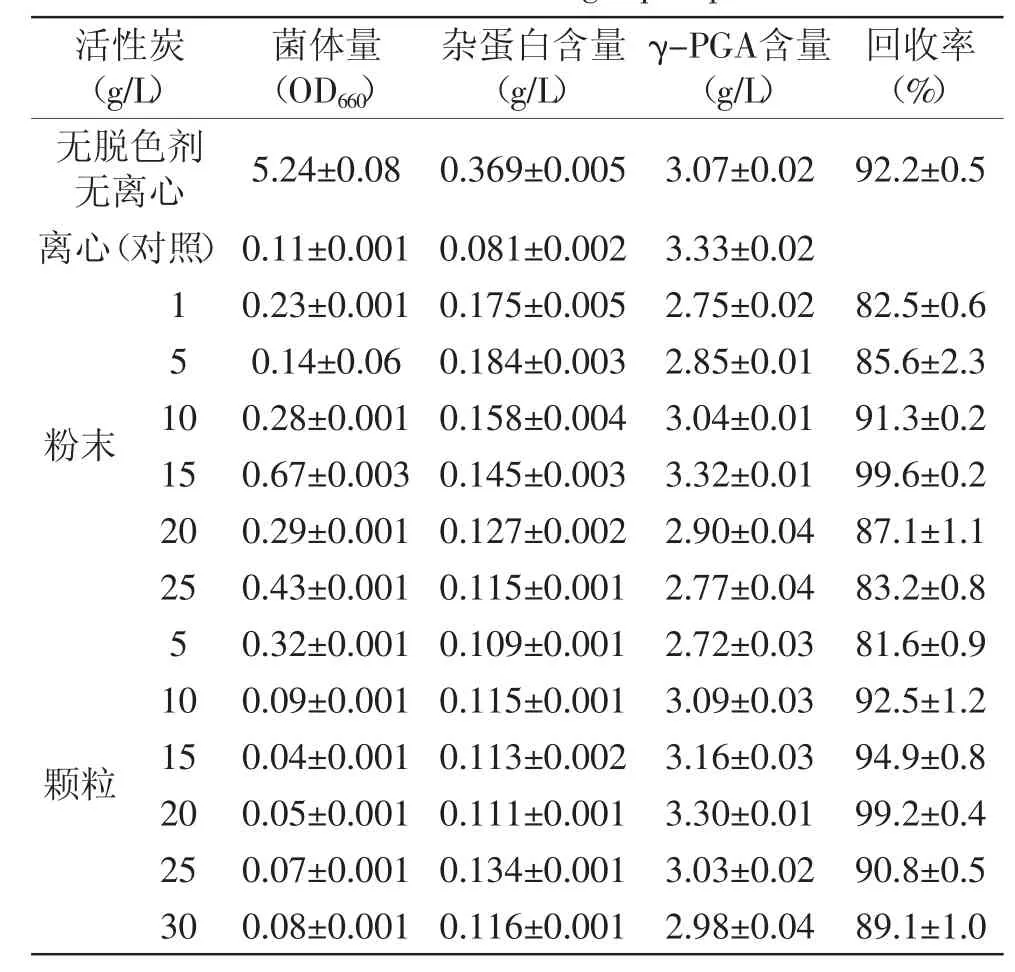
表2 粉末活性炭和颗粒活性炭对发酵液预处理的影响Table.2 Effect of powder activated carbon and granular activated carbon on fermenting liquid pretreatment
由表2可知,颗粒活性炭比粉末活性炭脱色效果稍好,除菌更彻底。但当活性炭浓度均为15g/L时,粉末活性炭γ-PGA回收率最高,达到99.6%;而颗粒活性炭在浓度为20g/L时,γ-PGA回收率最高,达到99.2%。与表1进行对比可知,加了活性炭的发酵液经抽滤除菌效果比不加活性炭的明显要好很多,发酵液非常透明澄清,而加了硅藻土的发酵液经过抽滤,滤液中杂蛋白含量比不加硅藻土处理的明显少很多,因此,硅藻土对杂蛋白的吸附有显著效果,而活性炭对菌体和杂质的吸附也具有显著效果。
2.1.6 硅藻土和活性炭对发酵液预处理的影响 由之前的实验结果可知,硅藻土的浓度对γ-PGA回收率的影响不是很显著,而活性炭的用量对γ-PGA回收率有较大的影响,因此合适用量的活性炭对预处理很关键,实验结果见表3。

表3 硅藻土浓度为10g/L时活性炭对发酵液预处理的影响Table.3 Effect of activated carbon on fermenting liquid pretreatment when the concentration of diatomaceous earth is 10g/L
由表3可知,在硅藻土浓度为10g/L时,活性炭浓度过高对发酵液影响较大,γ-PGA损失较多。粉末活性炭浓度为10g/L时,γ-PGA回收率为98.9%;颗粒活性炭浓度为15g/L时,γ-PGA回收率为99.4%。活性炭的用量超过10g/L时,对菌体量和杂蛋白含量影响并不显著,因此,在硅藻土和活性炭配合使用时,将硅藻土和粉末活性炭(颗粒活性炭)用量分别定为10g/L和10g/L(15g/L)。
2.2 γ-PGA醇析和盐析
由表4可知,当NaCl添加量相同时,乙醇用量不同会得到不同形态γ-PGA粗品,乙醇量过多,将会导致γ-PGA呈絮状析出,乙醇量过少,γ-PGA无法析出。因此,可以通过控制乙醇量选择生产需要的形态γ-PGA粗品。不加入NaCl时,得到颗粒状γ-PGA粗品需要三倍体积乙醇,而随着NaCl浓度增加,所需乙醇用量也逐渐减少,NaCl浓度超过5%时,只需一倍体积乙醇就能得到颗粒状γ-PGA粗品,大大节省了乙醇用量,降低了生产成本。
2.3 γ-PGA粗品性状分析
用盐析和醇析方法析出γ-PGA后,经过处理,γ-PGA粗品回收率可达90%左右,所得到的γ-PGA粗品为白色的颗粒状,吸水性极强,其水溶液无色无味。经过硅藻土和活性炭预处理,γ-PGA粗品水溶液中杂蛋白、多糖等杂质含量较少,均小于5%,几乎不含菌体。随着NaCl浓度增加,乙醇用量显著减少,当NaCl浓度超过5%,乙醇用量基本处于稳定。继续加大NaCl浓度,将不会显著减少乙醇用量。NaCl和乙醇用量不同,得到的γ-PGA粗品的性状也会有所差异,γ-PGA粗品性状分析见表5。

表4 不同用量的乙醇和NaCl对γ-PGA产物形态的影响Table.4 Effect of different dosage of ethanol and NaCl on γ-PGA product forms

表5 γ-PGA粗品性状分析Table.5 Analysis of the characteristics of γ-PGA
由表5可知,相同形态γ-PGA粗品中,γ-PGA提取率和纯度、多糖和杂蛋白含量略有差异,可能跟NaCl浓度有关系。不加NaCl,得到颗粒状γ-PGA粗品需要三倍体积乙醇,提取率和纯度均只有86.24%和88.49%,而5%NaCl和一倍体积乙醇提取γ-PGA,提取率和纯度最高,分别为95.21%和96.89%。γ-PGA粗品纯度和提取率有所提高,而且大大降低了乙醇用量,节约了工业成本和后续回收费用。
3 结论
采用稀释和酸化发酵液减低体系粘度,利用硅藻土和活性炭吸附发酵液中的菌体和杂蛋白等,用抽滤的方法替代离心,有效实现了菌液分离、脱色和杂蛋白去除。最佳稀释倍数为2倍,硅藻土和粉末活性炭(颗粒活性炭)用量分别定为10g/L和10g/L(15g/L),在室温下抽滤最佳pH为3.0。
利用盐析和醇析的结合,5%NaCl和一倍体积乙醇提取γ-PGA,经过冷冻真空干燥可得到白色颗粒状γ-PGA粗品,提取率为95.21%,纯度可达96.89%。相对于传统的提取工艺,本实验提取所需乙醇用量仅为一倍体积,大大降低了乙醇用量,节约了生产成本,为大规模工业化生产打下了坚实的基础。
[1]Sun MH,Park CP,Kim CJ,et al.Natural and edible Biopolymer poly-γ-glutamic acid:synthesis,production,and applications[J]. The Chemical Record,2005,5:352-366.
[2]Shih IL,Van YT.The production of poly-(γ-glutamic acid)from microorganisms and its various applications[J].Bioresour Technol,2001,79:207-225.
[3]Ashiuchi M.Occurrence and biosynthetic mechanism of poly-gamma-glutamicacid.Amino-AcidHomopolym[J]. Occurring Nat,2010,77:93.
[4]Jin Hwan Do,Ho Nam Chang,Sang Yup Lee.Efficient recovery of γ-poly(Glutamic acid)from highly viscous culture broth[J]. Biotechnol Bioeng,2001,76:219-223.
[5]桑莉,徐红,李晖,等.γ-聚谷氨酸产生菌的筛选机发酵条件[J].过程工程学报,2004,4(5):462-466.
[6]李文婧.γ-聚谷氨酸发酵及提取工艺研究[D].济南:山东轻工业学院,2010.
[7]梁金丰,徐红,姚俊,等.γ-聚谷氨酸提取的发酵液预处理及分离纯化工艺[J].食品与发酵工业,2009,35(3):6-11.
[8]徐华国,庄会华,林永贤,等.一种聚谷氨酸提取方法[P]. 2010-12-29.
[9]Zeng W,Lin YSH,Qi ZX,et al.An integrated high-throughput strategy for rapid screening of Poly(γ-glutamic acid)-producing bacteria[J].Appl Microbiol Biotechnol,2013,97:2163-2172.
[10]Zeng W,Chen GG,Zhang YK,et al.Studies on the UV spectrum of poly(γ-glutamic acid)based on development of a simple quantitative method[J].Int J Biol Macromol,2012,51:83-90.
[11]王文平,郭祀远,李琳,等.考马斯亮蓝法测定野木瓜多糖中蛋白质的含量[J].食品研究与开发,2008,29(1):115-117.
[12]王忠民,王跃进,周鹏.苯酚硫酸法测定葡萄多糖含量[J].新疆农业大学学报,2004,27(2):87-90.
[13]Ing-Lung Shih,I-Chung Fan,Ming-Hao Shen.Metheod for recovering and purifying polyglutamic acid[P].2005-2-17.
[14]Xu Hong,Jiang Min,Li Hui,et al.Efficient production of poly(γ-glutamic acid)by newly isolated Bacillus subtilis NX-2 [J].Process Biochemstry,2005,40(2):519-523.
[15]马霞,鞠蕾.一种发酵液中γ-聚谷氨酸的提取方法[P]. 2012-1-18.
Pretreatment and purification of poly-γ-glutamic acid from fermentation broth
HE Yang-yang1,2,ZENG Wei1,2,WANG Qing-long1,2,CHEN Gui-guang1,2,LIANG Zhi-qun1,2,*
(1.College of Life Science and Technology,Guangxi University,Nanning 530004,China;2.State Key Laboratory for Conservation and Utili Zation of Subtropical Agro-bioresources,Guangxi University,Nanning 530004,China)
By using alcohol precipitation and salting out to extract γ-PGA.The best dilution multiples was 2 times,the dosage of diatomaceous earth and powder activated carbon(granular activated carbon),respectively,10g/L and 10g/L(15g/L),the best pH value was 3.0 for suction filter under the room temperature.Using 5% NaCl and double volume of ethanol for extraction of γ-PGA,by frozen vacuum drying of γ-PGA,the sample was white and granular,extraction efficiency achieved 95.21%,purity was 96.89%,using this method,the production input had reduced and the dosage of ethanol also highly reduced.
poly-γ-glutamic acid;pretreatment;diatomaceous earth;activated carbon;extract
TS201.3
A
1002-0306(2014)06-0156-05
2013-07-16 *通讯联系人
贺杨扬(1989-),女,硕士研究生,研究方向:微生物工程、基因工程菌构建和酶工程。
国家自然科学基金项目(21062001);广西研究生教育创新计划资助项目(YCBZ2012004)。

