H1N1猪流感病毒感染猪血管内皮细胞后内参基因的筛选
朱鑫, 吴巧, 冯晓辉, 汤承, 岳华
(西南民族大学生命科学与技术学院, 四川 成都 610041)
H1N1猪流感病毒感染猪血管内皮细胞后内参基因的筛选
朱鑫, 吴巧, 冯晓辉, 汤承, 岳华
(西南民族大学生命科学与技术学院, 四川 成都 610041)
旨在评价H1N1猪流感病毒感染猪血管内皮细胞(PUVEC)后, 肽基脯氨酰异构酶A(Ppia)、β-肌动蛋白(Actb)、核糖体蛋白L4(Rpl4)、酪氨酸3/色氨酸5-单加氧酶激活蛋白(Ywhaz)和甘油醛-3-磷酸脱氢酶(Gapdh)等5个内参基因的稳定性. 采用Real-time RT-PCR方法测定H1N1 SIV感染PUVEC后3、6、9、12、15、18、24和30h时5个内参基因mRNA的表达水平, 未感染PUVEC为对照, 采用2-△Ct值对内参基因进行相对定量, 应用Genorm软件对其稳定性进行评价. 结果表明, 5个内参基因的稳定性由高到低分别为Ppia和Rpl4、Ywhaz、Actb、Gapdh, 其中Ppia和Rp14稳定性相同. 据此可知, Ppia和Rpl4在所选的5个内参基因中是研究H1N1 SIV与机体互作理想的2个内参基因.
H1N1猪流感病毒; 内参基因; Real-time RT-PCR
H1N1猪流感病毒(H1N1 swine influenza virus, H1N1 SIV), 是一种严重危害养猪业且对人类健康存在潜在隐患的流感病毒. 因此, 对H1N1 SIV的认识对公众健康越来越重要. 目前, 对猪流感病毒的致病机理还不完全清楚, 在病毒感染时, 宿主对病毒的转录应答是研究致病机理的一个重要内容, 而实时荧光定量RT-PCR是一个主要的研究手段, 并且已成为基因定量检测的黄金标准[1-2]. 在比较不同样本之间的基因表达时, 最关键的是考虑实验变量, 如细胞数量, 核酸提取和RNA反转录效率等. 因此, Real-time RT-PCR的准确性就依靠一个内在的内参基因来标准化[3-5]. 有文章报道在生理状态下稳定表达的内参基因在病毒感染时表达水平会发生改变[6-7]. 因此选择一个合适的内参基因是确定Real-time RT-PCR实验可靠性的关键.
血管内皮细胞具有屏障功能、分泌多种细胞因子、免疫调节、消除炎症等作用[8-9]; 同时, 血管内皮细胞还是H1N1流感病毒等多种病毒入侵机体时的靶细胞, 在病毒感染下能够产生大量炎症细胞因子[10]. 在本实验室前期工作中, 用H1N1等几种亚型病毒成功感染了猪血管内皮细胞(PUVEC), 据此, 我们选用了PUVEC作为研究H1N1 SIV与宿主互作的细胞模型. 根据现有报道, H1N1 SIV感染状态下, 在该细胞中理想的内参基因尚未进行筛选. 本研究参考相关文献, 选择肽基脯氨酰异构酶A(peptidyl prolyl isomerase A, Ppia), β-肌动蛋白(β-actin gene, Actb)核糖体蛋白L4(ribosomal protein L4, Rpl4), 甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, Gapdh), 酪氨酸3/色氨酸5-单加氧酶激活蛋白(tyrosine 3-monooxygenase/tryptophan 5-monooxygenase activation protein, Ywhaz)共5个候选内参基因, 研究其在H1N1 SIV感染PUVEC后的表达水平, 从中选出稳定的内参基因, 为研究H1N1 SIV与机体的互作提供新的依据.
1 材料与方法
1.1 细胞株及毒株
PUVEC细胞和H1N1 SIV毒株均由本实验室保存并提供, HA效价为27.
1.2 主要试剂
SYBR®Premix Ex TaqTM、TapDNA酶、Trizol Reagent及反转录试剂盒为TaKaRa公司的产品, MarkerⅠ购自北京博迈德, DMEM细胞培养基、胰蛋白酶为美国HyClone公司的产品, 胎牛血清为美国Gibco公司的产品, JM109工程菌由本实验室制备, Plasimid Miniprep Kit和AxyPrep DNA Gel Extraction Kit为美国Axygen公司的产品.
实时荧光定量PCR仪ABI 7300为美国ABI公司的产品; 凝胶成像系统Doc2000和PCR仪my cyclerTM为美国Bio-Rad公司的产品; 高速冷冻离心为德国Eppendorf公司的产品; Casy TT细胞计数仪为瑞士Roche公司的产品.
1.4 H1N1 SIV感染PUVEC
将培养瓶中汇合度达到85%~95%的PUVEC用胰蛋白酶消化, 制成2~4×105个/mL细胞悬液, 接种于6孔细胞培养板中, 2.5 mL/孔, 臵于5% CO2、37℃培养箱中培养, 待细胞汇合度达到85%~95%时接种H1N1 SIV, 0.5mL/孔, 臵于5% CO2、37℃培养箱中孵育1 h, 吸弃接种物, 加入2.5 mL/孔的含5 μg/mL TPCK胰酶和4%胎牛血清的DMEM培养基, 臵于5% CO2、37℃培养箱中培养. 共使用八个6孔板, 每个细胞培养板3孔接种病毒,另3孔用等量Hank's液代替病毒, 作为空白对照.
1.5 样本收集
观察各培养板中细胞的状态, 并于H1N1 SIV感染后的3、6、9、12、15、18、24和30h各取出一个培养板,向各孔加入Trizol 试剂700μL, 收集细胞裂解物, 于-20℃冰箱保存备用.
1.6 细胞样本总RNA 的提取及cDNA的合成
将细胞裂解物按照Trizol试剂说明书提取细胞总RNA, 并按照反转录试剂盒成cDNA, 于-20℃冰箱保存备用.
教师建立小组竞争机制,展开组间竞争。教室内各组分开,设立独立实验环境,各组成员可以随时了解其他组进度,形成企业竞争氛围,促进各组项目顺利完成;培养学生危机感,树立竞争理念。各组完成任务后展示成果,每组选派代表上台演示设计思路、实现过程、存在问题等。然后组内互评、组间互评、教师评价。通过分享、评价,让学生在享受成就,交流经验,提升沟通表达能力,深化学习成果。
1.7 引物的设计与合成
按照这5对常用内参基因的保守序列各设计一对引物, H1N1的引物采用文献[11]中报道的H1N1 M基因的引物, 猪内参基因的引物如表1.
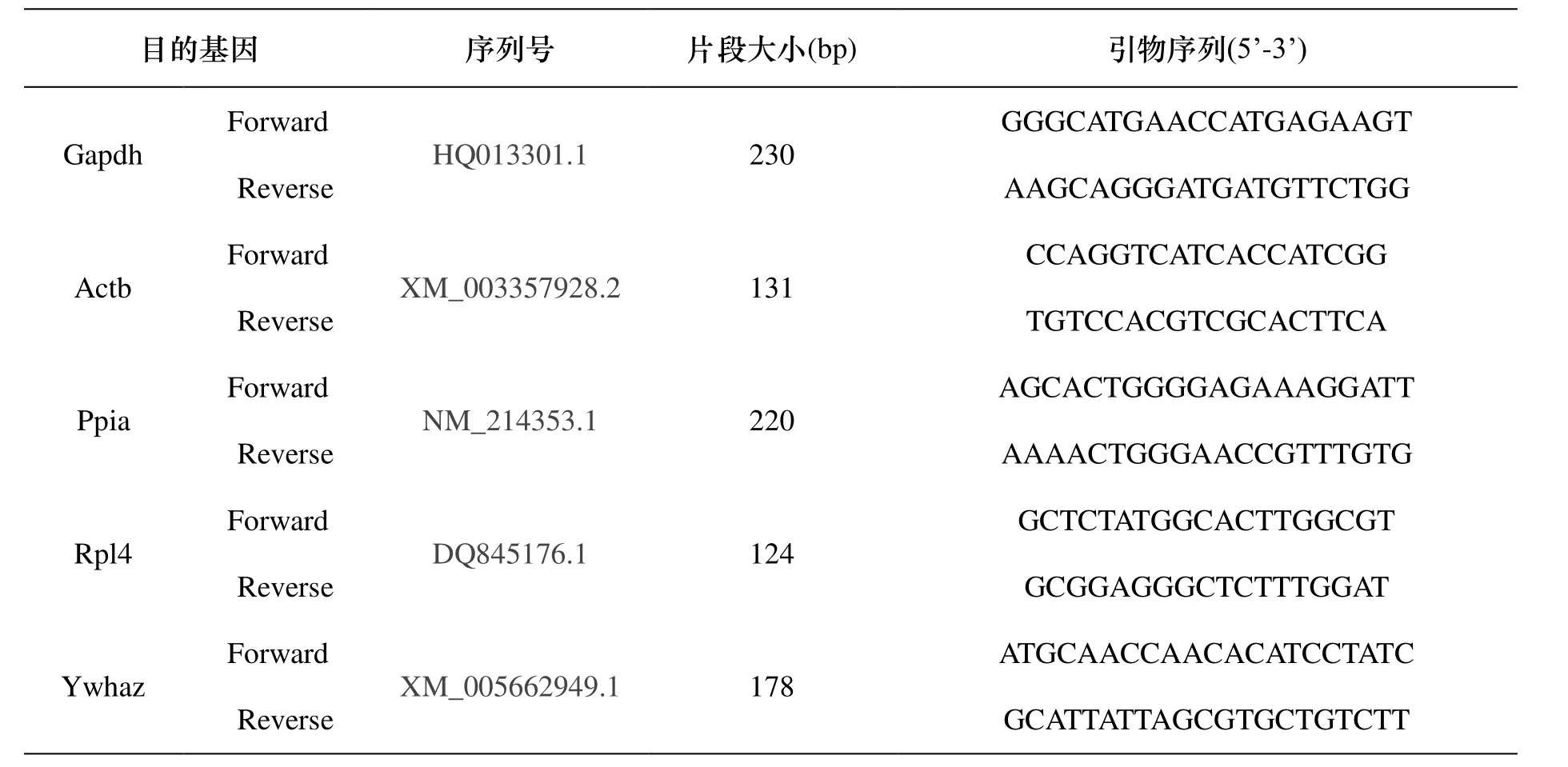
表1 猪5个内参基因的RT-PCR引物信息Tab.1 Information for primers of RT-PCR
1.8 引物特异性鉴定及阳性标准品制备
以1.6中反转录好的cDNA为模板, 用上述引物进行PCR扩增. PCR反应体系为25μl:10×PCR Buffer 2.5 μl, Taq DNA聚合酶0.125μl, MgCl21.5 μl, 上、下游引物各1 μl, dNTPs 2 μl, cDNA 2μl, 去离子水补足至25μl. 反应条件为:95℃下预变性5分钟; 95℃下变性30秒, 54℃下退火1分钟, 72℃下延伸45秒, 35个循环; 72℃下延伸5分钟; 37℃结束反应. 琼脂糖凝胶电泳鉴定PCR产物, 经试剂盒回收并纯化, 将产物克隆至pMD19-T载体中, 将其转化到JM109工程菌中, 用Plasmid Miniprep Kit提取重组质粒, 送到测序公司测序, 作为本研究的阳性标准品.
1.9 优化Real-time PCR条件
在ABI 7300荧光定量PCR仪上用SYBR GreenⅠ染料法进行扩增和数据分析. 以最高荧光值和最小Ct值为标准, 优化退火温度、引物浓度及循环条件. 以SYBR GreenⅠ试剂推荐的反应体系(20μl), 引物终浓度优化的范围为0.1~1.0μmol/L, 运用2步法和3步法进行扩增. 采用优化的引物浓度和循环条件, 将退火温度从54℃递增至60℃, 递增度数为1℃, 优化退火温度.
1.10 验证H1N1 SIV感染PUCEV及各样本的检测
以感染组的cDNA为模板, 以本实验室建立的RT-PCR方法[11]检测H1N1的M基因, 以验证H1N1 SIV是否成功感染PUVEC.
分别取每个时间点感染组和对照组的3个生物学重复, 将反转录好的cDNA用于荧光定量检测, 得到各个样本各内参基因的Ct值.
1.11 稳定性的检测
应用Genorm软件检测稳定性:通过ABI7300软件得出各内参基因的Ct值, 然后将各内参基因的Ct值代入公式△Ct值=样本Ct值-最小Ct值, 算出△Ct值后得到各内参基因的2-△Ct值, 应用Genorm软件得出5个候选内参基因的稳定值M, 然后通过软件的自动分析算出这5个内参基因表达稳定性的顺序.
2 结果
2.1 H1N1 SIV成功感染PUVEC
随机抽取感染3h后的细胞样本进行PCR检测, 结果表明H1N1 SIV成功感染PUVEC细胞(图1).
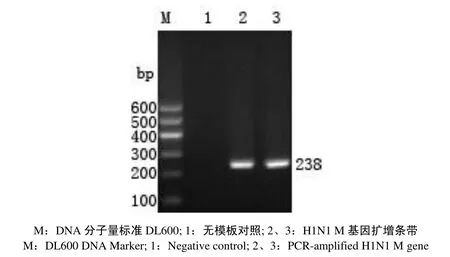
图1 H1N1感染后细胞中H1N1 M基因扩增产物Fig.1 Amplification of H1N1 M gene by PCR
2.2 内参基因的引物特异性
图2为琼脂糖凝胶电泳的结果. 从图2可知, 这5个内参基因的条带清晰, 与目的基因的序列完全一致, 证明这5对引物的特异性和准确性良好.
2.3 优化出的检测5个内参基因Real-time RT-PCR条件
Gapdh、Actb、Ppia、Rpl4、Ywhaz 5个内参基因优化出的反应体系为20μl:SYBR Green Ⅰ10 μl, 去离子水6 μl, 模板2 μl, 上、下游引物各1 μl. 反应条件为:95℃下预变性3分钟, 95℃下变性15秒, 56℃下退火30秒, 循环数:40个.
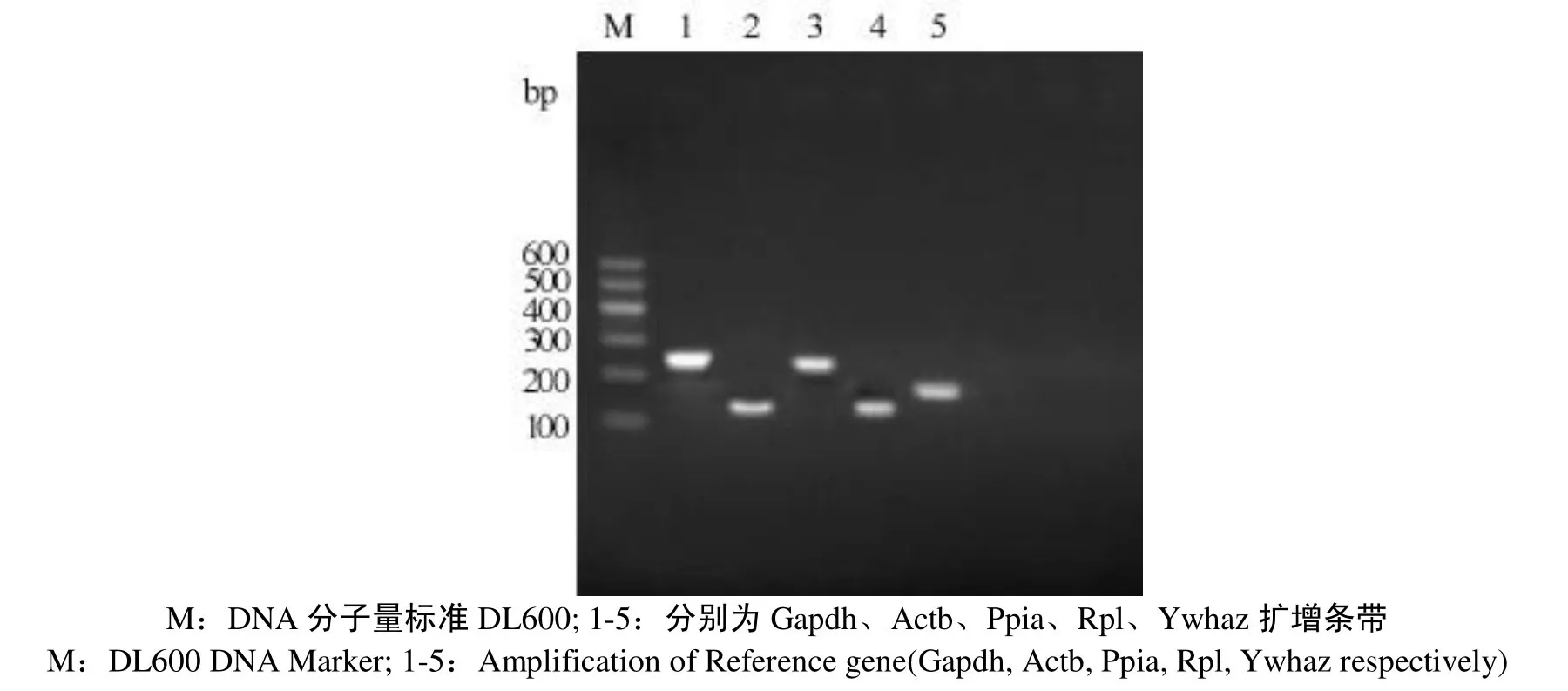
图2 内参基因PCR扩增产物Fig.2 Amplification of Reference gene by PCR
2.4 熔解曲线分析
由熔解曲线分析可见, Gapdh、Actb、Ppia、Rpl4、Ywhaz mRNA的Real-time RT-PCR产物仅有1个特异峰,无非特异扩增和引物二聚体. 其熔解温度分别为:81.4℃±0.5℃、86.2℃±0.3℃、85.2℃±0.2℃、83.0℃±0.3℃、81.8℃±0.3℃(图3).
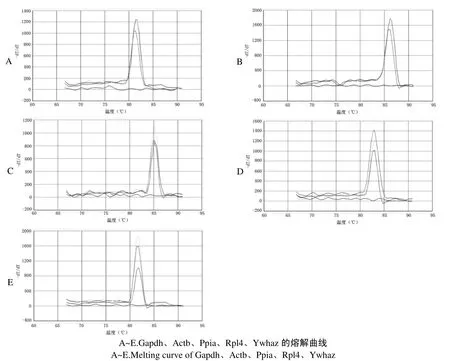
图3 内参基因的熔解曲线Fig.3 Melting curve of Reference gene
2.5 内参基因的表达稳定性
表2为内参基因的表达稳定性. 从表2可知, 综合评价感染组和对照组的M值后, 5个内参基因表达的稳定性由高到低分别为Ppia和Rpl4, Ywhaz, Actb, Gapdh, 且它们的M值均小于1.5, 表明这5个内参基因均能在H1N1 SIV感染时稳定表达, 其中Ppia和Rp14为最稳定的内参基因.

表2 内参基因表达稳定值Tab.2 Stable value of Reference gene
3 讨论
到目前为止, Real-time PCR技术在基因表达分析上有广泛的应用, 而筛选理想的内参基因是基因分析表达试验的重要的一环. 随着研究的深入, 已经有诸多证据表明, 在生理状态下稳定表达的内参基因在病毒感染时表达水平会发生改变, 不能用于标化目的基因, 因此, 合适的内参基因须由试验条件来确定. 理想的内参基因应该满足以下几点条件:(1)稳定表达于各种细胞和组织, 不受生理、病理变化以及环境因素的影响;(2)在各种细胞和组织中均能表达, 不受细胞种类的影响, 相同组织类型的不同样本其表达水平应当保持一致, 在不同组织间的表达不应有显著变化;(3)不存在假基因, 以避免基因组 DNA 的扩增, 表达丰度中等, 不能太高和太低, 内参基因和目的基因的表达水平应当在一个相同数量级; 然而往往被认为表达稳定的内参基因却表达不稳定[12-13].根据大量文献的报道, 任意一种内参基因的稳定表达都是指在某些类型或者一定实验条件下的稳定. 在其他类型的细胞和组织中或者受某些实验因素及病理、环境等的作用下, 内参基因的表达是变化的, 其表达差异可能是十几倍到几十倍[14-15].
近年来, ACTB和GAPDH被广泛应用作内参基因进行相对定量的分析研究, 它们一直以来都是人们常用的内参基因, 但是根据大量研究表明, 人们发现在某些条件下, 例如病毒感染, 环境等因素, ACTB和GAPDH不能作为稳定的内参基因对目的基因进行定量分析[16]. 所以理想的内参基因应该根据特定的试验条件来选择. Nygard等研究在猪组织基因表达时, ACTB和RPL4对高丰度的转录物是很好的内参基因, 而TATA盒结合蛋白(TBP)和次黄嘌呤磷酸核糖转移酶1(HPRT1)对低丰度的转录物是很好的内参基因[4]. Silver等在研究人类网状细胞的基因表达时, GAPDH是最好的内参基因, 而常用的β2-微球蛋白(B2M)应该避免使用[3]. Jung等在研究人类肾细胞癌时, 在比较肿瘤组织和正常组织时, PPIA和TBP是最稳定的内参基因[17]. YUE等在研究禽流感病毒感染鸡胚成纤维细胞时, ACTB和RPL4是在病毒感染状态下的CEFs中最好的内参基因[18]. 然而在流感病毒感染下, 筛选稳定内参基因的报道较少. 本试验证实在H1N1 SIV感染的猪血管内皮细胞中, PPIA和RPL4是在5个候选的内参基因中表达最为稳定的, 结果表明在H1N1 SIV感染状态下, PPIA和RPL4可用于标化实时荧光定量PCR的结果.
Genorm作为内参基因选择的良好工具, 为广大科研工作者解决了这一大难题. 利用Genorm程序, 研究人员可以在任何细胞和组织的众多内参基因中筛选出2个以上的内参基因. 研究结果表明, 使用多个内参基因将更加有利于系统偏差的校正, 得到更可靠的定量结果[12]. 本试验通过Genorm程序分析得出PPIA和RPL4在所选的5个内参基因中是研究H1N1 SIV与机体互作相对理想的2个内参基因, 这为研究H1N1 SIV与机体的互作提供了新的参考.
[1] DERVEAUX S, VANDESOMPELE J, HELLEMANS J. How to do successful gene expression analysis using real-time PCR[J]. Methods, 2010, 50(4):227-230.
[2] JAN H,SCHEFE K E,LEHMANN I R,et al. Quantitative real-time RT-PCR data analysis:current concepts and the novel “gene expression’s Ct difference”formula[J]. J Mol Med, 2006,84(11): 901-910.
[3] SILVER N, BEST S, JIANG J,et al.Selection of housekeeping genes for gene expression studies in human reticulocytes using real-time PCR[J]. BMC Molecular Biology,2006(7):33-42.
[4] NYGARD A B, JØRGENSEN C B, CIRERA S,et al.Selection of reference genes for gene expression studies in pig tissues using SYBR green qPCR[J]. BMC Molecular Biology,2007(8):67-73.
[5] DHEDA K,HUGGETT J F, BUSTIN S A, et al. Validation of housekeeping genes for normalizing RNA expression in real-timePCR[J]. BioTechniques, 2004(37): 112-119.
[6] WATSON S, MERCIER S, BYE C,et al. Determination of suitable housekeeping genes for norma-lisation of quantitative real time PCR analys is of cells infected with human immunodefi-ciency virus and herpes viruses[J].Virology Journal,2007,4(1):130-135.
[7] RADONI A, THULKE S,BAE H G, et al.Reference gene selection for quantitative real-time PCR analysis in virus infected cells:SARS corona virus, Yellow fever virus, Human Herpesvirus-6, Camelpox virus and Cytomegalovirus infections[J].Virology Journal,2005, 2(7): 1-5.
[8] 余乐, 张思春, 李素, 等. 猪脐静脉血管内皮细胞的分离及体外培养研究[J]. 中国预防兽医学报, 2012, 34(5): 370-374.
[9] 洪海霞, 张彦明, 孙裴, 等. 猪脐静脉血管内皮细胞的分离与培养[J]. 西北农林科技大学学报: 自然科学版, 2004, 32(5): 1-4.
[10] VALBUENA G,WALKER D H. The endothelium as a target for infections[J]. Annu Rev Pathol, 2006, 1: 171-198.
[11] 聂培婷, 汤承, 岳华. H1N1甲型流感病毒在BHK21中的增殖规律[J]. 西南民族大学学报: 自然科学版, 2012, 38(5): 764-769.
[12] 张艳君, 朱志峰, 陆融, 等. 基因表达转录分析中内参基因的选择[J]. 生物化学与生物物理进展, 2007, 34(5): 546-550.
[13] SUZUKI T, HIGGINS P J, CRAWFORD D R. Control selection for RNA quantitation[J]. Biotechni-ques,2000, 29(2): 332-337.
[14] LIU D W, CHEN S T, LIU H P. Choice of endogenous control for gene expression in nonsmall cell lung cancer[J]. Eur Respir J,2005, 26(6):1002-1008.
[15] SELVEY S, THOMPSON E W, MATTHAEI K, et al. Beta-actin—an unsuitable internal control for RT-PCR[J]. Mol Cell Probes,2001, 15(5): 307-311.
[16] GLARE E M, DIVJAK M, BAILEY M J, et al. ß-Actin and GAPDH housekeeping gene expression in asthmatic airways is variable and not suitable for normalising mRNA levels[J]. Thorax, 2002, 57: 765-770.
[17] JUNG M, RAMANKULOV A, ROIGAS J, et al. In search of suitable reference ge nes for gene expression studies of human renal cell carcinoma by real-time PCR[J].BMC Molecular Biology, 2007(8): 47-60.
[18] YUE H, LEI X W, YANG F L, et al. Reference gene selection for normalization of PCR analysis in chicken embryo fibroblast infected with H5N1 AIV[J].Virol Sin, 2010, 25(5): 425-431.
Selection of reference genes in porcine umbilicus vein endothelial cells infected with H1N1 swine influenza virus
ZHU Xin, WU Qiao, FE
NG Xiao-hui, TANG Cheng, YUE Hua
(School of Life Science and Technology, Southwest University for Nationalities, Chengdu 610041, P.R.C.)
The purpose of this study is to analysis the expression stability of Ppia, Actb, Rpl4, Ywhaz and Gapdh genes in porcine umbilical vein endothelial cells infected by H1N1 swine influenza virus. The paper detected mRNA expression level of these five genes at 3h, 6h, 9h, 12h,15h,18h, 24h and 30h post-infection using real-time RT-PCR, and the uninfected group was set as a control group. Relative quantification of these 5 genes was calculated using 2-△Ctvalue and then analysis of their expression stabilities was conducted using Genorm softwere. The result showed that the expression stability of these 5 genes ranges in a decreasing order as follows: Ppia, Rpl4, Ywhaz, Actb, and Gapdh, among which Ppia and Rpl4 have the same expression stability. In sum, the Ppia and Rpl4 genes are the ideal reference genes in H1N1 SIV infected PUVEC.
H1N1 SIV; reference gene; real-time RT-PCR
S855.8,S858.28
A
1003-4271(2014)04-0489-06
10.3969/j.issn.1003-4271.2014.04.03
2014-05-13
岳华(1963-), 女, 汉族, 河南人, 教授, 博士, E-mail: yhua900@163.co.m
国家自然科学基金项目(编号31172307).

