L-脯氨酰胺衍生物的合成及在不对称催化反应中的应用
李清寒, 丁勇, 赵志刚, 张刚, 陈峰
(西南民族大学化学与环境保护工程学院, 四川 成都 610041)
L-脯氨酰胺衍生物的合成及在不对称催化反应中的应用
李清寒, 丁勇, 赵志刚, 张刚, 陈峰
(西南民族大学化学与环境保护工程学院, 四川 成都 610041)
以L-脯氨酸为原料, 与不同的手性胺基醇及脂肪胺反应合成了6个手性酰胺化合物, 并考查了它们在醛的不对称烷基化反应及炔酯与三甲基铝的不对称偶联反应中的催化性能, 结果表明6个化合物均有一定的催化效果. 所有目标化合物均通过熔点测定和核磁共振氢谱及碳谱分析对其结构进行确证.
L-脯氨酰胺;不对称烷基化;不对称偶联
L-脯氨酸是最早发现的一种有效的不对称手性催化剂, 由于其结构简单, 自然界中含量非常丰富, 且价格低廉, 所以有机化学家对其研究比较深入. 目前脯氨酸及其衍生物在许多有机催化反应中得到了较好的应用,并且大部分反应都能够得到比较理想的收率和高的立体选择性, 比如:各种醛酮之间[1-4]或醛醛之间[5]以及分子内[6]的直接Aldol反应、不对称Mannich反应[7]、不对称Michael加成反应[8-9]、醛或酮的α-胺氧化反应[10-11]、羰基的直接α-胺化反应[12]、Baylis-Hill-man反应[13]、醛的分子内α-烷基化反应[14]、羰基化合物的不对称硅腈化反应[15-16]等. 2003年,Gong 等首次报道脯氨酸衍生物脯氨酰胺类化合物可以高效地催化丙酮与醛的不对称Aldol 反应, 其产物的构型与脯氨酸催化结果一致[17], 经过对过渡态的推测和理论计算,他们认为四氢吡咯环、酰胺和羟基三者的协同作用促进了不对称催化反应的发生, 其中形成氢键的能力决定了过渡态的稳定性, 从而决定了反应的立体选择. 虽然近年来脯氨酸及其衍生物已在许多有机不对称催化反应中得到了很好的应用, 取得了重大发展和进步, 但是该类化合物在羰基化合物的不对称烷基化反应及炔基酯与Me3Al的不对称偶联反应制备手性丙二烯化合物的反应中却还未见文献报道. 为此, 为了拓展脯氨酸及其衍生物在不对称烷基化反应及炔基酯与Me3Al的不对称偶联反应中的应用, 我们在参考已有的相关文献基础上设计合成了一系列脯氨酰胺催化剂, 该类催化剂保留了吡咯环的刚性环状结构, 同时又引入了酰胺和羟基两个官能团, 这有利于形成氢键, 从而使其立体选择性可能变得更强, 催化效果更好. 合成的目标化合物通过熔点测定和核磁共振氢谱及碳谱分析对其结构进行确证. 合成路线见Scheme1.
1 实验部分
1.1 主要试剂与仪器
XRC1显微熔点仪测定(温度未校正); Varian400MHz核磁共振仪(Me4Si为内标, CDCl3及CD3OD为溶剂). 所用试剂均为化学纯或分析纯, 除特别注明外, 未经进一步处理.
1.2 化合物3(a-d,f)的合成
在一干燥的圆底烧瓶中加入5.5 mmol Boc保护的L-脯氨酸, 30 mL无水CH2Cl2, 1 mL无水Et3N, 用冰冷却至0oC, 在搅拌下加入氯甲酸异丁酯0.72 mL (5.5 mmol). 加毕, 在该温度搅拌15分钟, 然后将相应的手性胺基醇或(R)-苯乙胺(5.5 mmol)或(R,R)-环己二胺(2.75 mmol)溶于无水CH2Cl2中, 在搅拌下向该溶液中缓慢加入. 加毕, 撤去冰浴, 室温搅拌反应, TLC跟踪至反应完全. 反应毕, 将该反应液旋蒸至干, 加入10 mL水, 用CH2Cl2(3×15 mL)萃取, 合并有机层. 然后分别用 1 M KHSO4溶液, 饱和NaHCO3, 饱和NaCl溶液洗涤有机层, 无水Na2SO4干燥.干燥毕, 将该溶液浓缩至干, 向剩余物中加入10 mL CH2Cl2, 5 mL TFA搅拌1小时. 反应毕, 用2 M NaOH溶液中和该反应液至PH = 8-9, 用CH2Cl2(3×15 mL)萃取, 有机层用饱和NaCl溶液洗涤, 无水Na2SO4干燥. 干燥毕, 将该溶液浓缩至干, 经柱层析分离得到相应的手性酰胺化合物3(a-d,f).
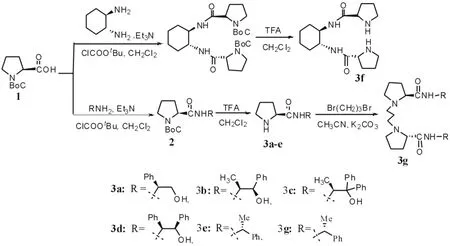
路线1 化合物3(a~d,f,g)的合成路线Scheme1 Synthetic route of compounds 3(a~d,f,g)
3a[18]:浅黄色粘稠固体, 收率73%.1H NMR (CDCl3, 400 MHz): δ 1.67 (m, 2H), 1.82 (s, J = 6 Hz, 1H), 2.08 (m, 1H), 2.87 (m, 1H), 2.95 (m, 1H), 3.51 (bs, 2H), 3.76 (m, 3H), 4.99 (m, 1H), 7.28 (m, 5H), 8.37 (d, J = 7.8 Hz, 1H);13C NMR (CDCl3, 100 MHz): δ 175.5, 139.3, 128.5, 127.4, 126.4, 66.2, 60.3, 55.3, 47.0, 30.5, 25.9.
3b: 白色固体, 收率75%; m.p. 126-127oC(文献[19]值:m.p. 127-128oC); [α]25D= -112.0 (c = 1.1, CHCl3) [文献[19]值:[α]25D= – 111.6o(c =1.0, CHCl3)];1HNMR (CDCl3, 400 MHz) : δ 1.10 (d, J = 6.9 Hz, 3H), 1.65-1.70 (sep, J = 6.5 Hz, 2H), 1.80- 1.90 (m, 1H), 2.05–2.15 (m, 1.H), 2.80-2.87 (m, 1H), 2.92-3.00 (m, 1H), 2.71-3.42 (br s, 1H), 3.73 (q, J = 4.6 Hz, 1H), 4.21-4.31 (m, 1H), 4.82 (d, J = 2.9 Hz, 1H,), 7.25- 7.35 (m, 5H), 7.65 (br d, 1H);13C NMR (CDCl3, 100 MHz) : δ 175.9, 140.8, 127.9, 127.3, 126.4, 76.8, 60.4, 50.9, 47.2, 30.6, 26.1, 14.9.
3c: 白色固体; 收率 79%; m.p.155-157oC; [α]25D= -73.0o(c =1.4, CHCl3) [文献[18]值:[α]25D= - 72.0o(c =1.3, CHCl3)];.1H NMR (CDCl3, 400 MHz): δ 1.20 (d, J = 6.8 Hz, 3H), 1.33 (m, 1H), 1.49 (m, 2H), 1.90 (m, 1H), 2.62 (m, 1H), 2.82 (m, 1H), 3.49 (dd, J = 9.3, 4.9 Hz, 1H), 4.77 (dt, J = 8.6, 6.8 Hz, 1H), 7.16 (m, 2H), 7.27 (m, 4H), 7.52 (m, 4H), 8.01 (d, J = 8.3 Hz, 1H);13C NMR (CDCl3, 100 MHz): δ 175.4, 146.1, 145.1, 128.2, 128.0, 126.7, 126.6, 125.8, 125.6, 80.4, 60.3, 52.9, 47.0, 30.4, 25.7, 15.2.
3d: 白色固体; 收率: 74%; m.p.142-145oC(文献[17]值: m.p. 141.7-144.8oC); [α]25D= -23.0 (c= 0.51, CH3CH2OH) [文献[17]值:[α]25D= – 23.8o(c =0.52, CH3CH2OH)];1H NMR (400 MHz, CD3OD): δ 1.37(m,1H), 1.56 (m, 1H), 1.66 (m, 1H), 1.93 (m, 1H), 2.93 (m, 1H), 3.64 (m, 1H), 4.94 (d, J= 6.9 Hz, 1H), 5.16 (d, J= 6.9 Hz, 1H), 7.26 (m, 10H);13C NMR (CD3OD, 100 MHz): δ 174.2, 142.2, 140.0, 128.5, 128.47, 128.44, 128.1, 127.8, 127.6, 76.8, 60.9, 59.3, 47.3, 31.2, 25.9.
3f: 白色固体;收率:73%;m.p. 174-175oC(文献[16]值:m.p. 175.0-175.8oC);[α]25D= - 41.7o(c = 1.65, CH2Cl2) [文献[16]值:[α]25D= – 42.3o(c =1.68, CH2Cl2)];1H NMR (CDCl3,400MHz): δ 1.35 (m, 4H), 1.67 (m, 4H), 1.75 (m, 4H), 2.01 (m, 2H), 2.12 (m, 4H), 2.87-3.00 (m, 4H), 3.62 (m, 2H), 3.67 (m, 2H), 7.64 (s, 2H).13C NMR (CDCl3,100MHz): δ 175.3, 60.4, 52.9, 47.0, 32.3, 30.6, 25.9, 24.8.
1.3 化合物3g的合成
在一干燥的圆底烧瓶中加入手性酰胺3e (5.2 mmol), K2CO3(10.5 mmol), 无水CH3CN (20 mL), 在搅拌下加入二溴丙烷(2.6 mmol). 加毕, 回流搅拌反应, TLC跟踪至反应完全. 反应毕, 冷却至室温, 向反应液中加入30 mL乙酸乙酯, 30 mL水. 分离有机层, 有机层用饱和NaCl溶液洗涤, 无水Na2SO4干燥. 经柱色谱分离(乙酸乙酯/石油醚=1:3), 得一浅黄色固体. 收率:73%;m.p.113-114(文献[20]值:m.p.114-115oC); [α]25D= –161.0o(c =0.5, CHCl3)[文献[20]值:[α]25D= –160.2o(c =0.5, CHCl3) ];1H NMR (CDCl3,400 MHz): δ 1.49 (d, J = 6.8 Hz, 6H), 1.68-1.83 (m, 8H), 2.07-2.21 (m,2H), 2.31 (q, J = 9.2 Hz, 2H), 2.60 (t, J = 7.2 Hz, 4H), 3.05 (dd, J = 10.0, 4.4 Hz, 2H), 3.17 (t, J = 8.0Hz, 2H), 5.10-5.14 (m, 2H), 7.27 -7.37 (m, 10H), 7.63 (d, J = 8.4 Hz,2H);.13C NMR (CDCl3,100 MHz): δ 173.8, 143.4, 128.6, 127.1, 125.8, 67.7, 54.2, 54.0, 47.6, 30.5, 28.5, 24.2, 22.2.
2 化合物3(a-d,f,g)的催化性能研究
2.1 化合物3(a-d,f,g)催化iBuMgCl及nBuMgCl与苯甲醛的不对称加成反应.
向干燥的反应试管中加入手性酰胺配体3 (0.05 mmol), 抽真空干燥, 用氮气臵换三次, 于氮气保护下加入Ti(OiPr)4(1.0 mmol), 1.0 mL THF, 室温搅拌反应1小时. 将反应混合物冷至0oC后, 加入iBuMgCl或nBuMgCl (1 M in THF, 1.0 mmol)和1.0 mL THF, 搅拌0.5 h后, 加入苯甲醛 (0.5 mmol). 加毕, 维持0oC, 反应5h, 加入饱和NH4Cl水溶液萃灭反应, 加入乙酸乙酯, 分出有机层, 水层用乙酸乙酯萃取(2×15mL), 合并有机层, 无水MgSO4干燥, 过滤除去MgSO4, 将有机层浓缩, 残留物经快速柱层析 (石油醚:乙醚= 10:1) 得相应的手性二级醇5.
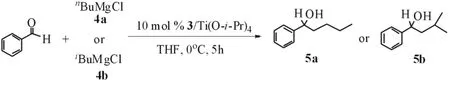
路线2 苯甲醛的不对称加成反应Scheme 2 Asymmetric Additionsof Benzaldehyde
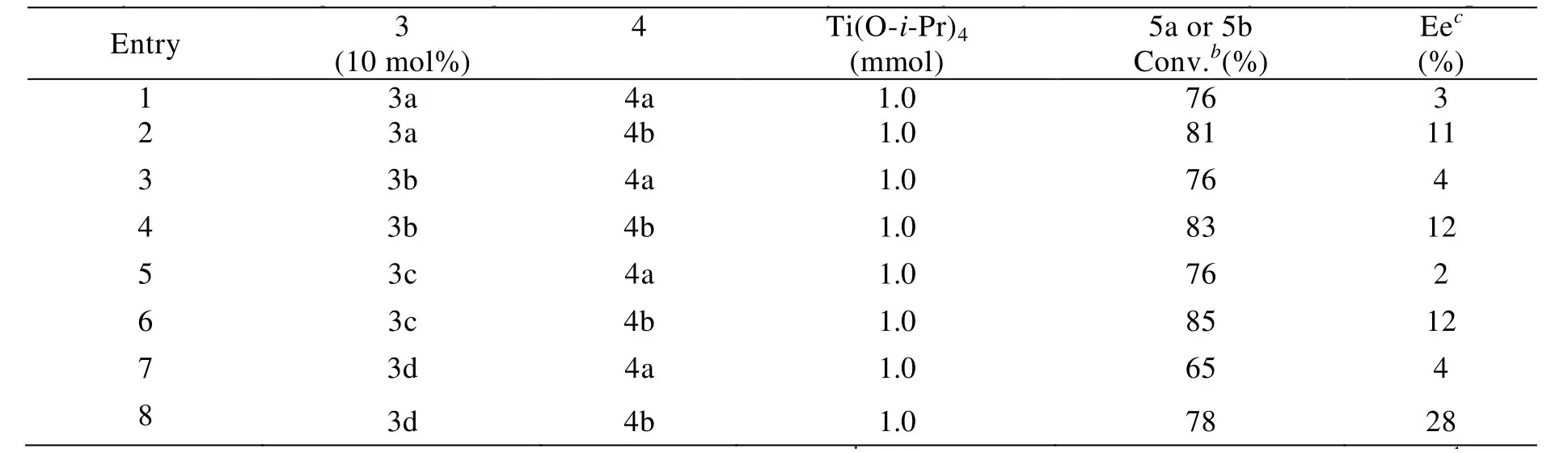
表1 手性钛催化剂3催化苯甲醛与nBuMgCl及iBuMgCl的不对称加成反应aTab.1 AsymmetricnBuMgCl andiBuMgCl Additions to Benzaldehyde Catalyzed by a Titanium Catalyst of Chiral Compouns 3.a
2.2 化合物3(a-d,f,g)催化炔基酯与Me3Al的不对称偶联反应.
向干燥的反应试管中加入手性酰胺配体3 (0.05 mmol), K2CO3(0.5 mmol), NiCl2(0.05 mmol), 抽真空干燥,用氮气臵换三次, 于氮气保护下加入1.0 mL THF, 室温搅拌反应0.5 h. 在室温加入Me3Al (1 M in Toluene, 0.3 mmol)和1.0 mL THF, 搅拌0.5 h后, 加入炔基酯6 (0.5 mmol). 加毕, 于室温反应20 h. 加入饱和NH4Cl水溶液萃灭反应, 加入乙酸乙酯, 分出有机层, 水层用乙酸乙酯萃取(2×15mL), 合并有机层, 无水MgSO4干燥, 过滤除去MgSO4, 将有机层浓缩, 残留物经快速柱层析 (石油醚:乙酸乙酯= 50:1) 得相应的手性丙二烯化合物7.
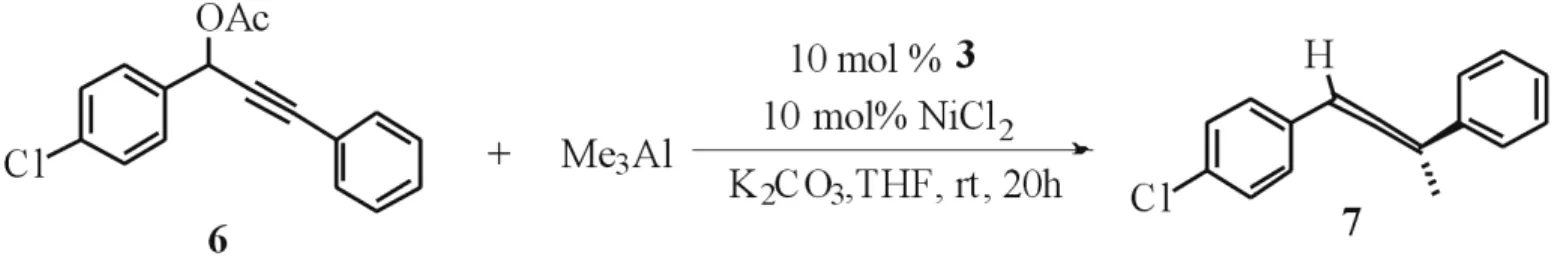
路线3 炔基酯与Me3Al的不对称偶联反应Scheme 3 Asymmetric cross-coupling of propargylic carbonates react with Trimethylaluminum.
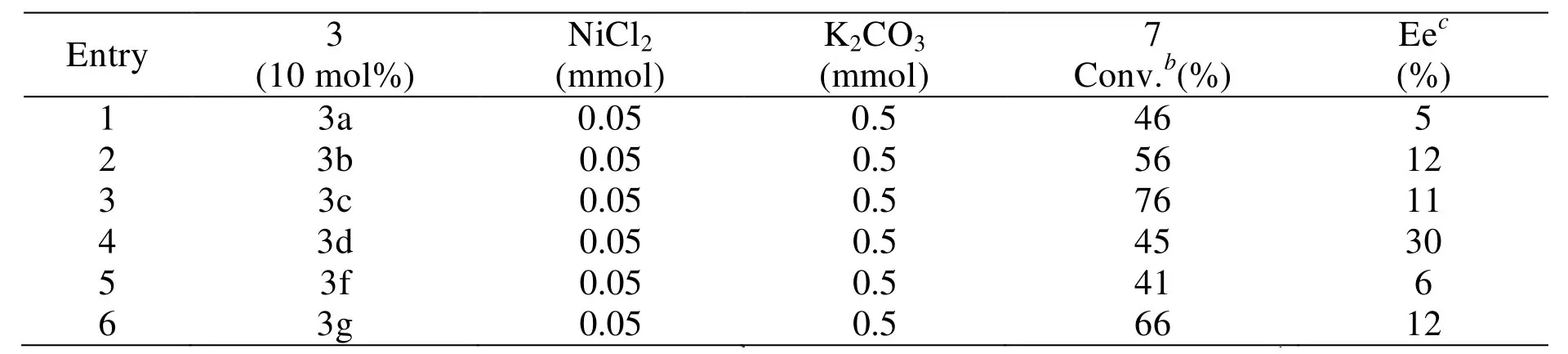
表2 手性镍催化剂3催化炔基酯与Me3Al的不对称偶联反应aTab.2 Asymmetric cross-coupling of propargylic carbonates react with Trimethylaluminum catalyzed by a Nickel catalyst of chiral compouns 3.a
3 结果与讨论
本文合成的6个化合物3(a-d,f,g)其结构组成均经过1H NMR和13C NMR得到确证, 合成的产物即为标题化合物. 并初步考查了所合成的6个手性酰胺化合物在醛的不对称烷基化及炔基酯与Me3Al的不对称偶联反应中的催化效果.
3.1 手性酰胺配体3对醛的不对称烷基化反应的影响
以THF为溶剂, 0.5 mmol苯甲醛, 1.0 mmoliBuMgCl或nBuMgCl为标准反应(Scheme 2), 分别初步考察了手性酰胺配体3与Ti(OiPr)4所形成的钛配合物催化剂对醛的不对称烷基化反应的影响. 结果表明, 当用不同结构的手性酰胺3配体 (10 mol%), 添加Ti(OiPr)4(1.0 mmol)催化苯甲醛与iBuMgCl及nBuMgCl的不对称加成反应时, 经过5 h反应可以达到65-83%的转化率, 目标化合物的对映选择性为2- 28% ee (Table 1, entries 1-8). 虽然在初步的试验中, 目标化合物的对映选择性最高只有21%, 但这也足以说明该类配体对醛的不对称烷基化反应具有一定的催化效果,而且通过更进一步的优化手性酰胺3的结构、反应溶剂、金属、添加剂等条件, 有可能找到一个催化效果较好的手性酰胺配体, 从而找到一类对醛与烷基格林纳的不对称烷基化反应有较好催化效果的新合成方法.
2.2 手性酰胺配体3对炔基酯与Me3Al的不对称偶联反应的影响
以THF为溶剂, 0.5 mmol 苯炔基酯, 0.3 mmol Me3Al (1 M in Toluene)为标准反应(Scheme 3), 分别初步考察了手性酰胺配体3与NiCl2所形成的金属配合物催化剂对苯炔基酯与Me3Al的不对称偶联反应的影响. 结果表明,当用不同结构的手性酰胺3配体 (10 mol%), NiCl2(10 mol%), 添加K2CO3(0.5 mmol)催化苯炔基酯与Me3Al的不对称偶联反应时, 室温反应20 h可以达到41-76%的转化率, 目标化合物的对映选择性为5-30% ee(Table 2, entries 1-6). 这表明该类配体对这一类新的不对称偶联反应有一定的催化效果. 但由于所考察配体的数量及结构有限, 所以未能得到很好的催化效果. 这也为该类新的不对称偶联反应提供了一个有效的新合成方法, 而且通过进一步的优化配体结构、反应溶剂、配位金属、碱等反应条件, 完全有可能得到较高的对映选择性, 从而为该类新的不对称偶联反应寻找到一个催化效果很好的合成方法.
[1] LIST B, LERNER R A, BARBAS C F. Proline-catalyzed direct asymmetric aldol reactions [J]. J Am Chem Soc, 2000, 122: 2395-2396.
[2] ALCAIDE B, LCAIDE B, ALMENDROS P. The direct catalytic asymmetric cross-aldol reaction of aldehydes [J]. Angew Chem Int Ed, 2003, 42: 858-860.
[3] NOTZ W, TANAK F, BARBAS C F. Enamine-based organocatalysis with proline and diamines: the development of direct catalytic asymmetric aldol, mannich, michael, and diels−alder reactions [J]. Acc Chem Res, 2004, 37: 580-591.
[4] KAZMAIER, U. Amino acids-valuable organocatalysts in carbohydrate synthesis [J]. Angew Chem Int Ed, 2005, 44: 2186-2188.
[5] NORTHRUP A B, MACMILLAN D W C. The first direct and enantioselective cross-aldol reaction of aldehydes [J]. J Am Chem Soc, 2002, 124: 6798-6799.
[6] PIDATHALA C, HOANG L, VIGNOLA N, et al. Direct catalytic asymmetric enolexo aldolizations [J]. Angew Chem Int Ed, 2003, 42: 2785-2788.
[7] WESTERMANN B, NEUHAUS C. Dihydroxyacetone in amino acid catalyzed mannich-type reactions [J]. Angew Chem Int Ed, 2005, 44: 4077-4079.
[8] HANESSIAN S, PHAM V. Catalytic asymmetric conjugate addition of nitroalkanes to cycloalkenones [J]. Org Lett, 2000, 2: 2975-2978.
[9] LIST B, POJARLIEV P, MARTIN H J. Efficient proline-catalyzed michael additions of unmodified ketones to nitro olefins [J]. Org Lett, 2001, 3: 2423-2425.
[10] MERINO P, TEJERO T. Organocatalyzed asymmetric α-aminoxylation of aldehydes and ketones-an efficient access to enantiomerically pure α-hydroxycarbonyl compounds, diols, and even amino alcohols [J]. Angew Chem Int Ed, 2004, 43: 2995-2997.
[11] ZHONG G F. A facile and rapid route to highly enantiopure 1,2-diols by novel catalytic asymmetric α-aminoxylation of aldehydes [J]. Angew Chem Int Ed, 2003, 42: 4247-4250.
[12] LIST B. Direct catalytic asymmetric α-amination of aldehydes [J]. J Am Chem Soc, 2002, 124: 5656-5657.
[13] IMBRIGLION J E, MBRIGLI J E, VASBINDER M M, et al. Dual catalyst control in the amino acid-peptide-catalyzed enantioselective baylis−hillman reaction[J]. Org Lett, 2003, 5: 3741-3743.
[14] VIGNOLA N, LIST B. Catalytic asymmetric intramolecular α-alkylation of aldehydes [J]. J Am Chem Soc, 2004, 126: 450-451.
[15] SHEN K, LIU X H, LI Q H, et al. Highly enantioselective cyanosilylation of ketones catalyzed by a bifunctional Ti(IV) complex [J]. Tetrahedron, 2008, 64: 147-153.
[16] XIONG Y, HUANG X, GOU S H, et al. Enantioselective cyanosilylation of ketones catalyzed by a nitrogen-containing bifunctional catalyst [J]. Adv Synth & Cata, 2006, 348:538-544.
[17] TANG Z, JIANG F, YU L, et al. Novel small organic molecules for a highly enantioselective direct aldol reaction [J]. J Am Chem Soc, 2003, 125: 5262- 5263.
[18] MONIKA R, VISHNUMAYA, SANDEEP K G, et al. Highly enantioselective direct aldol reaction catalyzed by organic molecules [J]. Org Lett, 2006, 8 (18): 4097-4099.
[19] TANIMORI S, NAKA T, KIRIHATA M. Synthesis of a new proline‐derived organic catalyst and its evaluation for direct aldol reaction [J]. Synth Comm, 2004, 34(22): 4043-4048.
[20] QIN B, LIU X H, SHI J, et al. Enantioselective cyanosilylation of α,α-dialkoxy ketones catalyzed by proline-derived in-situ-prepared N-oxide as bifunctional organocatalyst [J]. J Org Chem, 2007, 72 (7):2374-2378.
Synthesis and application of L-Pyrrolidine-2-carboxamide derivatives in asymmetric catalytic reaction
LI Qing-han, DING Yong, ZHAO Zhi-gang, ZHANG Gang, CHEN Feng
(School of Chemistry and Environmental Protection Engineering, Southwest University for Nationalities, Chengdu 610041, P.R.C.)
Six L-Pyrrolidine-2-carboxamide derivatives3(a-d,f,g)were synthesized from L-Pyrrolidine-2-carboxylic acid react with different chiral aminoalcohol and aliphatic amino. Their catalysis was evaluated in asymmetric alkylation of aldehydes and asymmetric cross-coupling of propargylic carbonates react with Trimethylaluminum. The result indicated that the compounds exhibited different catalysis in asymmetric catalytic reaction. Their structures have been determined by1H NMR and13C NMR data.
L-Pyrrolidine-2-carboxamide derivative; asymmetric alkylation; asymmetric cross-coupling
O621.3
A
1003-4271(2014)04-0499-05
10.3969/j.issn.1003-4271.2014.04.05
2014-05-19
李清寒(1972-), 男, 汉族, 四川中江人, 博士后, 副教授, 硕士生导师, 主要从事生物有机、金属有机和不对称合成研究. E-mail: lqhchem@163.com.
西南民族大学中央高校基本科研业务费专项基金(No.12NZYTD03); 西南民族大学2013年研究生学位点建设项目(No. 2013XWD-S0703); 西南民族大学校学术带头人培养基金(No.381010).

