苯并噻唑衍生物的生物活性及其构效关系研究进展
武祥龙,李海亮,卢 娜,牛银波,李晨睿,梅其炳
(1.西北工业大学生命学院空间生物实验模拟技术国防重点学科实验室,陕西西安710072;2.石药集团中奇制药技术(石家庄)有限公司,河北石家庄050035)
构效关系研究已经成为药物化学领域重要的研究方向之一。苯并噻唑衍生物属于含氮杂环化合物,因其广泛的生物活性而倍受关注。相关研究主要集中在:抗肿瘤[1]、抗菌[2]、驱虫剂[3]、镇痛剂[4]、抗炎[5]、抗惊厥[6]、抗结核[7]、抗痉挛[8]、抗疟疾[9]、治疗糖尿病[10]、抗氧化[11]、植物生长调节剂[12]等。
苯并噻唑的结构式如图1所示。Prabhu等[13]总结了苯并噻唑衍生物结构与其生物学活性之间的关系:2-位引入苯环表现出抗肿瘤、抗TB(肺结核)、抗惊厥和抗炎等活性;6-位引入卤素表现出抗惊厥活性;6-位引入甲氧基表现出抗老年痴呆的活性;6-位引入苯环表现出抗炎活性等。作者在此总结了近年来苯并噻唑衍生物的生物活性及其构效关系的研究进展。
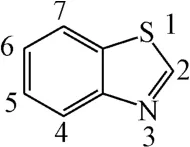
图1 苯并噻唑的结构式Fig.1 The structural formula of benzothiazole
1 苯并噻唑衍生物的抗肿瘤活性
1.1 苯并噻唑2-位衍生物对HeLa细胞的抑制作用
Prabhu等[13]合成了苯并噻唑衍生物1a~1h(图2),研究了其对HeLa细胞的抑制效果。结果表明,1a对HeLa细胞的抑制活性较弱,引入氯原子后的1b对 HeLa细胞的抑制作用与顺铂相当,而IC50仅为顺铂的34.4%。苯环上取代基的位置决定其抗肿瘤活性:对位取代的活性优于其它位置,可能因为对位取代的衍生物能更好地与受体结合;间位有氟原子存在时活性很弱。取代基的类型对活性影响也较大,对位各取代基的活性大小依次为:p-Cl>p-OCH3>p-CH3>p-OH(IC50<18μg·mL-1),对位引入-NO2后活性较弱(IC50>100μg·mL-1)。
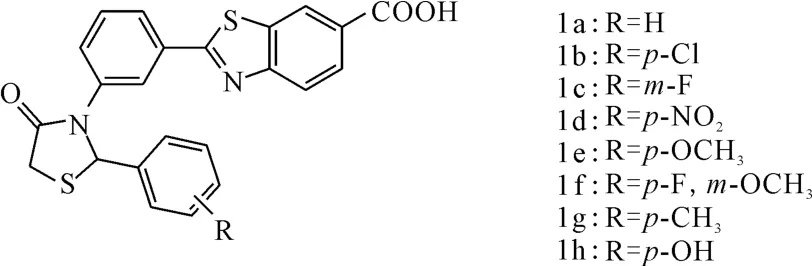
图2 化合物1a~1h的结构式Fig.2 The structural formula of compound 1a~1h
Venkatesh等[14]合成了苯并噻唑衍生物2a~2f(图3),并考察了其对HeLa细胞增殖的影响。结果表明,胍基丙酸苯并噻唑衍生物的活性优于胍基丙酸喹唑啉衍生物。构效关系研究表明,苯并噻唑环上C6位-OH、-COOH和-SO2NH2对活性起重要作用,因为可形成氢键。C6位上-OH取代的化合物2f活性最强(IC50=2μmol·L-1),活性大小依次为:-OH>-COOH>-SO2NH2。
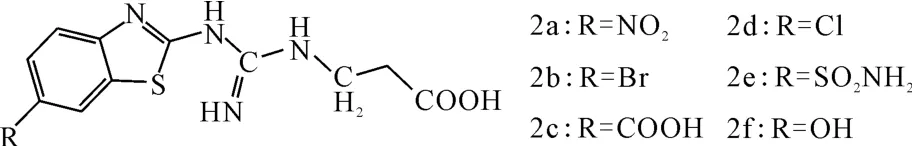
图3 化合物2a~2f的结构式Fig.3 The structural formula of compound 2a~2f
1.2 苯并噻唑2-位衍生物对HepG2和MCF-7细胞增殖的影响
图4 化合物3~3w的结构式Fig.4 The structural formula of compound 3~3w

表1 化合物3~3w的构效关系Tab.1 Structure-activity relationship of compound 3~3w
Wang等[15]合成了具有抗肿瘤活性的苯并噻唑衍生物3~3w(图4),其构效关系(表1)如下:(1)对于R1:3b、3f、3q的活性高于化合物3,3a与化合物3接近,3r较化合物3活性降低,表明氯原子和甲氧基对构效关系的影响趋势不明确。(2)对于R2:苯环C4位的氢被氯原子取代能提高化合物的活性(3dvs 3,3evs 3a,3fvs 3b,3g vs 3c)。增加的效能主要来源于π电子效应、+σ效应,或者两者共同作用的结果[16];C4位的氢被硝基取代则活性消失(3h~3k);C2位的氢被甲氧基取代能显著增加其活性,如3m和3n,相比于化合物3,3m对HepG2的活性大约提高了57倍、对MCF-7的活性提高了32倍;C2位的氢被甲基取代得到化合物3p~3s,其中3p~3r的活性优于化合物3,表明甲基是结构修饰的有效取代基,而3s的活性消失,表明两边的苯基不能同时被移除;R2上C2位的氢被氯甲基取代得到活性很高的化合物3t~3w,表明氯甲基能显著提高母体化合物的活性;当R2为氯甲基时,即使R1处没有苯环存在,仍然具有一定活性(3w),进一步确定氯甲基在该类苯并噻唑衍生物的活性中发挥着重要作用。
1.3 含苯并噻唑结构的席夫碱对乳腺癌细胞的抑制作用
Solomon等[17]将吲哚醌类曼尼西碱与2-氨基苯并噻唑相连,获得苯并噻唑的席夫碱衍生物(图5),研究了它们对3种乳腺癌细胞及2种正常乳腺细胞的抑制效果。结果表明,席夫碱衍生物具有更好的活性。化合物5e(R=R1=H,R2=morpholinyl)的抑制效果与顺铂相当。虽然其对正常乳腺细胞的抑制率较高,但也仅约为对乳腺癌细胞抑制率的50%。
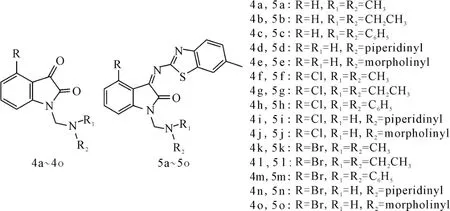
图5 曼尼西碱(4a~4o)和席夫碱(5a~5o)的结构式Fig.5 The structural formula of Mannichisatin(4a~4o)and Schiff base analogs(5a~5o)
2 苯并噻唑衍生物的抗菌活性
化合物6a~6f(图6)普遍表现出抗细菌和抗真菌的活性。其构效关系如下[18]:(1)含取代基的苯并噻唑化合物比不含取代基的具有更好的抗菌活性;(2)6b和6e抗菌效果最好,对革兰氏阴性菌、革兰氏阳性菌和真菌均有较高的活性。主要是因为其苯并噻唑环上含有硝基;(3)亲脂性对抗菌活性起关键作用。例如,6e、6f的油水分配系数较低,分别为(0.62±0.97)、(0.39± 0.97),表现出较好的抗菌活性,而6a、6c和6d的油水分配系数较高,分别为(3.37±0.91)、(3.33±0.92)[19]、(2.68±0.91),亲脂性较强,这可能是导致这些化合物抗菌活性较弱的原因之一。总体而言,苯环上吸电子基团对其抗菌和抗真菌作用是有利的,而亲脂性在生物活性中起着尤为重要的作用。
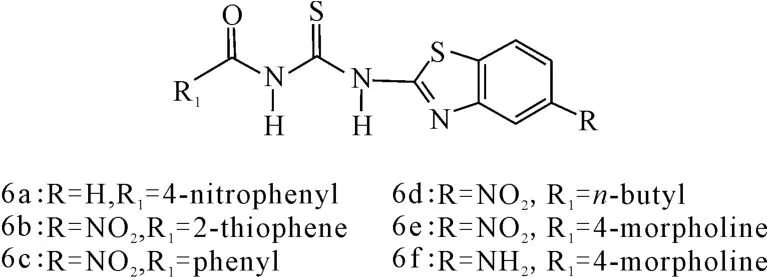
图6 化合物6a~6f的结构式Fig.6 The structural formula of compound 6a~6f
化合物7a~7d和8a~8e(图7)均显示出抗细菌和抗真菌的活性。而且,与抗菌药阿莫西林和氟康唑相比,7a和7b、8a和8b对革兰氏阳性菌、革兰氏阴性菌和真菌的抑制作用更强。当R1和R2为氟或溴原子时,抗微生物活性较强;R1和R2为-CH3或-OCH3时,活性则大大降低;此外,苯并噻唑母核上引入异喹啉或吲哚基团,对活性的改善是有益的[20]。
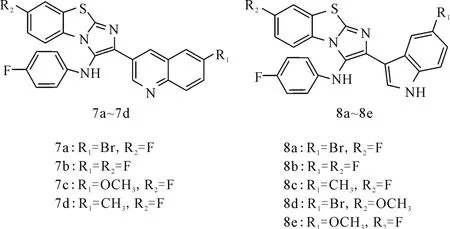
图7 化合物7a~7d和8a~8e的结构式Fig.7 The structural formula of compound 7a~7dand 8a~8e
Ouyang等[21]合成了苯并噻唑2-氨基衍生物9(图8,取代基略),其中含有较多卤素取代和丙二胺连接臂的化合物具有较好的抗菌活性,尤其是C3、C4位二取代效果更佳。这些化合物对革兰氏阳性菌的活性高于对革兰氏阴性菌的活性,对大肠杆菌也具有较好的抑菌活性。当n 1、R1为氟原子、R2为氯原子时化合物的活性最好,其对甲氧西林敏感和耐受的金黄色葡萄球菌的最小抑菌浓度(MIC)分别为0.5μg·L-1和1μg·L-1,对盘尼西林敏感和耐受的肺炎链球菌的MIC均为4μg ·L-1,对万古霉素耐受和非耐受的乳酸菌抑制效果也较好(MIC<2μg·L-1)。该类化合物在耐药菌株的抑制方面可能具有较好的应用前景。

图8 苯并噻唑衍生物9的结构式Fig.8 The structural formula of benzothiazole derivative 9
3 苯并噻唑衍生物的镇痛和抗炎活性
Shafi等[22]合成的苯并噻唑衍生物10a~10d(图9)具有较好的镇痛和抗炎作用,其中10b和10c比布洛芬的镇痛效果好,10a和10d与布洛芬镇痛效果相当。这些化合物也表现出潜在的抗炎活性,在口服剂量下不造成胃溃疡和胃黏膜细胞的破坏,而布洛芬在低剂量下引起黏膜和基底膜的损害,高剂量下甚至引起胃内上皮细胞的脱落。可见,这类化合物是潜在的抗炎试剂。
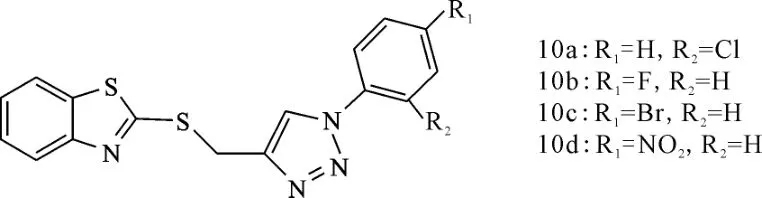
图9 化合物10a~10d的结构式Fig.9 The structural formula of compound 10a~10d
4 苯并噻唑衍生物对酶的抑制作用
4.1 苯并噻唑衍生物对Lck的抑制作用
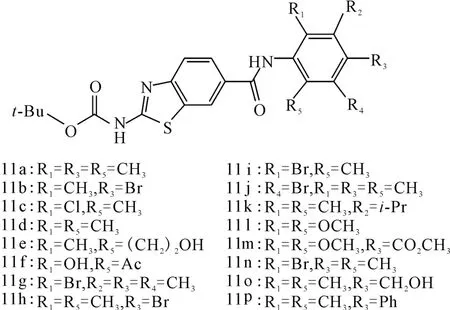
图10 化合物11a~11p的结构式Fig.10 The structural formula of compound 11a~11p
Das等[23]在研究噻唑类p56lck(Lck,淋巴细胞特异性蛋白酪氨酸激酶)抑制剂的过程中,发现化合物11a(图10)对Lck具有较好的抑制作用(IC50=0.29μmol ·L-1)。随后合成了一系列11a衍生物,其构效关系如下:(1)化合物11a中酰胺部分的异构体及苯环上的取代产物活性均没有改善;(2)苯胺环上的取代基对活性影响较大;(3)C4位的CH3被H(11d)、Br(11h)或-CH2OH(11o)取代后,活性变化不大,但被-CO2Me或较大的苯环取代后,活性降低;(4)C3和C5位引入取代基对活性不利(11g,11j,11k);(5)11d的C2位甲基被Cl取代后,活性不受影响,但被Br(11i)或-(CH2)2OH(11e)取代后,活性丧失;(6)从11b和11h活性的差异可见,苯胺环上C2和C6位取代对活性具有重要影响;(7)C2位被溴(11i)或极性基团(11f,11l)取代后,活性丧失。
4.2 苯并噻唑衍生物对葡萄糖醛酸酶的抑制作用
苯并噻唑的C2位上连接苯基时,如果苯环上有合适的取代基(如连有羟基),能表现出葡萄糖醛酸酶抑制活性,当苯环上的取代基存在卤素、甲基、甲氧基、叔胺基时,不表现酶抑制活性。因此,亲水性基团是酶抑制活性的关键影响因素,而且苯环上邻对位羟基取代较间位羟基取代活性更好。当两个羟基相邻时,活性降低或者无活性(2,4,5-三羟基取代例外)[24]。
4.3 苯并噻唑衍生物对酒精脱氢酶的抑制作用
Xie等[25]合成多个含苯并噻唑的脲类化合物(图11),发现对Aβ-结合性酒精脱氢酶具有抑制作用。研究表明,脲基是抑制活性必需的结构。1mmol·L-1脲基能完全占据Aβ-结合性酒精脱氢酶的结合位点,而氨基化合物(12a~12k)在高浓度下(1mmol·L-1)的抑制率也不足50%。由此推测脲基部分氢键供体参与Aβ和ABAD的结合。以杂环或者多环替代苯脲,活性通常更低。苯并噻唑环和苯脲环的取代基对抑制活性有较大影响。苯并噻唑环上氢被小的吸电子基团氯或氟取代后,活性增强。而且,在苯脲的对位引入羟基的化合物具有显著的活性。这些因素共同决定了15h和15l的效果(IC50<10μmol·L-1)。
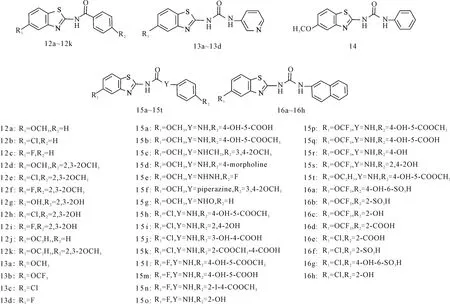
图11 Aβ-结合性酒精脱氢酶抑制性苯并噻唑类衍生物的结构式Fig.11 The structural formula of benzothiazole derivatives inhibiting Aβ-ABAD
5 苯并噻唑衍生物与多巴胺受体的亲和力
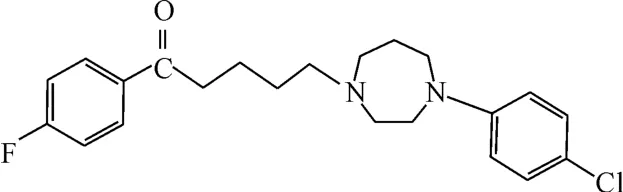
图12 化合物SYA013的结构式Fig.12 The structural formula of compound SYA013
研究发现SYA013(图12)是结合多巴胺受体的1种先导化合物,能结合D2受体、D3受体、D4受体、5HT1A、5HT2A。而且,7倍ED50剂量下,其仍未出现非典7型抗精神病药物相关的强直性昏厥[26]。
Peprah等[27]以苯并噻唑取代SYA013丁酰苯中4-氟-苯基部分,合成了化合物16a~16g(图13),希望筛选出对多巴胺受体选择性较好的化合物。亲和力实验表明,16a~16d只对多巴胺受体表现出微弱的亲和力;而引入脱品醇形成的化合物16f对D3受体表现出很好的亲和力(D2=180nmol·L-1,D3=16nmol·L-1,D4= 508nmol·L-1),而且对D3受体具有较好的选择性(D2/D3=11.3,D4/D3=31.8)。临床研究表明,选择性D3受体拮抗剂能减少药物滥用、逆转认知功能障碍,且对精神分裂症和帕金森患者有较好的效果,有望用于治疗某些精神疾病[28];将化合物16f的羰基移除后形成化合物16g,对D2的亲和力明显增强,而对D3和D4的亲和力变化不大,而且化合物16f和16g对5-HT受体的亲和力大大削弱。由此可见,苯并噻唑连接芳基脱品醇有望成为选择性D3受体拮抗剂的新的结构模式。
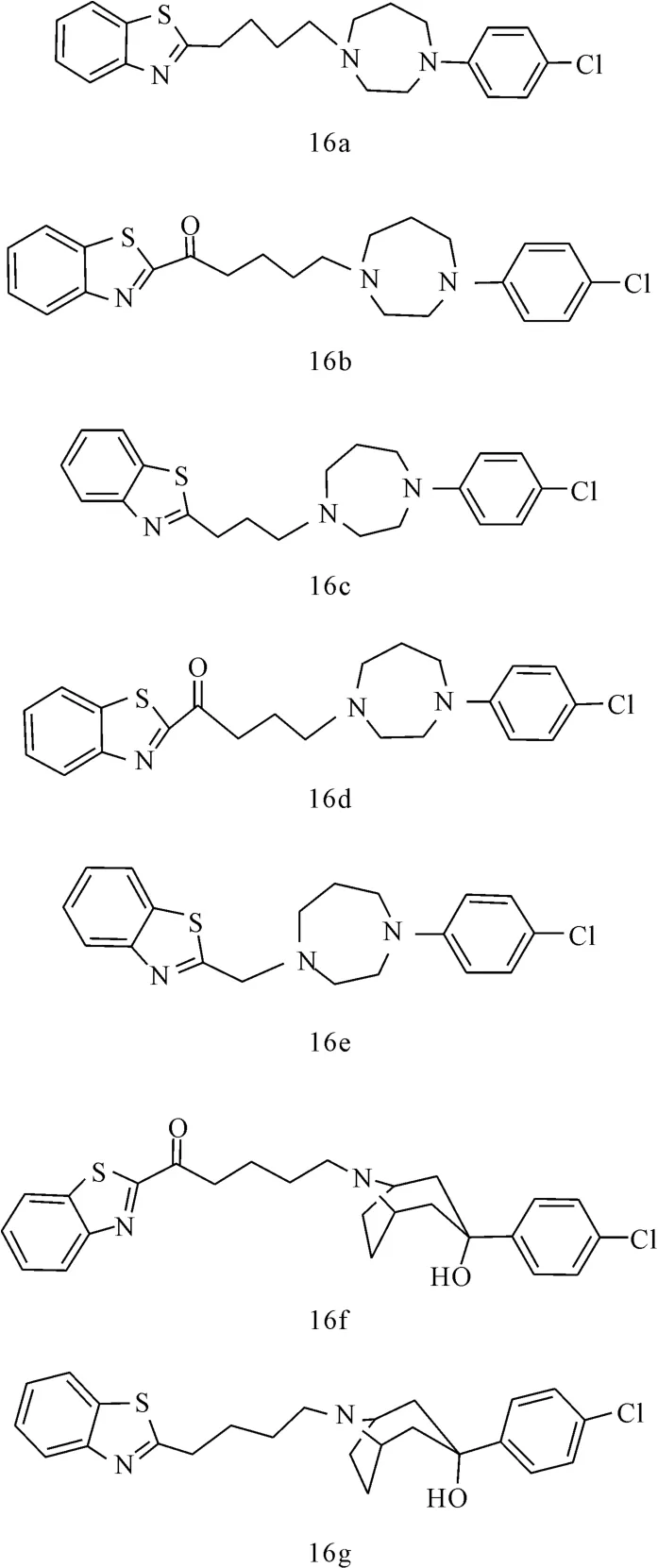
图13 化合物16a~16g的结构式Fig.13 The structural formula of compound 16a~16g
6 苯并噻唑衍生物的抗结核活性
Telvekar等[29]合成了苯并噻唑的席夫碱衍生物(图14,取代基略)。其中卤素取代的化合物具有较好抗结核活性,而苯并噻唑环上C6位引入甲基、甲氧基和硝基会对抗结核活性产生不利的影响,含2,4-二氯-二苯醚结构的化合物的活性较好。测定了中间体17a(R=H)、17b(R=Cl)、17c(R=CH3)和18a(R1=R2=R3=R4=R5=H)、18b(R1=Cl,R2=R3=R4=R5=H)、18c(R3=Cl,R1=R2=R4=R5=H)的MIC依次为:287.50μg· mL-1、232.80μg·mL-1、221.87μg·mL-1、132.80 μg·mL-1、123.44μg·mL-1、117.19μg·mL-1,是其拼接产物19a(R=R1=R2=R3=R4=R5=H)、19g(R=Cl,R1=R2=R3=R4=R5=H)、19m(R=CH3,R1=R2=R4=R5=H,R3=Cl)(MIC分别为12.69μg·mL-1、2.00μg·mL-1、15.00μg·mL-1)的8倍以上,说明席夫碱结构在抗结核活性中发挥重要作用。
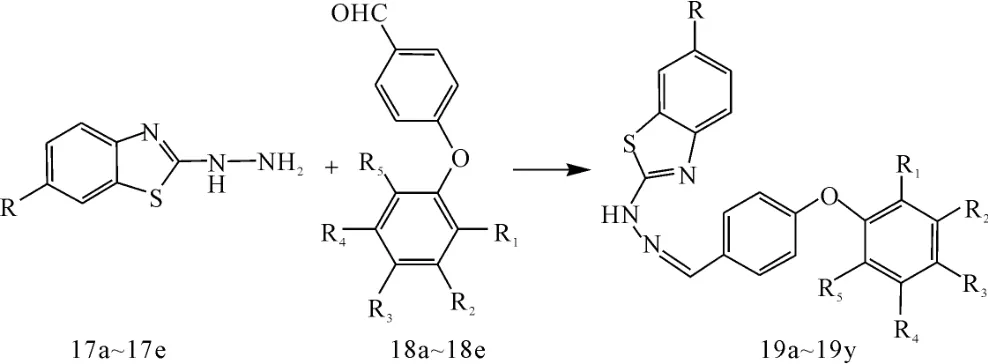
图14 苯并噻唑席夫碱类衍生物Fig.14 Schiff base derivatives of benzothiazole
7 结语
苯并噻唑衍生物具有重要的生物活性,研究其结构和生物活性关系对寻找新的先导化合物以开发新药具有重要意义。未来的发展趋势是将实验研究和理论计算研究相结合,以促进苯并噻唑衍生物的构效关系研究,为更好地研制新药提供指导。
[1] BNTEAU V,BESSON T,GUILLARD J,et al.Synthesis and in vitro antitumour evaluation of benzothiazole-2-carbonitrile derivatives[J].Eur J Med Chem,1999,34(12):1053-1060.
[2] KUMAR S.Synthesis and antimicrobial study of some Schiff bases of sulfonamides[J].Journal of Current Pharmaceutical Research,2010,1(1):39-42.
[3] NADKARNI A B,KAMATH R V,KHADSE G B.Synthesis and anthelmintic activity of substituted phenyl imidazo[2,1-b]benziothiazoles[J].Indian J Heterocycl Chem,2000,9(4):309-310.
[4] NAPOLITANO A,Di DONATO P,PROTA G.Zinc-catalyzed oxidation of 5-S-cysteinyldopa to 2,2′-bi(2 H-1,4-benzothiazine):Tracking the biosynthetic pathway of trichochromes,the characteristic pigments of red hair[J].J Org Chem,2001,66(21):6958-6966.
[5] KUZ′MIN V,LOZITSKY V,KAMALOV G,et al.Analysis of the structure-anticancer activity relationship in a set of Schiff bases of macrocyclic 2,6-bis(2-and 4-formylaryl-oxymethyl)pyridines[J].Acta Biochimica Polonica,2000,47(3):867-875.
[6] HAYS S J,RICE M J,ORTWINE D F,et al.Substituted 2- benzothiazolamines as sodium flux inhibitors:Quantitative structure-activity relationships and anticonvulsant activity[J].Journal of Pharmaceutical Sciences,1994,83(10):1425-1432.
[7] PROTA G,d′ISCHIA M,NAPOLITANO A,et al.The chemistry of melanins and related metabolites[J].Medicinal Research Reviews,1988,8(4):525-556.
[8] NAPOLITANO A,MEMOLI S,PROTA G,et al.A new insight in the biosynthesis of pheomelanins:Characterization of a labile 1,4-benzothiazine intermediate[J].J Org Chem,1999,64(9):3009-3011.
[9] WAKAMATSU K,KAGESHITA T,FURUE M,et al.Evaluation of 5-S-cysteinyldopa as a marker of melanoma progression:10 Years′experience[J].Melanoma Research,2002,12(3):245-253.
[10] NAPOLITANO A,VINCENSI M R,Di DONATO P,et al.Microanalysis of melanins in mammalian hair by alkaline hydrogen peroxide degradation:Identification of a new structural marker of pheomelanins[J].Journal of Investigative Dermatology,2000,114(6):1141-1147.
[11] PUSTOSHNAYA L,PUSTOSHNYI V,MAZITOVA A,et al.Antioxidant effect of triazinone derivatives in thermal oxidation of polyisoprene[J].Polymer Degradation and Stability,2000,70(1):39-41.
[12] LOOS D,SIDOOVA E,SUTORIS V.Benzothiazole derivatives.48.Synthesis of 3-alkoxycarbonylmethyl-6-bromo-2-benzothiazolones and 3-alkoxycarbonylmethyl-6-nitro-2-benzothiazolones as potential plant growth regulators[J].Molecules,1999,4(4):81-93.
[13] PRABHU P P,PANNEERSELVAM T,SHASTRY C,et al.Synthesis and anticancer evaluation of 2-phenyl thiaolidinone substituted 2-phenyl benzothiazole-6-carboxylic acid derivatives[J].Journal of Saudi Chemical Society,http://dx.doi.org/10.1016/j.jscs.2012.02.001.
[14] VENKATESH P,TIWARI V S.Design and synthesis of quinazolinone,benzothiazole derivatives bearing guanidinopropanoic acid moiety and their Schiff bases as cytotoxic and antimicrobial agents[J].Arabian Journal of Chemistry,http://dx.doi.org/10.1016/j.arabjc.2011.09.004.
[15] WANG Z,SHI X H,WANG J,et al.Synthesis,structure-activity relationships and preliminary antitumor evaluation of benzothiazole-2-thiol derivatives as novel apoptosis inducers[J].Bioorg Med Chem Lett,2011,21(4):1097-1101.
[16] TOPLISS J G.Utilization of operational schemes for analog synthesis in drug design[J].J Med Chem,1972,15(10):1006-1011.
[17] SOLOMON V R,HU C,LEE H.Hybrid pharmacophore design and synthesis of isatin-benzothiazole analogs for their anti-breast cancer activity[J].Bioorg Med Chem,2009,17(21):7585-7592.
[18] SAEED S,RASHID N,JONES P G,et al.Synthesis,character-ization and biological evaluation of some thiourea derivatives bearing benzothiazole moiety as potential antimicrobial and anticancer agents[J].Eur J Med Chem,2010,45(4):1323-1331.
[19] HOEY A J,JACKSON C M,PEGG G G,et al.Characteristics of cyanopindolol analogues active at theβ3-adrenoceptor in rat ileum[J].British Journal of Pharmacology,1996,119(3):564-568.
[20] RIDA S M,EL-HAWASH S A M,FAHMY H T Y,et al.Synthesis of novel benzofuran and related benzimidazole derivatives for evaluation of in vitro anti-HIV-1,anticancer and antimicrobial activities[J].Archives of Pharmacal Research,2006,29(10):826-833.
[21] OUYANG L,HUANG Y,ZHAO Y,et al.Preparation,antibacterial evaluation and preliminary structure-activity relationship(SAR)study of benzothiazol-and benzoxazol-2-amine derivatives[J].Bioorg Med Chem Lett,2012,22(9):3044-3049.
[22] SHAFI S,ALAM M M,MULAKAYALA N,et al.Synthesis of novel 2-mercapto benzothiazole and 1,2,3-triazole based bis-heterocycles:Their anti-inflammatory and anti-nociceptive activities[J].Eur J Med Chem,2012,49:324-333.
[23] DAS J,LIN J,MOQUIN R V,et al.Molecular design,synthesis,and structure-activity relationships leading to the potent and selective p56lckinhibitor BMS-243117[J].Bioorg Med Chem Lett,2003,13(13):2145-2149.
[24] KHAN K M,RAHIM F,HALIM S A,et al.Synthesis of novel inhibitors ofβ-glucuronidase based on benzothiazole skeleton and study of their binding affinity by molecular docking[J].Bioorg Med Chem,2011,19(14):4286-4294.
[25] XIE Y,DENG S,CHEN Z,et al.Identification of small-molecule inhibitors of the Aβ-ABAD interaction[J].Bioorg Med Chem Lett,2006,16(17):4657-4660.
[26] ABLORDEPPEY S Y,ALTUNDAS R,BRICKER B,et al.Identification of a butyrophenone analog as a potential a typical antipsychotic agent:4-[4-(4-chlorophenyl)-1,4-diazepan-1-yl]-1-(4-fluorophenyl)butan-1-one[J].Bioorg Med Chem,2008,16(15):7291-7301.
[27] PEPRAH K,ZHU X Y,EYUNNI S V K,et al.Structure-activity relationship studies of SYA013,a homopiperazine analog of haloperidol[J].Bioorg Med Chem,2012,20(5):1671-1678.
[28] MICHELI F.Recent advances in the development of dopamine D3receptor antagonists:A medicinal chemistry perspective[J].Chem Med Chem,2011,6(7):1152-1162.
[29] TELVEKAR V N,BAIRWA V K,SATARDEKAR K,et al.Novel 2-(2-(4-aryloxybenzylidene)hydrazinyl)benzothiazole derivatives as anti-tubercular agents[J].Bioorg Med Chem Lett,2012,22(1):649-652.

