药用植物浸提液溶藻效果和溶藻机理的研究
廖春丽, 吴创业, 郑 瑞, 孙宁聪, 鞠慧丽, 胡继勇, 单林娜
(1.河南城建学院生命科学与工程学院,河南 平顶山 467044; 2.平顶山质量工程学院食品与化工系,河南 平顶山 467044; 3.河南城建学院化学与材料工程学院,河南 平顶山 467044)
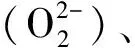
1 材料与方法
1.1材料
1.1.1 药用植物 9种药用植物分别选用重楼(ParispolyphyllaSmith var.chinensis (Franch.) )、薄荷(MenthahaplocalyxBrig.) 、独活(RadixAngelicaepubescentis.) 、扁蓄(PolygonumaviculareL.)、山豆根(SophoratonkinensisGapnep.)、黄连(CoptischinensisFranch.)、泽泻(Alismaorientalis(Sam.) Juzep.)、柴胡(BupleurumchinensDC.)、川椒(Zanthoxylumbungeanum.)的药用部位的干品,材料来源于平顶山市区国大药房中药店.
1.1.2 藻种 藻种选用小球藻,铜绿微囊藻,惠氏微囊藻.这些藻种来自中科院水生生物研究所藻种保藏中心.藻种经活化后,在25 ℃、光照强度为2 500 lx、光暗期为12 h∶12 h的条件下培养.藻种的接种及传代过程均严格按照无菌操作规则进行.藻类培养基:绿藻使用SE培养基[9];蓝藻使用BG11培养基[10].
1.2方法
1.2.1 药用植物浸提液的制备 分别称取上述药用植物干品2 g,加入50 mL 蒸馏水,100 ℃水浴1 h,最后过滤定容至50 mL,其药用植物浸提液质量密度为4 g·L-1.
1.2.2 药用植物对藻的溶藻效果的测定 将药用植物浸提液按1∶5的接种量投入到对数生长期的惠氏微囊藻、小球藻和铜绿微囊藻的藻液中(藻的密度控制为106个·mL-1),培养条件与藻的相同,设置对照和加药用植物样各3组平行.加药用植物溶藻5 d后测定藻细胞密度,计算出不同药用植物对不同藻的溶藻率.根据下面的公式计算出药用植物的溶藻率:
R=(1-N/N0)×100%
式中:R为藻细胞抑制率( %) ;N为处理组藻细胞密度(个·mL-1) ;N0为对照组藻细胞密度(个·mL-1)
1.2.3 粗酶液的制备 将药用植物浸提液按体积比1∶5的接种量投入到对数生长期的藻液中(藻的浓度控制为106个·mL-1),培养条件与藻的相同.设置对照和加药用植物样各3组平行,加药用植物溶藻后,每天取1次样,连续取样5 d,取溶藻样3 000 r·min-1离心5 min,然后把离心过的藻细胞分别加预冷至4 ℃的0.05 mol·L-1的磷酸缓冲液(提取SOD,CAT,POD的磷酸缓冲液pH值分别为7.8,7.0,5.5)和少量石英砂在 0~4 ℃冰浴中研磨,匀浆液7 000 r·min-1离心10 min,取上清液即粗酶液测定酶活性.
1.2.4 各种酶活性的测定 超氧化物歧化酶(SOD)∶3 mL反应体系包括: 30 mL 50 mmol·L-1的 pH值7.8磷酸缓冲液,依次溶入Met,NBT,核黄素与EDTA,使它们的浓度分别为1.3×10-2mol·L-1,6.3×10-5mol·L-1,1.3×10-6mol·L-1与1×10-4mol·L-1.试验组加入上述3 mL反应体系和30 μL粗酶液(用未加粗酶液的反应体系做对照),在25~30 ℃下用光强4 000 lx的荧光灯管(可用15 W荧光灯)进行光照,15~20 min后,出现颜色变化,停止光照,在560 nm测定吸光度值.过氧化物酶: 反应体系为: 50 mL 50 mmol·L-1的 pH值5.5磷酸缓冲液,加入28 μL愈创木酚,愈创木酚溶解冷却后加入19 μL 30% H2O2.试验组加入上述3 mL反应体系和1 mL粗酶液(对照组加入上述3 mL反应体系和1 mL 50 mmol·L-1的 pH值5.5磷酸缓冲液),反应由加入启动,25 ℃下测定470 nm吸光度值,把取的样每隔1 min读数1次,3 min内吸光度值变化为1个计算单位.过氧化氢酶采用碘量法测定[11].
2 结果与分析
2.1各种药用植物浸提液的除藻效果
在无菌条件下,分别将9种药用植物浸提液按1∶5的接种量投入到对数生长期的藻液中(藻的密度控制为106个· mL-1),置光照培养箱中培养,此时上述药用植物浸提液的质量浓度均为4 g·L-1.对药用植物重楼、川椒、薄荷、独活、扁蓄、山豆根、黄连、泽泻、柴胡进行初步的抑藻筛选试验(图1)
从图1的除藻效果来看,重楼和黄连这2种药用植物浸提液对铜绿微囊藻、惠氏微囊藻、小球藻的除藻效果较好.重楼浸提液对3种藻除藻率分别达到了78%,70%,60%;黄连浸提液对3种藻除藻率分别达到了75%,75%,63%.从这些数据中又看出,重楼浸提液对惠氏微囊藻的除藻效果最好,黄连浸提液对铜绿微囊藻,惠氏微囊藻的除藻效果最好.然后以铜绿微囊藻和惠氏微囊藻为研究对象,研究重楼和黄连这2种药用植物浸提液对它们的抗氧化体系酶活性的影响.

图1 各种药用植物浸提液的除藻效果
2.2药用植物浸提液对藻类SOD活性的影响
考虑到单位体积培养液中的藻细胞数不同,因此将培养至对数生长期的藻类计数,计算出单位藻细胞的SOD活性,以△A470(min·106cells)-1表示.图2和图3显示出药用植物浸提液(重楼和黄连)对铜绿微囊藻和惠氏微囊藻超氧化物歧化酶活性的影响.对照组随着时间的延长,铜绿微囊藻和惠氏微囊藻的SOD活性逐渐增加;试验组,刚开始时重楼和黄连药用植物浸提液都对2种藻的超氧化物歧化酶活性有促进作用,但随着作用时间的延长,铜绿微囊藻和惠氏微囊藻的SOD活性逐渐降低.而且试验组超氧化物歧化酶的活性都低于对照组的活性,这就说明了超氧化物歧化酶SOD不能及时消除过量的氧自由基,这些增加的自由基会氧化细胞膜等膜质结构,破坏藻细胞的正常生长与繁殖,进而印证了重楼和黄连药用植物浸提液对铜绿微囊藻和惠氏微囊藻有溶解作用.

图2 重楼浸提液对藻SOD活性的影响
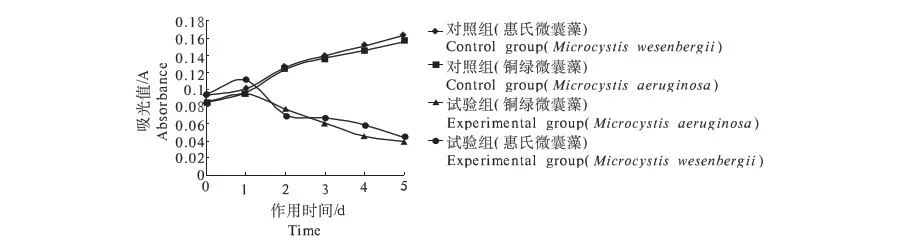
图3 黄连浸提液对藻SOD活性的影响
2.3药用植物浸提液对藻类CAT活性的影响
图4和图5显示出药用植物浸提液(重楼和黄连)对铜绿微囊藻和惠氏微囊藻过氧化氢酶活性的影响.本研究以被分解的H2O2量中,空白滴定值减去样品滴定值差为纵坐标,以作用时间为横坐标.可以看出随着时间的延长,铜绿微囊藻和惠氏微囊藻的SOD活性逐渐降低.
2.4药用植物浸提液对藻类POD活性的影响
黄连和重楼浸提液中的化感物质对2种藻的过氧化物酶(POD)的影响规律与其对SOD、CAT的影响规律相类似.图6和图7可以看出,随着时间的延长,铜绿微囊藻和惠氏微囊藻的SOD活性逐渐降低.

图4 重楼浸提液对藻CAT活性的影响

图5 黄连浸提液对藻CAT活性的影响
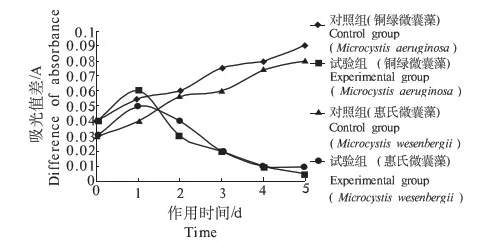
图6 黄连浸提液对藻POD活性的影响
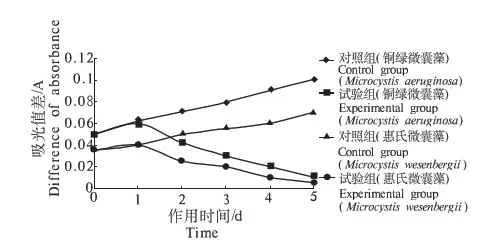
图7 重楼浸提液对藻POD活性的影响
3 结论与讨论

参考文献:
[1]ZHANG T T,CHEN C P,WU A P,et al.Allelopathic effects of several higher aquatic plants on algae[J].Journal of Biology,2007,24 (4):32-36.
[2]RICE E L.Allelopathy [M].2nd. edition.London:Academic Press,1984.
[3]VYVYAN J R.Allelochemicals as leads for new herbicides and agrochemicals [J].Tet radron,2002,58:1631-1646.
[4]柴民伟,石福臣,马 妍,等.药用植物浸提液抑制蛋白核小球藻生长的化感效应[J].生态学报,2010,30(18):4960-4966.
[5]BLACKHALLl M L,COOMBES J S,FASSET T R.The relationship between antioxidant supplements and oxidative stress in renal transplant recipients:A review [J].Asaio Journal,2004,50(5) :451-457.
[6]DELRIO D,SERAFINI M, PELLEGRINI N.Selected methodologies to assess oxidative/antioxidant status invivo:acritical review [J].Nutrition Metabolism and Cardiovascular Diseases,2002,12(6) : 343-351.
[7]FOYER C H,VANACKE H,GOMEZ L D,et al .Regulation of photosynthesis and antioxidant metaboli sminmaize leaves at optimal and chilling temperatures:review [J].Plant Physiology and Biochemistry,2002,40(6):659-668.
[8]MRUK D D,SILVEST RINI B,MO M Y,et al.Antioxidant superoxide dismutasea review:its function regulation in the testis and role in male fertility [J].Contraception,2002, 65(4) :305-311.
[9]中国科学院微生物研究所.一般细菌常用鉴定方法[M].北京:科学出版社,1978.
[10]汪 辉,刘兆普,魏 微,等.一株溶藻菌的分离、鉴定及其溶藻物质的研究[J].中国环境科学,2008,28(5):461-468.
[11]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.

