术后肠梗阻对大鼠脑内nesfatin-1表达影响
(青岛大学医学院山东青岛266021;*青岛市立医院)
术后肠梗阻对大鼠脑内nesfatin-1表达影响
武庆杰,胡沙沙,逄明杰*,祝海*,王萍*,郭菲菲,孙向荣,徐珞
(青岛大学医学院山东青岛266021;*青岛市立医院)
目的探讨术后肠梗阻对大鼠脑内nesfatin-1表达及临床意义。方法大鼠经腹腔注射硫酸仲丁巴比妥(100~150)mg/kg麻醉后行腹部手术,术后2小时后经心灌注固定,免疫组化观察大鼠脑内c-Fos和nesfatin-1免疫阳性神经元的表达。结果手术组大鼠下丘脑室上核(SON)(P<0.01),室旁核(PVN)(P<0.01),蓝斑(LC)(P<0.05)、动眼神经副核(EW)(P<0.01)、中缝苍白核(rRPa)(P<0.05)、孤束核(NTS)(P<0.01)、延髓腹外侧区(VLM)(P<0.01)神经元c-Fos表达显著增加,而nesfatin-1免疫阳性神经元表达无显著改变(P>0.05)。发现腹部手术可激活的c-Fos神经元中,在下丘脑SON内99%、apPVN内71%、lmPVN内47%、mmPVN内41%以及mp-PVN内9%表达nesfatin-1;在脑干、腹部手术可分别激活LC内91%、rRPa内82%、EW和VLM内74%、NTS 14%表达c-Fos的nesfatin-1神经元。结论腹部手术可激活下丘脑和脑干摄食相关中枢内nesfatin-1神经元,其对摄食和胃排空障碍疾病调控具有潜在临床意义。
腹部手术;Fos;下丘脑;NUCB2;术后肠梗阻;大鼠大脑;免疫组化;Nesfatin-1
动物腹部手术可造成术后肠梗阻模型,在胃肠道手术后,表现为有效抑制肠内容物转运,延迟胃排空。腹部手术中可激活实验动物和人类应激反应时的内分泌标记物[1-3]。其前研究报道过大鼠腹部手术后可激活大鼠大脑特定核团的神经元,包括下丘脑视上核(SON)、室旁核(PVN)及含儿茶酚胺的脑干区域如蓝斑(LC)、孤束核(NTS)、延髓腹外侧区(VLM)的神经元[4-5]。
Nesfatin-1是最近在下丘脑中发现的来源于前体蛋白NUCB2的含82个氨基酸的多肽,侧脑室注射或外周注射后可减少大鼠进食[6]。Nesfatin-1mRNA存在于大鼠多个核团[7-9],包括下丘脑和脑干中表达丰富的自主核团[9]。最近发现给大鼠侧脑室注射Nesfatin-1不仅可减少进食,而且会延迟胃排空[10]。在实验动物和人类[11]腹部手术后可造成胃肠梗阻现象,推测术后胃肠梗阻可能激活nesfatin-1神经元。因此,目前的研究,我们观察大鼠腹部手术造成术后肠梗阻是否能激活大脑中nesfatin-1神经元。
1 材料与方法
1.1 材料成年雄性SD大鼠,体重280~350 g,每笼4只,在特定温度、湿度、24 h昼夜循环光照条件下生活,自由进食和饮水。
1.2 方法
1.2.1 腹部手术16只大鼠分装在单独笼内,禁食20 h,自由饮水。在禁食后第10 h,经腹腔注射硫酸仲丁巴比妥(100~150mg/kg)麻醉大鼠,麻醉后四肢固定于手术台上,腹部备皮后碘伏消毒铺巾,于下腹部正中线做一个长约3 cm的切口,依次切开皮肤、腹壁肌肉后进腹。实验组大鼠(8只)术后将盲肠取出,用盐水湿纱布由盲肠末端自下而上擦拭肠管,反复6次左右,随后将盲肠放回腹腔,缝合肌肉和皮肤。麻醉和手术持续大约10min,动物在2~3min后苏醒。对照组大鼠(n=8)仅接受麻醉不进行腹部手术。
1.2.2 c-Fos和Nesfatin-1免疫组化染色大鼠经腹腔注射硫酸仲丁巴比妥(100~150mg/kg)麻醉[35],经心灌注固定,亦即用0.9%氯化钠溶液和4%多聚甲醛灌注固定。断头取脑,后固定12 h,10%蔗糖脱水24 h后速冻。冠状切片,用自动漂浮技术孵育脑片。加兔抗-c-Fos血清,4℃过夜,随后加入山羊抗兔IgG,孵育2 h。Fos显色用3,3'-二氨基联苯胺(DAB)和硫酸镍铬。脑片继续在兔抗鼠nesfatin-1孵育液中孵育12 h(℃),用生物素-羊抗兔IgG孵育2 h,3,3'-二氨基联苯胺(DAB)显色。切片梯度乙醇和二甲苯脱水,封片。深蓝色核染的是c-Fos细胞,棕色细胞质显色的是Nesfatin-1免疫阳性细胞,胞质为棕色,核染色为黑色的是双染细胞。
1.2.3 细胞计数光学显微镜下观察c-Fos和nesfatin-1免疫阳性细胞。通过Paxinos和Watson’s图谱定位,定量评估免疫反应细胞数。c-Fos和nesfatin-1免疫阳性细胞数=c-Fos或nesfatin-1平均细胞数/每个核团的细胞总数。
1.3 统计学处理用GraphPad Prism 3.0软件分析,所有数据采用方差分析和t检验。
2 结果
2.1 术后肠梗阻对脑内nesfatin-1-免疫阳性细胞表达的影响本研究定量分析结果显示,对照组和手术组大鼠SON或PVN内nesfatin-1免疫阳性细胞数无明显差异(P>0.05;图1和表1)。与对照组相比,手术处理组大鼠PVN内c-Fos免疫阳性神经元显著增加(表1),即:mpPVN(t=17.2;P<0.01)、mmPVN(t= 25.8,P<0.01)、lmPVN(t=19.5;P<0.01)和apPVN(t= 22.1;P<0.01)内c-Fos免疫阳性神经元表达显著增多。手术处理组大鼠下丘脑SON和PVN内c-Fos/ nesfatin-1双染细胞与对照组相比也显著增加(图1,表1),即:SON(t=6.9,P<0.01)、apPVN(t=58.4,P<0.01)、lmPVN(t=18.5,P<0.01),mmPVN(t=16.5,P<0.01)和mpPVN(t=6.9,P<0.01)内c-Fos/nesfatin-1双染细胞显著增多,腹部手术分别可激活SON内99%、apPVN内71%、lmPVN内47%、mmPVN内41%以及mpPVN内9%的表达c-Fos的nesfatin-1神经元,与对照组相比,**P<0.01,见图1。

图1 术后肠梗阻对视上核Nesfatin-1和c-Fos表达的影响
表1 腹部手术对大鼠下丘脑PVN nesfatin-1和c-Fos表达的影响(±s,number/section)

表1 腹部手术对大鼠下丘脑PVN nesfatin-1和c-Fos表达的影响(±s,number/section)
P均<0.01
组别n apPVN mpPVN mmPVN lmPVN对照组8 38.5±12.2 48.2±15.1 99.5±32.1 160.2±52.1手术组8 41.2±13.1 48.2±15.1 98.2±31.1 149.3±45.1
表2 腹部手术对大鼠下丘脑PVN c-Fos表达的影响(±s,number/section)

表2 腹部手术对大鼠下丘脑PVN c-Fos表达的影响(±s,number/section)
P均<0.01
组别n apPVN mpPVN mmPVN lmPVN对照组8 5.1±1.2 24.3±7.2 13.2±4.3 16.5±5.2手术组8 21.2±6.4 102.2±33.4 82.3±26.1 52.3±15.4
表3 腹部手术对大鼠下丘脑PVN c-Fos+Nesfatin-1表达的影响(±s,number/section)

表3 腹部手术对大鼠下丘脑PVN c-Fos+Nesfatin-1表达的影响(±s,number/section)
P均<0.01
组别n apPVN mpPVN mmPVN lmPVN对照组8 2.1±0.9 3.1±1.2 2.2±0.8 2.3±0.9手术组8 17.2±5.1 23.3±6.1 30.2±9.1 18.3±5.6
注:apPVN:室旁核前侧小细胞区,mpPVN:室旁核内侧小细胞区,mmPVN:室旁核内侧大细胞区,lmPVN:室旁核侧面大细胞区。
2.2 术后肠梗阻对中脑和脑干nesfatin-1和c-Fos免疫阳性神经元表达的影响腹部手术2 h后,上述脑核团内nesfatin-1免疫活性细胞表达无明显改变(P>0.05);但腹部手术可使LC(t=2.6,P<0.05)、rRPa(t= 2.57,P<0.05)、EW(t=10.74,P<0.01)、VLM(t=7.86,P<0.01)和NTS(t=10.46,P<0.01)内c-Fos免疫反应神经元数量显著增加;结果显示,腹部手术分别可激活LC内91%、rRPa内82%、EW和VLM内74%、NTS 14%的表达c-Fos的nesfatin-1神经元,与对照组相比,*P<0.05;**P<0.01。见图2。
A(LC中nesfatin-1和c-Fos免疫阳性神经元表达)、B(EW中nesfatin-1和c-Fos免疫阳性神经元表达)、C(rRPa中nesfatin-1和c-Fos免疫阳性神经元表达)、D(NTS中nesfatin-1和c-Fos免疫阳性神经元表达)、E(VLM中nesfatin-1和c-Fos免疫阳性神经元表达)、LC(蓝斑)、EW(动眼神经副核)、rRPa(中缝苍白核)、NTS(孤束核)、VLM(延髓腹外侧区)。
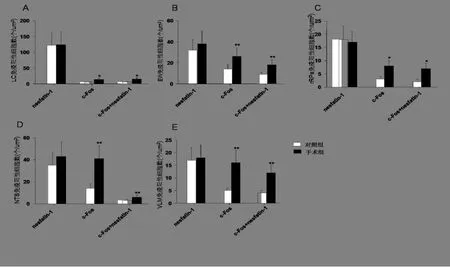
图2 术后肠梗阻对中脑和脑干nesfatin-1和c-Fos免疫阳性神经元表达的影响
3 讨论
有文献报道下丘脑SON和PVN均有nesfatin-1免疫阳性神经元表达。有文献报道,中脑和脑干内也有nesfatin-1的表达,如蓝斑(LC)、动眼神经副核(EW)、中缝苍白核(rRPa)、孤束核(NTS)以及延髓腹外侧区(VLM)均有nesfatin-1的表达[7,8,9]。本研究结果显示,大鼠腹部手术2 h后下丘脑、中脑及脑干诸核团均有不同程度的c-Fos表达增加。腹部手术还可激活绝大多数SON(99%)、LC(91%)、rRPa(82%)、EW和VLM(74%)、apPVN(71%)内的nesfatin-1免疫阳性神经元,NTS(14%)、mmPVN(41%)以及mpPVN(9%)内只有少量nesfatin-1神经元被激活。结果提示,腹部手术可激活脑核团内nesfatin-1免疫阳性神经元的表达。这与文献[7-9]报道的结果基本一致。
结果显示,在mpPVN中激活的c-Fos免疫阳性神经元是apPVN中的5倍,这可能是mpPVN的面积大于apPVN所致。然而,腹部手术可激活apPVN中大部分(71%)的nesfatin-1神经元,而mpPVN中仅激活9%的nesfatin-1神经元。这种差异可能与mpPVN神经元的多样化有关,有文献报道,mpPVN中除有促肾上腺皮质激素释放因子(CRF)和nesfatin-1外,还包含应激条件下可激活的甲状腺激素释放激素、生长激素释放激素[12]。功能学研究表明,在PVN,尤其是在小细胞区包含CRF神经元的部位,对手术2 h后胃排空延迟的发生具有重要作用[2-5]。胃电刺激可改善患者肠梗阻症状[13],与PVN中CRF神经元活性减弱相关[14]。侧脑室注射nesfatin-1,大鼠进食减少,该效应可能是通过CRF信号通路而实现的,即应用选择性CRF2受体拮抗剂astressin2-B,可完全阻断nesfatin-1抑制大鼠的摄食效应[15]。因此,室旁核小细胞区nesfatin-1神经元的激活可能参与术后胃排空的延迟,该效应可能与CRF信号通路有关。
VLM可以投射到LC区域[16],LC与PVN之间也有纤维联系[17]。电生理学研究表明,侧脑室注射CRF或LC注射CRF,LC去甲肾上腺素神经元对疼痛刺激的反应加强。各种应激,如束缚、休克、低血压、腹部手术均会增加LC区去甲肾上腺素表达[4,8,12,18]。结果提示,LC中nesfatin-1神经元的激活可能与腹部手术后胃肠梗阻的发生有关。
总之,腹部手术可激活PVN大细胞区及前侧小细胞区、SON、LC、rRPa、EW、VLM及NTS中大部分nesfatin-1神经元,表明腹部手术诱导的nesfatin-1神经元激活可能对进食和胃排空的减弱有潜在调控作用。
[1]BonnetMS,DjelloulM,Tillement V,et al.Central NUCB2/Nesfatin-1-expressing neurones belong to the hypothalamic-brainstem circuitry activated by hypoglycaemia[J].Neuroendocrinol,2013,25(1):1-13.
[2]StengelA,GoebelM,WangL,etal.Abdominalsurgery activates nesfatin-1immunoreactive brain nuclei in rats[J].Peptides,2010,Feb:31(2): 263-270.
[3]Khler G,Koch OO,Antoniou SA,et al.Relevance of?Surgery?after Embolization of Gastrointestinal and Abdominal Hemorrhage[J]. World JSurg,2014,35(1):268-374.
[4]Bonaz B,Plourde V,TachéY.Abdominal surgery induces Fos immunoreactivity in the ratbrain[J].Comp Neurol,1994,349:212-222.
[5]BonazB,TachéY.Corticotropin-releasing factorand systemic capsaicin-sensitive afferents are involved in abdominal surgery-induced Fosexpression in the paraventricularnucleusof the hypothalamus[J].Brain Res,1997,748:12-20.
[6]Oh-IS,Shimizu H,Satoh T,et al.Identification of nesfatin-1 as a satietymolecule in thehypothalamus[J].Nature,2006,443:709-712.
[7]Brailoiu GC,Dun SL,Brailoiu E,et al.Nesfatin-1:distribution and interactionwith a G protein-coupled receptor in the ratbrain[J].Endocrinology,2007,148:5088-5094.
[8]Foo K,Brismar H,Broberger C.Distribution and neuropeptide coexistence of nucleobindin-2 mRNA/nesfatin-like immunoreactivity in the ratCNS[J].Neuroscience,2008,156:563-579.
[9]GoebelM,Stengel A,Wang L,TachéY,etal.Nesfatin-1 immunoreactivity in rat brain and spinal cord autonomic nuclei[J].Neurosci Lett,2009,452:241-246.
[10]Stengel A,Goebel M,Wang L,et al.Central Nesfatin-1 Reduces Dark Phase Food Intake and Gastric Emptying in Rats:Differential Role of CorticotropinReleasing Factor2 Receptor[J].Endocrinology, 2009,150:4911-9.
[11]Luckey A,Wang L,Jamieson PM,etal.Corticotropinreleasing factor receptor 1-deficientmice do not develop postoperative gastric ileus [J].Gastroenterology,2003,125:654-659.
[12]Viau V,Sawchenko PE.Hypophysiotropic neurons of the paraventricular nucleus respond in spatially,temporally,and phenotypically differentiated manners to acute vs.repeated restraint stress:rapid publication[J].JComp Neurol,2002,445:293-307.
[13]Sobocki J,Thor PJ,Krolczyk G.High frequency electrical stimulation of the stomach ismore effective than low frequency pacing for the treatment of postoperative functional gastric stasis in humans[J]. Neuromodulation,2003,5:254-257.
[14]Gourcerol G,Gallas S,Mounien L,et al.Gastric electrical stimulationmodulates hypothalamic corticotropin-releasing factor-producing neurons during post-operative ileus in rat[J].Neuroscience,2007, 148:775-781.
[15]Stengel A,Goebel M,Wang L,et al.Central Nesfatin-1 Reduces Dark Phase Food Intake and Gastric Emptying in Rats:Differential Role of CorticotropinReleasing Factor2 Receptor[J].Endocrinology, 2009,150:4911-4919.
[16]Cunningham ET Jr.Sawchenko PE.Anatomical specificity ofnoradrenergic inputs to the paraventricular and supraoptic nucleiof the rat hypothalamus[J].Comp Neurol,1988,274:60-76.
[17]Dubois A,Kopin IJ,Pettigrew KD,etal.Chemicaland histochemical studies of postoperative sympathetic activity in the digestive tract in rats[J].Gastroenterology,1974,66:403-407.
[18]Dun NJ,Dun SL,Shen E,etal.c-fosexpression asamarker of central cardiovascular neurons[J].Biol Signals,1995,4:117-123.
The Effect of Abdom inal Su rgery-induced Postoperative Ileus on Nesfatin-1 Exp ression in the Rat Brain
W u Qingjie,Hu Shasha,Pang M ingjie,etc.
(Qingdao University MedicalCollege,Qingdao 266021,Shandong;*Qingdao MunicipalHospital,Qingdao 266011,Shandong)
Ob jectiveTo investigate the effectof abdominal surgery-induced postoperative ileus on nesfatin-1-immunoreac⁃tive(ir)neuronsexpression in the ratbrain and the clinical significance.M ethodsRatswere anesthesiaed w ith Sulfuric acid butabar⁃bitaland abdom inal surgery was performed.Two hours after abdom inal surgery,ratswere transcardially perfused and brains processed for double immunohistochemical labeling of Fos and nesfatin-1.Resu ltsAbdominal surgery,induced an obvious increase of c-Fos expression in neurons of the supraoptic nucleus(SON)(P<0.01),paraventricular nucleus(PVN)(P<0.01),locus coeruleus(LC)(P<0.05),Edinger-Westphal nucleus(EW)(P<0.01),rostral raphe pallidus(rRPa)(P<0.05),nucleus of the solitary tract(NTS)(P<0.01) and ventrolateralmedulla(VLM)(P<0.01),but the expression of nesfatin-1-immunoreactive cells did notdiffer(P>0.05).The statisti⁃calanalysisshowed thatamong the actived c-Fosneurons,99%in the SON,71%in the anterior parvicellular PVN,47%in the lateral magnocellular PVN,41%in themedialmagnocellular PVN and 9%in themedial parvicellular PVN could expression nesfatin-1;in the hindbrain,abdom inal surgery activated nesfatin-1 neurons91%in the LC,82%in the rRPa,74%in the EW and VLM,14%in the NTS could expression c-Fos.ConclusionAbdom inal surgery can activate the nesfatin-1-ir neurons in the hypothalam ic and hind⁃brain food related nucles,and suggesta possible implication in the controlof food intake and gastric emptying disorder.
Abdominalsurgery;Fos;Hypothalamus;NUCB2;Postoperative ileus;Ratbrain
R574.2;R393
A
1008-4118(2014)02-0006-04
2014-03-26
10.3969/j.issn.1008-4118.2014.02.02
武庆杰,(1983-)男,现在菏泽医学专科学校工作。
徐珞,E-mail:xu.luo@163.com
国家自然科学基金(No.81100260,No.81270460 and No.81300281);青岛市科技局项目(13-1-4-170-jch)

