大黄素治疗裸鼠胰腺癌肝转移瘤的实验研究
徐贤绸温培楠王兆洪刘 岸杨伟青
1浙江省平阳县人民医院普外科 平阳 325400 2温州医科大学附属第二医院肿瘤外科
大黄素治疗裸鼠胰腺癌肝转移瘤的实验研究
徐贤绸1温培楠1王兆洪2刘 岸2杨伟青1
1浙江省平阳县人民医院普外科 平阳 325400 2温州医科大学附属第二医院肿瘤外科
目的观察大黄素及其脂质体对裸鼠胰腺癌肝转移模型影响及作用机制。方法建立裸鼠胰腺癌肝转移模型,随机分为对照组、吉西他滨组、实验Ⅰ组、实验Ⅱ组和实验Ⅲ组,每组10只,分别经脾脏注射给予10%葡萄糖、吉西他滨100mg/kg、大黄素10mg/kg、大黄素脂质体5mg/kg和大黄素脂质体10mg/kg。观察各组荷瘤裸鼠肝转移瘤生长情况,免疫组织化学法检测肿瘤组织Ki-67和CD-34表达,Tunel法检测肿瘤组织细胞凋亡,Western blotting法检测肿瘤组织MMP-2和MMP-9表达水平。结果与对照组比较,吉西他滨组、实验Ⅰ、Ⅱ、Ⅲ组肝转移瘤生长明显抑制(P均<0.05);与实验Ⅰ、Ⅱ组比较,实验Ⅲ组肿瘤缩小更明显(P<0.05);实验Ⅲ组瘤重与吉西他滨组比较,差异无统计学意义(P>0.05);实验Ⅰ、Ⅱ、Ⅲ组肿瘤组织Ki-67、CD34、MMP-2和MMP-9表达较对照组均明显降低(P均<0.05),而凋亡细胞明显增加(P均<0.05)。结论大黄素及其脂质体均有抗裸鼠胰腺癌肝转移瘤的作用,但后者作用更为明显,其机制可能与抑制胰腺癌组织MMP-2和MMP-9表达有关。
小鼠;胰腺肿瘤;肿瘤转移;大黄素;脂质体
胰腺癌为消化道恶性肿瘤,多数患者确诊时因已合并肝等部位转移而失去手术机会,吉西他滨作为治疗胰腺癌的首选化疗药物,其治疗有效率也不高,同时存在一定毒副反应[1-2]。因此,有必要寻求一种低毒高效的药物以控制胰腺癌及肝转移瘤的生长,改善进展期胰腺癌患者预后。笔者采用薄膜-超声分散法制备大黄素脂质体,以吉西他滨作为阳性对照,观察大黄素及其脂质体治疗裸鼠胰腺癌肝转移瘤的效果,并初步探讨其机制,现报道如下。
1 材料与方法
1.1动物和细胞株 4~6周龄雌性BALB/c-nu/nu品系裸小鼠,无特定病原体(SPF)级,体质量(18.56± 0.85)g,购自中科院上海动物实验中心,动物质量合格证号:SCXK(沪)2007-0005,饲养于温州医学院动物实验中心SPF屏障系统内,动物饲料和水等经严格灭菌处理。人胰腺癌细胞株SW1990购自ATCC,细胞生长于含10%胎牛血清的RPMI-1640培养基中,含1%的青-链霉素,在5%CO2和37℃培养箱内孵育,胰蛋白酶消化传代,取对数生长期细胞为实验对象。
1.2药物和试剂 大黄素购自美国Sigma公司,采用薄膜-超声分散法[3]制备大黄素脂质体,大黄素纳米脂质体为浅黄色透明胶体,在电镜下呈完整圆球形或椭圆形的球粒,粒径约为25nm,含量为(2.1± 0.2)mg/mL,包封率为(98.26±0.38)%;胎牛血清、含EDTA胰酶和RPMI-1640培养基购自美国Gibco公司;Ki-67和CD34抗体购自武汉博士德生物工程有限公司;ABC免疫组化检测试剂盒购自美国Gibco公司;TUNEL试剂盒购自瑞士罗氏公司;MMP-2、MMP-9和β-actin抗体购自美国Epitomics公司;BCA蛋白浓度测定试剂盒购自美国Sigma公司。
1.3模型建立和给药 裸鼠胰腺癌皮下移植瘤制备:取2×106个指数生长期的SW1990细胞注射至裸鼠左下肢外侧皮下组织,3周后待皮下移植瘤生长成1cm3后取出,将肿瘤组织剪成1mm3的组织块备用。裸鼠胰腺癌肝转移模型制备:取1mm3的瘤块,置于16#带针芯穿刺针内,2%戊巴比妥钠腹腔注射麻醉裸鼠,行上腹正中切口约1cm,暴露肝左叶,刺入穿刺针,将瘤块种植于裸鼠肝左叶,缝合裸鼠腹壁。共制备50只裸鼠胰腺癌肝转移模型,并随机分成5组,每组10只。对照组每只给予10%葡萄糖0.1mL;吉西他滨组给予吉西他滨100mg/kg;实验Ⅰ组给予大黄素10mg/kg;实验Ⅱ组给予大黄素脂质体5mg/ kg;实验Ⅲ组给予大黄素脂质体10mg/kg。手术后第4天开始通过皮试针头经脾下极注射给药,术后第3周处死裸鼠,完整剥取肝脏肿瘤组织,称重并计算抑瘤率。抑瘤率=(1-治疗组平均瘤重/对照组平均瘤重)×100%
1.4肿瘤组织Ki-67和CD34测定 采用免疫组织化学法检测。按照Envision法的操作步骤进行免疫组化实验,每组选取5个标本经正常羊血清封闭非特异性抗原,加入一抗孵育过夜后,加入生物素标记的二抗,DAB显色,苏木精复染,脱水后封片。低倍镜(×100)下随机选择20个视野,图片结果用Image-Pro Plus 6.0图像处理软件分析Ki-67和CD34的阳性表达强度。
1.5肿瘤组织细胞凋亡 采用Tunel法检测。按Tunel试剂盒说明书操作,细胞核固缩、染色体凝集成块、呈棕褐色染色者为凋亡细胞,低倍镜(100×)下观察20个视野,图片结果用Image-Pro Plus 6.0图像处理软件进行分析。
1.6肿瘤组织蛋白表达的检测 采用Western blot法检测。将肿瘤组织粉碎后加入RIPA裂解液裂解细胞,提取上清液。用Bradford法测量蛋白浓度后取等量蛋白质样品(20μg/孔),常规8%SDS-PAGE电泳,半干转膜仪转膜,5%脱脂奶粉封闭,加入一抗(1: 1000)于4℃下孵育过夜,HRP标记的羊抗兔IgG为第二抗体(1:2500)室温孵育1h,ECL显色,条带暴光强度用Quantity One 4.6.2(BIO,RAD)软件分析,以β-actin为内参,通过与内参的灰度比,得出目的条带的相对表达水平。
1.7统计学方法 实验所得计量数据以均数±标准差() 表示,应用SPSS11.0软件进行统计分析,采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1大黄素对裸鼠胰腺癌肝转移瘤生长的影响 各组裸鼠死亡情况:实验中对照组、实验Ⅱ组和实验Ⅲ组裸鼠进食良好,无死亡;吉西他滨组裸鼠出现恶病质2只,死亡1只;实验Ⅰ组裸鼠出现稀便3只,死亡1只。各组裸鼠移植瘤重量及抑瘤率:实验结束后处死模型裸鼠后分离肝脏肿瘤并称重,各组裸鼠肝脏移植瘤重见表1。与对照组比较,吉西他滨组、实验Ⅰ、Ⅱ、Ⅲ组瘤重均明显减轻(P<0.05),抑瘤率分别为79.2%、50.6%、59.3%和77.9%;实验Ⅲ组分别与实验Ⅰ、Ⅱ组比较,差异有统计学意义(P均<0.05);吉西他滨组与实验Ⅲ组比较,差异无统计学意义(P>0.05)。各组肿瘤组织病理学检测结果:各组裸鼠肝脏肿瘤组织经HE染色后镜下观察均证实为胰腺癌,其中吉西他滨组和实验Ⅰ组肿瘤组织中可见组织细胞片状坏死,见图1(封四)。
表1 各组裸鼠瘤重、抑瘤率比较()

表1 各组裸鼠瘤重、抑瘤率比较()
注:与对照组比较,*P<0.05;与实验Ⅰ、Ⅱ组比较,△P<0.05
?
2.2大黄素脂质体对裸鼠胰腺癌肝转移瘤组织Ki-67和CD34表达的影响 Ki-67染色阳性细胞表现为胞浆不着色,胞核染成棕褐色,核固缩,染色质浓聚,而CD34阳性细胞表现为胞膜为棕褐色。免疫组化结果显示,实验Ⅰ、Ⅱ、Ⅲ组裸鼠肿瘤组织Ki-67和CD34阳性表达强度均明显低于对照组(P<0.05);吉西他滨组Ki-67阳性表达较对照组下降(P<0.05),而CD34阳性表达与对照组比较差异无统计学意义(P>0.05);与实验Ⅰ组比较,实验Ⅲ组Ki-67和CD34阳性表达强度明显降低(P<0.05),见表2,图2(封四)。
表2 各组裸鼠肿瘤组织细胞Ki-67、CD34和TunelIOD值比较()

表2 各组裸鼠肿瘤组织细胞Ki-67、CD34和TunelIOD值比较()
注:与对照组比较,*P<0.05;与实验Ⅲ组比较,▲P<0.05
?
2.3大黄素脂质体对裸鼠胰腺癌肝转移瘤细胞凋亡的影响 Tunel染色阳性细胞表现为仅为胞核染成棕褐色。实验各组肿瘤组织切片中均可见凋亡细胞,吉西他滨组、实验Ⅰ、Ⅱ、Ⅲ组裸鼠肿瘤组织Tunel阳性细胞的IOD值较对照组均明显升高(P均<0.05);实验Ⅲ组Tunel阳性细胞的IOD值显著高于实验Ⅰ组(P<0.05)。见表2,图3(封四)。
表3 各组裸鼠肿瘤组织细胞MMP-2和MMP-9 IOD值比较()
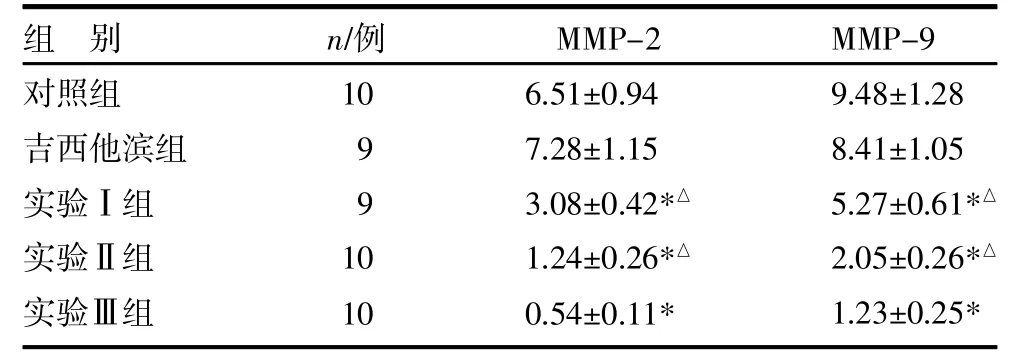
表3 各组裸鼠肿瘤组织细胞MMP-2和MMP-9 IOD值比较()
注:与对照组比较,*P<0.05;与实验Ⅲ组比较,△P<0.05
?
2.4大黄素脂质体对裸鼠胰腺癌肝转移瘤细胞MMP-2、MMP-9表达的影响 Western印迹检测结果表明,MMP-2、MMP-9和β-actin阳性特异性条带分别为72kDa、79kDa和43kDa;大黄素或大黄素脂质体作用裸鼠胰腺癌肝转移瘤模型后,均可抑制MMP-2和MMP-9在肿瘤组织细胞中的表达(P<0.05),但吉西他滨组MMP-2和MMP-9表达强度与对照组比较差异无统计学意义(P>0.05);与实验Ⅰ、Ⅱ组比较,实验Ⅲ组MMP-2和MMP-9蛋白表达强度明显降低,差异有统计学意义(P<0.05)。见表3,图4(封四)。
3 讨 论
大黄素是一种蒽醌类化合物,是大黄等中药的有效成分,对包括胰腺癌在内的多种恶性肿瘤生长有抑制作用,且对机体毒副作用少[4-6]。而脂质体作为一种药物载体,因可避免药物被内皮细胞摄取而直接送入病灶并缓慢发挥作用,故可使所载药物生物利用率增高、不良反应减轻[7-8],实验研究和临床应用均显示较好的应用前景。大黄素因具有强亲脂性,制作成脂质体的大黄素水溶性大大增加,可具良好的生理相容性[3]。因此,我们的研究力求证实大黄素对裸鼠胰腺癌肝转移瘤的治疗作用以及脂质体作为大黄素载体的“减毒增效”作用,并初步探讨其可能的机制。
本研究结果表明,吉西他滨(100mg/kg)可明显抑制裸鼠胰腺癌肝转移瘤生长,而10mg/kg脂质体大黄素也有较明显的抑瘤作用,二者效果相当,证实脂质体大黄素抑制胰腺癌肝转移瘤生长的疗效。实验结果还表明,普通大黄素也可抑制胰腺癌肝转移瘤生长,但剂量为10mg/kg的大黄素的抑瘤率为50.6%,低于剂量为10mg/kg脂质体大黄素的抑瘤效果,也低于剂量为5mg/kg脂质体大黄素的抗肿瘤效应,表明将大黄素制作成脂质体给药可增强其抗癌效应。对肿瘤组织进行免疫组化分析可知,脂质体大黄素可明显降低Ki-67在肿瘤组织中的阳性表达,表明脂质体大黄素能有效聚集于转移瘤上,增加局部药物浓度从而增强大黄素的抑瘤效应。因此,本研究证实了大黄素对胰腺癌肝转移瘤的作用,也证实了脂质体作为载体提高大黄素的抑瘤效果。
既往研究表明,大黄素抑制肿瘤细胞生长方式以诱导细胞凋亡为主,而非通过明显的细胞毒性作用[9]。本研究过程中也可观察到细胞毒性药物吉西他滨作用裸鼠后出现稀便和食欲不振等明显毒副作用,普通大黄素组裸鼠也有类似反应,但较轻。而大黄素脂质体作用实验动物后无一例出现明显毒副作用,同时镜下观察大黄素脂质体作用后肿瘤组织未见明显组织坏死表现,表明脂质体作为载体可降低所载药物(本实验为大黄素)的毒性,与文献报道相符[7-8]。
肿瘤转移的机制比较公认的是三步骤学说[6],即①分离:肿瘤细胞黏附能力下降,脱离原发病灶;②降解:癌细胞和局部宿主细胞分泌水解酶,水解细胞外基质(ECM)和基底膜中的蛋白成分;③移动:癌细胞通过水解后形成的组织间隙向周围浸润或进入淋巴管、血管,向远处转移。三个步骤涉及癌细胞与癌细胞,癌细胞与ECM,癌细胞与宿主细胞间的复杂的相互作用。癌细胞可产生和诱导间质细胞产生多种蛋白酶降解ECM,促进浸润转移,基质金属蛋白酶(matrix metalloproteinases,MMPs)是其中最为重要的一组。MMP-2和MMP-9在过度表达情况下能够破坏基底膜和降解细胞外基质中胶原和非胶原成分,使得肿瘤突破原发部位正常基底膜并向深层浸润,且突破血管和淋巴管,造成肿瘤血行和淋巴转移。同时MMP-9还可调控血管内皮生长因子(VEGF)[10],促进肿瘤血管生成。
因此,抑制MMP-2和MMP-9能有效抑制恶性肿瘤浸润、转移和血管生长。在本实验中,吉西他滨对肿瘤血管生长以及对MMP-2和MMP-9表达无明显影响(P>0.05),而大黄素脂质体不仅可有效抑制肝转移瘤组织CD-34的表达,还可抑制MMP-2和MMP-9在体内肿瘤中表达(P<0.05),且较相同浓度大黄素明显,表明大黄素脂质体可能通过抑制MMP-2和MMP-9在胰腺癌组织表达,而有效抑制胰腺癌肝转移瘤生长。
综上所述,大黄素脂质体因具脂质体药物的生物利用率高和不良反应轻的优势,在对裸鼠胰腺癌肝转移瘤模型进行治疗中取得比普通大黄素更好、与吉西他滨相当的疗效,但毒副作用较后两者明显减少,其抗肿瘤作用机制可能与抑制肿瘤细胞中MMP-2和MMP-9表达有关。
[1]Gooden HM,White KJ.Pancreatic cancer and supportive care-pancreatic exocrine insufficiency negatively impacts on quality of life[J].Supportive Care in Cancer,2013,21(7):1835-1841.
[2]Sohal DP,Metz JM,Sun W,et al.Toxicity study of gemcitabine,oxaliplatin,and bevacizumab,followed by 5-fluorouracil,oxaliplatin,bevacizumab,and radiotherapy,in patients with locally advanced pancreatic cancer[J].Cancer Chemotherapy and Pharmacology,2013,71(6):1485-1491.
[3]顾宜,石玉,张三奇,等.大黄素纳米脂质体的制备和质量评价[J].第四军医大学学报,2003,24(5):479-479.
[4]Li J,Liu P,Mao H,et al.Emodin sensitizes paclitaxel-resistant human ovarian cancer cells to paclitaxel-induced apoptosis in vitro[J].Oncol Rep,2009,21(6):1605-1610.
[5]Cai J,Razzak A,Hering J,et al.Feasibility evaluation of emodin(rhubarb extract)as an inhibitor of pancreatic cancer cell proliferation in vitro[J].JPEN J Parenter Enteral Nutr,2008,32(2):190-196.
[6] Ko JC,Su YJ,Lin ST,et al.Suppression of ERCC1 and Rad51 expression through ERK1/2 inactivation is essential in emodin-mediated cytotoxicity in human non-small cell lung cancer cells[J].Biochem Pharmacol,2010,79(4):655-664.
[7]解亦斌,王铮,韩志凯,等.裸鼠胰腺癌肝转移模型脂质体阿霉素介入化疗实验研究[J].中华医学杂志,2010,90(30):2126-2129.
[8]凌家俊,古锦辉,谢毅,等.羟基喜树碱磁性脂质体的制备及其靶向性特征试验[J].中国实验方剂学杂志,2012,18(16):19-23.
[9]Huang Q,Lu G,Shen HM,et al.Anti-cancer properties of anthraquinones from rhubarb[J].Med Res Rev,2007,27(5):609-630.
[10]Shan B,Li W,Yang SY,et al.Estrogen up-regulates MMP2/ 9 expression in endometrial epithelial cell via VEGFERK1/2 pathway[J].Asian Pac J Trop Med,2013,7645(13):60146-60147.
Inhibitory Effect of Emodin on Hepatic Metastasis of Human Pancreatic Carcinoma in Nude Mice
XU Xianchou1,WEN Peinan1,WANG Zhaohong2,LIU An,YANG Weiqing.1 Department of General Surgery,the People's Hospital of Pinguang,Pingyang(325400),China;2 Department of Surgery,the Second Affiliated Hospital of Wenzhou Medical University
ObjectiveTo investigate the anti-tumor effect of free emodin and liposome emodin on hepatic metastasis of human pancreatic carcinoma in nude mice.MethodsAfter the model of hepatic metastasis of human pancreatic carcinoma was established in mice,the mice were randomized into 5 groups(n=10),receiving 10%glucose, gemcitabine(100 mg/kg),free emodin(10 mg/kg),and liposomal emodin(5 and 10 mg/kg)via spleen injection in each group.The hepatic metastatic foci of pancreatic tumor weight and inhibition rate were evaluated after the mice were sacrificed.Immunohistochemistry(IHC)was used to detect the positive expression of Ki-67 and CD34 in tumors.The Tunel test kit was used to explore cellular apoptosis in tumor tissue.Expression of MMP-2 and MMP-9 were detected by Western blotting.ResultsAdministration of gemcitabine,liposomal emodin and free emodin significantly decreased tumor weight as compared to untreated controls(P<0.05);administration of liposomal emodin resulted in a substantial delay of tumor growth as compared to free emodin at the same dose(P<0.05),but did not result in a significant difference as compared to gemcitabine group(P>0.05).The positive expression of Ki-67 and CD34 in the tumors of liposomal emodin groups were significantly lower than those in control group(P<0.05).Apoptosis occurred more frequently in liposomal emodin group than in control group(P<0.05).ConclusionEmodin has the anti-tumor effect on hepatic metastasis of pancreatic tumor and the effect is more obvious in liposomal emodin than in free emodin.The underlying mechanism may partially be through down-regulation of MMP-2 and MMP-9.
mice;pancreatic neoplasm;neoplasm metastasis;emodin;liposomes
2013-10-10
浙江省温州市科技计划项目(No.Y20110012)
徐贤绸,E-mail:xxc@pyhosp.com

