头孢曲松钠与胃蛋白酶相互作用的光谱研究
肖 敏,邵从英,葛宝宝,訾言勤
(淮北师范大学 化学与材料科学学院,安徽 淮北 235000)
头孢曲松钠(Ceftriaxone sodium)(CSI,见图1)为第三代头孢菌素类抗菌药物,与第一、二代相比,其抗菌谱更广,抗菌活性更强,特别对革兰氏阴性杆菌的抗菌谱广、抗菌作用强[1].胃蛋白酶(Pepsin)是生物上第一个被发现的动物酶,是由胃部的胃粘膜主细胞所分泌消化酶,能有效地将食物中的蛋白质分解为小的肽片段.因胃蛋白酶在医学上对人体有巨大作用,所以在医疗和医药方面人们投入更多的研究[2-3].
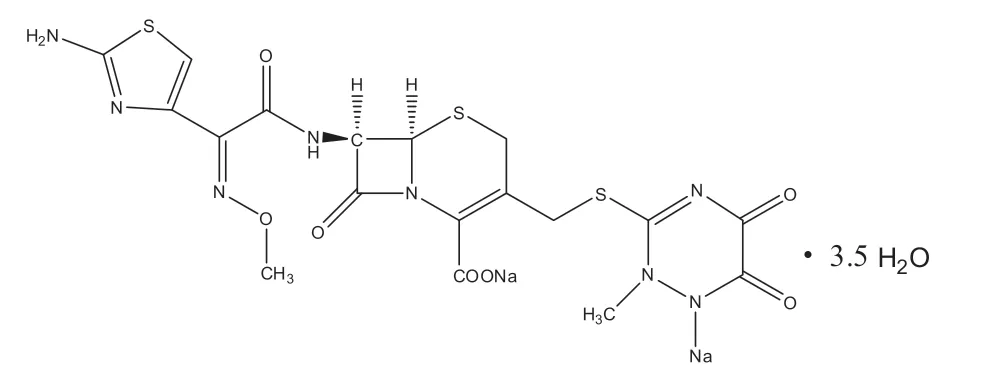
图1 头孢曲松钠的分子式Fig.1 The structure of ceftriaxone sodium
本实验探讨头孢曲松钠与胃蛋白酶的主要作用力类型和热力学函数的变化,同时计算反应结合常数k与结合位点数n,利用同步荧光法对蛋白质构象影响进行考察,旨在为医学和药学等方面提供有用信息.
1 实验部分
1.1 仪器与试剂
FP-8300 型(日本岛津)荧光分光光度计;FA-2004 型(上海良平)电子天平;TU-1901 型(北京普析)双光束紫外可见分光光度计;pHS-3D型(上海虹益)精密pH计;HH-4型(国华电器)数显恒温水浴锅;注射用头孢曲松钠(汕头金石粉针剂有限公司,分子量628.6):配制100 mL的1.0×10-4mol·L-1备用液;胃蛋白酶(南京海辰药业有限公司,分子量35 000):配制250 mL的2.1×10-4mol·L-1;配制pH 1.81 B-R缓冲溶液;所用试剂均为分析纯或优级纯,冰箱1~4 ℃保存;实验用水为去离子水.
1.2 实验方法
向10 mL试管中依次加入pH 1.81的B-R缓冲溶液1.00 mL,胃蛋白酶溶液1.00 mL,以及系列浓度的头孢曲松钠溶液,定容混合均匀后,静置20 min,进行测定.在荧光光度计上(激发波长277 nm,夹缝宽度均为5 nm),记录在不同温度下290~500 nm 范围内荧光发射光谱.并且在298 K 时,记录Δλ=15 nm 与Δλ=60 nm的同步荧光光谱.
2 结果与讨论
2.1 荧光猝灭机制探讨
固定胃蛋白酶的浓度,加入系列浓度的头孢曲松钠,胃蛋白酶的荧光强度有规律地下降(如图2),表明头孢曲松钠对胃蛋白酶有猝灭效果,两者发生相互作用.荧光猝灭的机制主要有静态猝灭和动态猝灭两种,且均满足Stem-Volmer方程[4]:


图2 头孢曲松钠和胃蛋白酶体系的荧光猝灭光谱Fig.2 The fluorescence emission spectra of pepsin in presence of CSI,T=298 K,pH=1.81
在温度分别298 K,303 K及308 K的条件下,以F0/F对[Q]作图得图3:

图3 头孢曲松钠和胃蛋白酶体系的Stern-Volmer方程曲线
由图3b知,在3个不同温度下,胃蛋白酶与头孢曲松钠作用均是向上弯曲的曲线;而图3a可以看出,从0到1.75×10−4mol·L−1低浓度区间,两者作用得到良好的直线线性关系,由Sterm-volmer方程求得该体系的动态猝灭常数,数据列于表1中.

表1 胃蛋白酶与头孢曲松钠作用的扩散碰撞的动态猝灭常数Table1 Stern–Volmer quenching constants for pepsin-CSI system at different temperatures,pH1.81
由表1可看出,不同温度下的Kq值均大于最大动态扩散碰撞速率常数2.0×1010L·mol-1·s-1;然而随着温度的升高,Stern-Volmer猝灭常数Ksv增大,头孢曲松钠与胃蛋白酶作用机制表现为动态猝灭.因此,推断头孢曲松钠和胃蛋白酶的荧光猝灭过程可能是一个动态猝灭为主的过程[5].
2.2 结合常数和结合位点
在猝灭过程中,胃蛋白酶与头孢曲松钠的结合常数可由荧光体和猝灭剂的结合常数表达式导出[6]:

以lg[(F0-F)/F]对lg[CSI]作图,得到图4:

图4 头孢曲松钠与胃蛋白酶结合双对数图Fig.4 Double-lg plot at different temperature
由(2)式可求得结合常数K和结合位点数n,见表2.

表2 头孢曲松钠与胃蛋白酶在不同温度下的热力学常数、结合位点数nTable 2 Thermodynamic parameters,numbers of binding sites n for pepsin-CSI system at different temperatures
由表2可见,头孢曲松钠和胃蛋白酶之间存在强烈的相互作用,且随着温度的升高,结合常数不断增大,也进一步判断其猝灭机制为动态猝灭,同时可以看出头孢曲松钠和胃蛋白酶之间只有1个结合位点.
2.3 热力学函数及结合作用力
在298 K、303 K和308 K 3个温度下,依据热力学参数方程式(3)-(5)即可计算出头孢曲松钠和胃蛋白酶结合的ΔH、ΔG、ΔS等热力学函数值如表2.

根据热力学参数可以简单地判断其相互作用力的类型[7],表2中ΔG<0表明在头孢曲松钠和胃蛋白酶的结合过程是一个自发的过程,ΔH>0,且ΔS>0,表明二者结合是一个吸热的熵增的过程,由此可以推测该体系中头孢曲松钠和胃蛋白之间的作用力主要是疏水作用力.
2.4 体系的能量转移及结合距离的计算
根据Förster非辐射能量转移理论[8],供体和受体之间的结合距离R及临界能量转移距离R0之间的关系为[9-10]:


图5 头孢曲松钠紫外吸收光谱Fig.5 The overlap of the UV absorption spectrum of CSI
图5为头孢曲松钠的紫外吸收光谱与胃蛋白酶的荧光光谱图.通过(6)-(8)式,对图5中的光谱重叠部分的面积进行积分求和,可得光谱的重叠积分为J=4.188 6×10-16cm3·L·mol-1,得到它们的距离r=0.92 nm,小于8 nm[11].表明在头孢曲松钠和胃蛋白酶作用时,二者发生非辐射能量转移.
2.5 同步荧光的构象变化
图6为头孢曲松钠和胃蛋白酶体系的同步荧光光谱.从图6中可以看出,酪氨酸残基(Δλ=15 nm)(图6a)和色氨酸残基(Δλ=60 nm)(图6b),随着头孢曲松钠浓度的增加,最大发射波长均缓慢地红移,荧光强度均逐渐减弱.表明,头孢曲松钠与胃蛋白酶发生作用时,影响色氨酸残基和酪氨酸残基的微环境,使色氨酸、酪氨酸残基周围的极性增加,疏水性减小,构象发生改变.

图6 头孢曲松钠与胃蛋白酶体系的同步荧光光谱Fig.6 Synchronous fluorescence spectra of pepsin with CSI
3 结论
胃蛋白酶和头孢曲松钠结合使胃蛋白酶内源荧光发生有规律的猝灭,猝灭机理为动态猝灭,作用过程中两者发生非辐射能量转移,形成复合物,结合常数较大.头孢曲松钠和胃蛋白酶之间主要由疏水作用力相结合,且只有1个结合位点数.本文取得的结果对药学和临床医药的生物学具有较大意义.
[1]张爱梅,闫炜,王怀生.CdTe/CdS 量子点-蛋白质与头孢曲松钠的相互作用[J].分析化学,2008,36(4):444-448.
[2]KYEONG S J,YECHEOL R,JEHAN K,et al.Synchrotron small-angleX-ray scattering studies of the structure of porcine pepsin under various pH conditions[J].J Phys Chem B,2008,112(49):15821-15827.
[3]YU Y K,HU J N,BAI X F,et al.Preparation and function of oligopeptide-enriched hydrolysate from globin by pepsin[J].Process Biochemistry,2006,41(7):1589-1593.
[4]MOTE U S,BHATTAR S L,PATIL S R,et al.Interaction between felodipine and bovine serum albumin:fluorescence quenching study[J].Luminescence,2010,25(1):1-8.
[5]LI D,ZHU J,JIN J.Spectrophotometric studies on the interaction between nevadensin and lysozyme[J].Journal of Photo⁃chemistry and Photobiology A:Chemistry,2007,189(1):114-120.
[6]FENG X Z,LIN Z,YANG L J,et al.Investigation of the interaction between acridine orange and bovine serum albumin[J].Talanta,1998,47(5):1223-1229.
[7]GEORGE N,HAROLD A S.The structure of water and hydrophobic bonding in proteins.Ⅲ.The thermodynamic properties of hydrophobic bonds in proteins[J].J Phys Chem,1962,66(10):1773-1789.
[8]FÖRSTER T.Modern quantum chemistry[M].New York:Academic Press,1965.
[9]SAHA D C,RAY K,MISRA T N.Energy transfer in triton-X 100 micelles:a fluorescence study[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2000,56(4):797-801.
[10]CRISTOBAL G,DOS R,PIERRE D J M.Fluorescence resonance energy transfer spectroscopy is a reliable “Ruler” for measuring structural changes in proteins:dispelling the problem of the unknown orientation factor[J].Struct Biol,1995,115(2):175-185.
[11]VALEUR B,BROCHON J C.New trends in fluorescence spectroscopy[M].Belin:Springer Press,1999.

