抗氧化乌拉尔甘草内生菌株的筛选及鉴定
, , , ,
(1.浙江工业大学 药学院,浙江 杭州 310032;2.浙江大学 生物系统工程与食品科学学院,浙江 杭州 310058)
乌拉尔甘草(Glycyrrhizauralensis)为豆科多年生草本植物,主要分布在干旱、半干旱地区,主产区在内蒙古、宁夏及甘肃,是一种重要的药用植物资源,有“十方九草”之称[1-2].主要含有甘草酸、甘草次酸、黄酮、生物碱、氨基酸等成分,具有抗炎、抗病毒、抗肿瘤、抗菌等多种生理活性[3-4].
近年来,植物内生菌特别是药用植物内生菌,作为一种新的资源引起了人们的广泛关注,已从中分离出了多种具有抗菌、抗肿瘤、杀虫、免疫抑制和抗氧化等作用的生物活性物质,其中很多是具有特殊生物活性的新结构物质[5].王鸿等[6]从鱼腥草内生菌挥发性成分中分离到宿主活性成分的结构类似物,表明内生菌能产生与宿主具类似生理活性的物质.当前对乌拉尔甘草内生真菌的研究报道较少,主要对甘草中具有抗菌活性的菌株进行了筛选,而内生菌的抗氧化活性筛选则未见报道.本研究旨在分离鉴定内蒙古地区乌拉尔甘草根、茎、叶中的内生真菌,检测其发酵产物的抗氧化活性,为探明内蒙古乌拉尔甘草的道地性以及更好地开发利用甘草及内生菌提供参考.
1 材料与方法
1.1 材 料
乌拉尔甘草植株采自内蒙古呼和浩特.
1.2 培养基
马铃薯葡萄糖培养基(PDA培养基):固体培养基用于内生真菌的分离纯化,液体用于发酵.称取马铃薯约200 g,洗净后去皮切成小块,煮沸30 min,纱布过滤后再加15 g葡萄糖和18 g琼脂,溶化后补足水分至l 000 mL,pH自然,分装至锥形瓶后12l ℃灭菌20 min.
1.3 内生真菌的分离与纯化
分别取新鲜甘草的根、茎、叶,分别用自来水冲洗干净,滤纸吸干水分.按下列程序进行表面消毒处理:先用体积分数75%酒精浸泡1 min,无菌水冲洗3遍,再用0.1%的升汞处理30 s,无菌水冲洗4次.其次在无菌条件下,用无菌的手术剪将植物根、 茎、 叶剪成小段,根和茎沿剖面剪成1~2 mm厚的片段,叶片切成3 mm×3 mm 的方块,置于培养基平板上,在28 ℃下培养3 d.观察外植体周围有无菌落形成,挑取内生菌株菌丝到PDA培养基中,置于28 ℃下继续培养3~5 d.反复转接至纯培养后,将菌株接种到斜面培养基上,保存至4 ℃冰箱中备用.
空白对照:将上述经过表面消毒后未切割的样品置入空白平板中,28 ℃下培养, 若材料周围未长出杂菌,则说明所分离的菌株为内生菌株.
1.4 内生菌株的形态学鉴定
观察内生菌菌落形态特征.挑取分离得到的纯培养物,用乳酸石炭酸棉蓝染色,常规镜检,观察内生菌株的显微形态.参照《真菌鉴定手册》,对分离的内生菌株进行分类、鉴定[7-10].
1.5 抗氧化活性筛选
1.5.1 内生菌株发酵液清除DPPH自由基能力的测定
从PDA培养基上取活化的真菌适量,分别接种到100 mL锥形瓶内50 mL液体培养基中,于28 ℃摇床中120 r/min 振荡培养7 d.发酵液经纱布过滤后,用乙酸乙酯等体积萃取3次,浓缩至干,4 ℃保存.分别精密称取干燥恒重的各乙酸乙酯提取物5 mg,甲醇溶解并稀释至50 mL,即100 μg/mL备用.
1) 准确称取1.971 5 mg DPPH,用甲醇溶解,定容至25 mL容量瓶.
2) 分别移取各样液0.5 mL于10 mL具塞试管中,加入0.5 mL DPPH-甲醇溶液,充分混匀,室温静置30 min后,测定A517(Ai)(以甲醇作参比).
3) 0.5 mL DPPH-甲醇溶液与0.5 mL甲醇溶液混合后测定A517(Ac).
4) 0.5 mL样液与0.5 mL甲醇溶液混合后测定A517(Aj).
抗氧化能力用抑制率来表示[11],即
1.5.2 总抗氧化能力的测定(FRAP值测定)
取各真菌发酵液,适当稀释后移液器取100 μL,加入FRAP工作液3 mL,混匀反应20 min,于593 nm处读取吸光度.以FeSO4为标准物绘制标准曲钱,求得回归方程.样品的抗氧化能力以FRAP值表示:1FRAP单位=1 μmol FeSO4,即样品的抗氧化能力相当于FeSO4的μmol/L数[12].
1.6 活性菌株的分子生物学鉴定
1.6.1 基因组提取
采用SK1375真菌基因组抽提试剂盒提取菌株基因组.
参照酵母26S rDNA D1/D2区引物NL1:5’-GCA TAT CAA TAA GCG GAG GAA AAG-3’和NL2:5’- GGT CCG TGT TTC AAG ACG G-3’[13]引物对,由上海生工公司合成.25 μL扩增体系包括:Template(基因组)10 pmol,Primer up (10 μM) 0.5 μL,Primer down (10 μM) 0.5 μL,dNTP mix (10 Mm each) 0.5 μL,10×Taq reaction Buffer 2.5 μL,Taq (5 U/μL) 0.2 μL,加水至25 μL.PCR反应扩增仪进行扩增,扩增程序为:预变性94 ℃ 5 min;循环94 ℃ 30 s,55 ℃ 35 s,72 ℃ 60 s,35个循环,循环结束后72 ℃下延伸8 min.扩增完成后,将产物送往上海生工生物公司测序.
1.6.2 序列比较及发育树构建
以Colletotrichum属26S rDNA D1/D2序列为参照,对PCR产物测序结果在Genbank数据库内进行同源序列搜索(blast search),找出该菌株与数据库中同源性最高的模式菌株,用MEGA 5.1进行系统发育分析和进化树构建.
2 结果分析与讨论
2.1 甘草内生真菌的分离与鉴定
如表1所示,从甘草植株的根、茎、叶中共分离得到14株内生真菌,其中从根中分离得到6株,从叶、茎中均分离得到4株.甘草的不同组织中,内生菌株的种类也不同.从根中分离到的内生菌株归属于3个属,依次为镰孢霉属、炭疽菌属、毛霉属,其中毛霉属最多.从茎中分离得到青霉属与炭疽菌属内生菌株.从叶中只分离到青霉属. 从所分离菌株的种属来看,其中青霉属数量最多,为优势菌属.
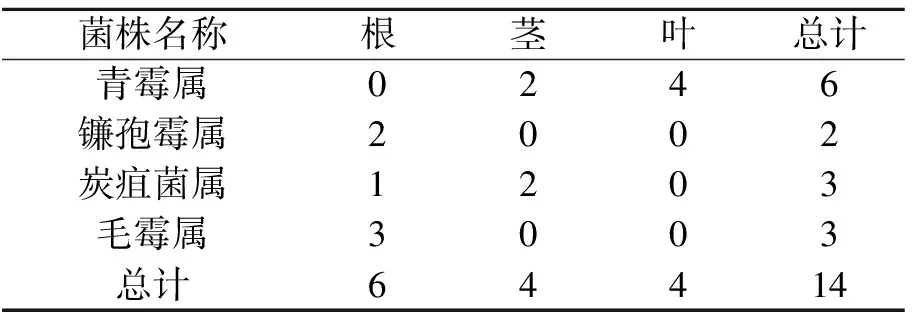
表1 甘草组织中内生菌株的分布
2.2 清除DPPH自由基能力的测定
对14株内生真菌发酵液进行清除DPPH自由基活性的测定,结果见图1.由图1可知:所分离获得的菌株普遍表现出较强的抗氧化活性.其中有4株真菌清除DPPH能力最强,清除率高达95%以上,分别为菌株L1-1,L2-1,R2-1,S2-1,最弱的为菌株R1-1,清除率为54%.
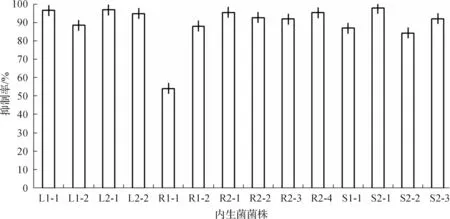
图1 14株内生真菌对DPPH自由基的清除率
2.3 FRAP法筛选
以标准品(FeSO4)溶液的吸光度值y与标准品(FeSO4)浓度x(mmol/L)进行线性回归,求得线性回归方程y=0.286 9x+0.064 3,R2=0.998 4.结果表明FeSO4浓度在0~1 mmol/L范围内与吸光度呈良好的线性关系.取各真菌发酵液,适当稀释后移液器取100 μL,加入FRAP工作液3 mL,混匀反应20 min,于593 nm处读取吸光度,对照标准曲线,求得FRAP值见表2.
实验结果表明:总抗氧化最强的为S2-2;清除DPPH能力最强的为S2-1;综合比较总抗氧化活性和清除DPPH能力,R2-3和L1-2 2株菌株比较突出.综合分析DPPH法和FRAP法,中药甘草中普遍存在具有抗氧化活性的内生真菌,其中根中具有强氧化活性的菌株占33%,茎中占50%,叶中占25%.酵母属的菌株S2-2和R2-3具有高抗氧化能力,强于毛霉属菌株.甘草中不同部位分离得到的内生真菌抗氧化能力不同,不同种属的菌株其抗氧化活性也存在一定差异.

表2 14种内生真菌的FRAP值1)
2.4 活性菌株分子生物学鉴定
由图1和表2可知:内生真菌菌株R2-3对DPPH自由基的抑制率达91.78%,FRAP值为298,较空白组有极显著提高.菌株R2-3为本实验抗氧化活性测定最为显著的菌株,对其进行进一步的分子生物学鉴定.利用26S rDNA D1/D2区引物对其进行扩增,得到一条约606 bp的条带,结果见图2.
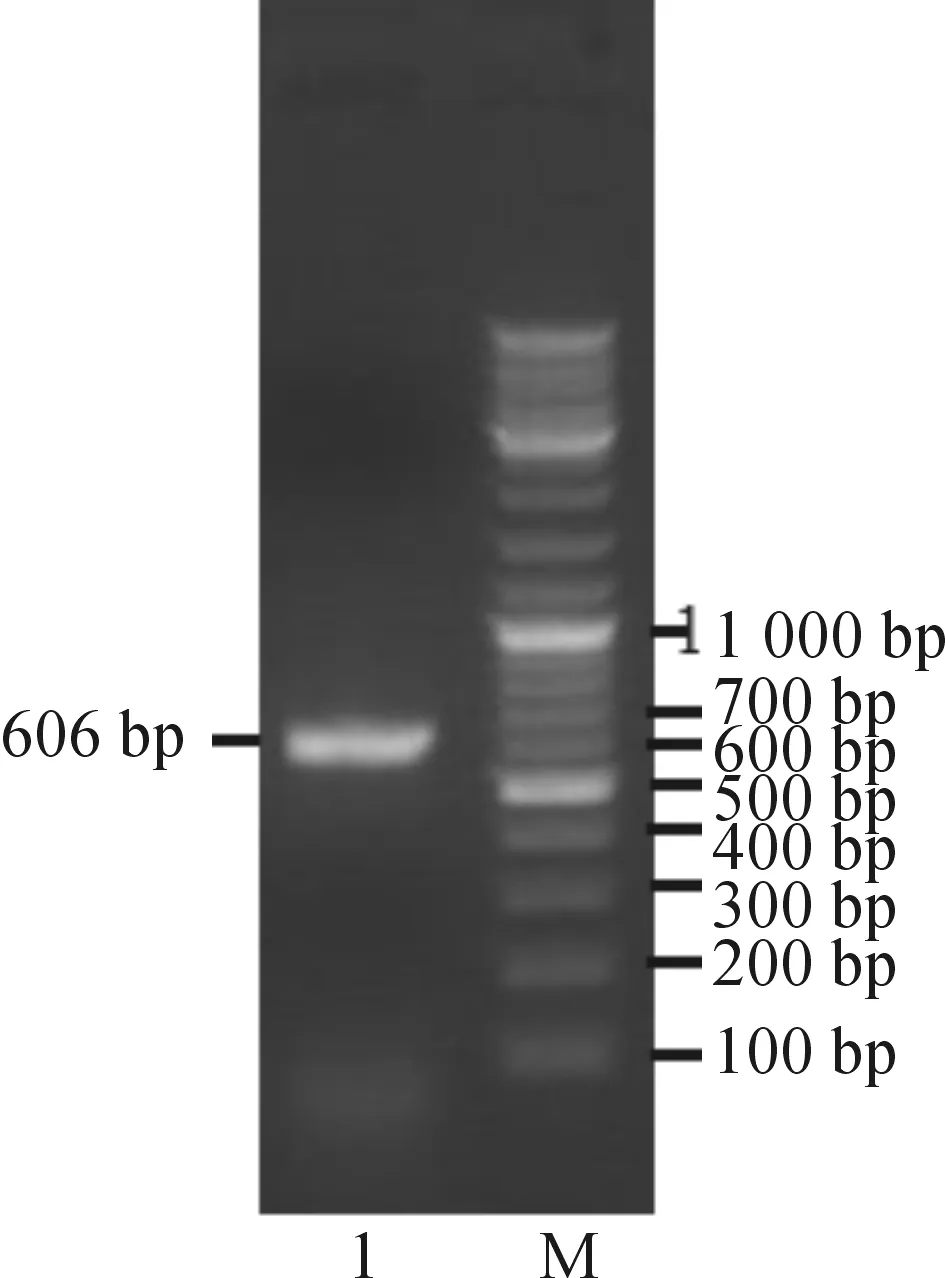
M—标准DNA分子量;1—R2-3
取PCR产物40 μL,由上海生工生物工程公司完成测序工作,测序结果如下:
GCATATCAATAAGCGGAGGAAAAGAAA
CCAACAGGGATTGCCTCAGTAACGGCGAGTG
AAGCGGCAACAGCTCAAATTTGAAATCTGG
CCCCCCGGGTCCGAGTTGTAATTTGCAGAGG
ATGCTTTTGGCGCGGTGCCTTCCGAGTTCCC
TGGAACGGGACGCCATAGAGGGTGAGAGCC
CCGTACGGTTGGACACCAAGCCTGTGTAAA
GCTCCTTCGACGAGTCGAGTAGTTTGGGAA
TGCTGCTCAAAATGGGAGGTATATTTCTTC
TAAAGCTAAATACCGGCCAGAGACCGATAG
CGCACAAGTAGAGTGATCGAAAGATGAAA
AGCACTTTGAAAAGAGGGTTAAACAGCAC
GTGAAATTGTTAAAAGGGAAGCGCTTGTG
ACCAGACTTGCGCCCGGTGAATCACCCAGC
TCTCGCGGCTGGGGCACTTTGCCGGCTCAG
GCCAGCATCAGCTCGCCGTCGGGGACAAAA
GCTTCGGGAACGTAGCTCTCTTCGGGGAGT
GTTATAGCCCGCTGCACAATACCCTTCGGC
GGGCTGAGGTACGCGCTCCGCAAGGATGCT
GGCGTAATGGTCATCAGCGACCCGTCTTGA
AACACGGAC
PCR产物测序结果在NCBI上进行BLAST比对,应用相关软件将菌株R2-3与同源性较近的代表菌株26S rDNA序列进行多重比较后构建系统发育树,见图3.比对分析发现:菌株R2-3扩增片段的碱基序列与Colletotrichumgloeosporioides的26S rDNA序列同源性高达100%,由此证明所筛选到的抗氧化活性菌株为炭疽菌.

图3 R2-3菌株与其他菌株亲缘关系的发育树
3 结 论
实验采用了两种方法评估了14株甘草内生菌株发酵液的抗氧化活性.DPPH法筛选出的4株内生菌株L1-1,L2-1,R2-1,S2-1对DPPH自由基的清除率达95%以上;FRAP法检测3株内生菌株L1-2,S2-2,R2-3表现较高的还原力,FRAP值分别为256,309,298,占菌株总数的14.3%,其他内生菌株也在不同程度上表现出一定的抗氧化活性.结果表明:甘草内生真菌是筛选天然抗氧化活性成分或先导化合物的潜在资源.本次实验首次从乌拉尔甘草中分离到炭疽病菌,且其具有较高的抗氧化活性.炭疽菌虽为致病菌,会侵染植物造成病害,同时宿主甘草中亦存在抑菌活性物质[14],但两者能在特殊的生境中形成良好的共生关系,其共生机制还有待深入研究.
参考文献:
[1]王丽,刘磊,韩素贞.乌拉尔甘草内生真菌拮抗菌株的筛选和鉴定[J].生物技术通讯,2009(6):155-156.
[2]刘建利,曹君迈,马文平.宁夏乌拉尔甘草内生茵鉴定及甜瓜采后病害病原拮抗菌的筛选[J].干旱地区农业研究,2011,29(1):252-253.
[3]朱绪民,邸迎彤,彭树林,等.乌拉尔甘草中的化学成分[J].中草药,2003,34(3):199-201.
[4]汪倩雯,汪琨,杨霄,等.89种中草药醇提物体外抗菌活性的研究[J].浙江工业大学学报,2009,37(3):291-293.
[5]刘霞,党峰峰,贺晓龙,等.陕北野生甘草内生菌的分离及抑茵活性筛选[J].西北植物学报,2010,30(10):2111-2112.
[6]王鸿,蓝丽华,易喻,等.鲜鱼腥草及其内生菌挥发性成分分析[J].浙江工业大学学报,2012,40(6):626-629.
[7]帖卫芳,胡鸢雷,祝建波,等.甘草内生真菌的分离及鉴定[J].生物技术通讯,2010(9):150-152.
[8]陈笑笑,于海宁,应优敏,等.仙鹤草内生真菌的分离鉴定与抗菌活性[J].浙江工业大学学报,2011,39(1):40-41.
[9]霍娟,陈双林.杜仲内生真菌抗氧化活性[J].南昌大学学报,2004,28(3):270-272.
[10]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[11]曾培源,林雄浩,蔡巧燕,等.DPPH法测定粗疣合叶苔内生真菌的抗氧化活性[J].福建中医药大学学报,2010,20(5):41-42.
[12]BENZIE I F F, STRAINT J J. The ferricreducing ability of plasma(FRAP)as a measure of “antioxidant power”: the FRAP assy[J]. Analytical Biochemistry,1996,239:70-76.
[13]FELL J W, BOEKHOUT T, FONSECA A, et al. Biodiversity and systematics of basidiomycetous yeasts as determined by large-subunit rDNA D1/D2 domain sequences analysis[J]. Int J Syst Evol Microbiol,2000,50:1351-1371.
[14]罗建军,翁群芳,胡美英.抑菌植物的筛选及甘草对5种植物病原真菌抑菌活性的研究[J].华南农业大学学报,2012,33(3):357-360.

