葡萄(Vitis vinifera L.)籽蛋白的生化组成分析
汪 莹,胡 冰,徐丹娜,马慧丽,赖童飞,周 婷
(杭州师范大学生命与环境科学学院,浙江 杭州 310036)
葡萄(Vitisvinifera)是葡萄属一种常见落叶木质藤本植物,果实为浆果类水果.葡萄籽为葡萄的种子,质量约占整粒葡萄的5%~7%,是葡萄酒厂和饮料厂在榨汁过程中的主要副产品.我国是葡萄生产大国,2012年产量达960万吨(http://faostat.fao.org/),可产生至少20~30万吨的葡萄籽.葡萄籽含有丰富的蛋白质、粗脂肪、各种氨基酸、维生素及矿物质等[1],具有一定的营养及药用价值.但国内尚未对葡萄籽进行良好的加工利用,分离后多丢弃或发酵后用做肥料,造成了资源的浪费.
目前,对于葡萄籽的开发主要集中于榨油(葡萄籽油中富含人体必需且自身不能合成的亚油酸)及提取其中的天然抗氧化成分低聚原花青素(Oligomeric proanthocyanidins, OPC).近年来,研究发现葡萄籽及其衍生物具有更多的用途.Adámez等研究发现葡萄籽提取物对格兰仕阳性菌及阴性菌均有明显的抑制作用[2];Su等发现葡萄籽提取物能够控制HAV、FCV-F9、MNV-1的3种食源性病毒引发的病害[3];Afonso等研究表明葡萄籽中的酚类复合物能够抑制Angiotensin I converting enzyme的活性,可用于治疗心血管疾病[4];同时,葡萄籽提取物对风湿性关节炎[5]、镉诱导的肾损伤[6]、膀胱癌[7]有一定的疗效.此外,Reddy等将葡萄籽提取物用于羊肉切片及银鲤的冷藏保鲜[8-9];Okaman等还通过化学活化途径将葡萄籽制成活性炭[10].但是长期以来,对葡萄籽的重要组分蛋白质(约占总重的8.44%~25.9%)关注度较低,早期主要集中于葡萄籽蛋白的分离提取技术[11-12],近年来,Pesavento等利用MALDI-MS分析了不同栽培品种葡萄籽蛋白的区别,但没有鉴定具体的成分[13];Gazzola等利用LC-MS/MS技术发现葡萄籽胚乳蛋白主要成分与植物种子蛋白11S globulin同源,并鉴定出一种分子量为43 kDa且与豆科种子7S globulins高度同源的蛋白[14].葡萄籽蛋白的营养学价值及应用潜力需要进一步挖掘.
因此,本研究主要通过双向电泳结合质谱鉴定技术、氨基酸含量分析以及红外光谱分析技术,初步研究了葡萄籽蛋白的主要成分及生化特性,为葡萄籽的综合利用和深度开发提供了理论依据.
1 材料和方法
1.1 材料
葡萄(VitisviniferaL.)籽分离自葡萄皮渣,干燥后用于后续试验,由天津尖峰天然产物研究发展有限公司提供.大豆分离蛋白(蛋白含量为85%),购自哈尔滨大豆高新科技有限公司.
1.2 葡萄籽化学成分分析
葡萄籽的各项生化指标检测简述如下,水分的测定参见GB/T 5009.3-03:直接干燥法;灰分的测定参见GB/T 5009.4-03:干法灰化;脂肪的测定参见GB/T 5009.6-03:索氏抽提;蛋白质含量的测定参见GB/T 5009.5-03:微量凯氏定氮法.
使用IRIS Intrepid型电感耦合全谱直读等离子发射光谱仪(Thermo,USA),检测葡萄籽金属含量.准确称取葡萄籽粉末0.5 g,放入聚四氟乙烯消解罐中.消解罐中加入10 mL王水(V(HCl) ∶V(HNO3)=3∶1),100 ℃加热2 h,冷却到室温后向消解罐中加入3 mL HNO3,100 ℃加热2 h,冷却到室温再加入1 mL HNO3,120 ℃加热4 h,冷却静置过夜.用超纯水定容至50 mL.ICP-AES法测定,射频功率1 050 kW,雾化气压力为4.25×106Pa,辅助气流速110 L/min,样品提升量1 170 mL/min,样品冲洗时间1 min,高波扫描5 s,低波扫描30 s.
1.3 葡萄籽蛋白提取及双向电泳分析
将100 g葡萄籽粉碎、匀浆(50 mmol/L PBS +1%(w/v)PVP,pH 7.5,料液比例为1 g∶4 mL),8层纱布过滤后,4 ℃、12 000 g、30 min离心保留上清液,超纯水透析,100 kDa超滤膜浓缩,冷冻干燥,蛋白干粉样品-80 ℃保存备用.
按10 μg∶1 μL比例将蛋白干粉溶解于蛋白裂解缓冲液(2 mol/L thiourea,7 mol/L urea,4%(w/v)CHAPS,1%(w/v)DTT,2%(v/v)carrier ampholytes pH 3-10)Bradford法检测蛋白质浓度.取100 μg蛋白样品利用裂解缓冲液定容至125 μL,20 ℃水化IPG胶条(IPG strip pH3-10 NL,7 cm)15 h.在等电聚焦仪(PROTEAN i12 IEF Cell,Bio-Rad,USA)中进行等电聚焦.运行参数:250 V Rapid 15 min;4000 V Gradual 60 min;4000 V Rapid 15 000 Vhr;500 V Hold.等电聚焦完毕后,在10 mL平衡缓冲液(6 mol/L urea,75 mmol/L Tris-HCl (pH 8.8),29.3%(v/v)glycerol,2%(w/v)SDS,0.002%(w/v)bromophenol blue)中平衡2次,每次15 min.第一次平衡液中加入100 mg二硫苏糖醇,第二次平衡液中加入250 mg碘乙酰胺.使用Mini-PROTEAN Tetra Cell(Bio-Rad,USA)垂直电泳仪进行第二向SDS-PAGE电泳.分离胶浓度为12.5%,浓缩胶浓度为5%.电压设定为120 V,电泳1.5 h.考马斯亮蓝G-250染色.利用凝胶扫描仪ChemiDoc XRS+ Imaging System(Bio-Rad,USA)采集图像,扫描模式为Transmission mode,分辨率为600 dpi,保存为TIF格式的图像文件.运用Image Master 2D Elite software(Amersham Pharmacia Biotech,Sweden)软件进行分析.挑选丰度最高的5个蛋白点送往生工生物工程(上海)股份有限公司进行质谱鉴定,使用仪器为MALDI-TOF-TOF-MS ABI 4800串联质谱(ABI,USA),检测结果利用MASCOT搜索引擎(Matrix Science Ltd., London,UK)进行搜索.MASCOT MS/MS Ions搜索参数的设置为:Enzyme:Trypsin;Fixed modifications:Carbamidomethyl(C);Variable modifications:Acetyl(Protein N-term),Deamidated (NQ),Dioxidation(W),Oxidation(M);Mass values:Monoisotopic;Peptide Mass Tolerance:±100 ppm;Fragment Mass Tolerance:±0.3 Da;Max Missed Cleavages:1;Instrument type:MALDI-TOF-TOF.
1.4 葡萄籽蛋白的氨基酸组成分析
样品用含2%(w/v)苯酚的6 mol/L盐酸混合,充N2,熔封,置110 ℃水解20 h.旋转蒸发至干,加硼砂缓冲液溶解,OPA/FMOC柱前自动衍生化后上样分析[15].分析柱:hypersil ODS柱 5 μm 4.0×125 mm(Thermo,USA);流动相A:20 mmol/L NaAc(pH7.6),含0.018%(v/v)三乙胺(TEA)和0.3%(v/v)四氢呋喃(THF);流动相B:100 mmol/L NaAc(pH7.2)、CH3OH及CH3CN的混合物,3种物质体积比为1︰2︰2;流速:1 mL/min;柱温:40 ℃;DAD UV检测器: Signal A=338/10 nm Ref =390/20 nm,Signal B=262/16 nm Ref=324/8 nm.
1.5 葡萄籽蛋白红外光谱测定
将干燥的2 mg蛋白样品与200 mg溴化钾研磨均匀,置于模具中,用5×107Pa压力在油压机上压成透明薄片,采用Nicolet Magna IR 560傅里叶变换红外光谱仪(Thermo Nicolet,USA)在4000~400 cm-1波数范围测定吸收光谱[16].扫描次数128次,分辨率4 cm-1.
2 实验结果
2.1 葡萄籽化学成分组成
表1葡萄籽主要成分及金属元素含量
Tab.1Themaincomponentsandmetalelementscontentofgrapeseeds
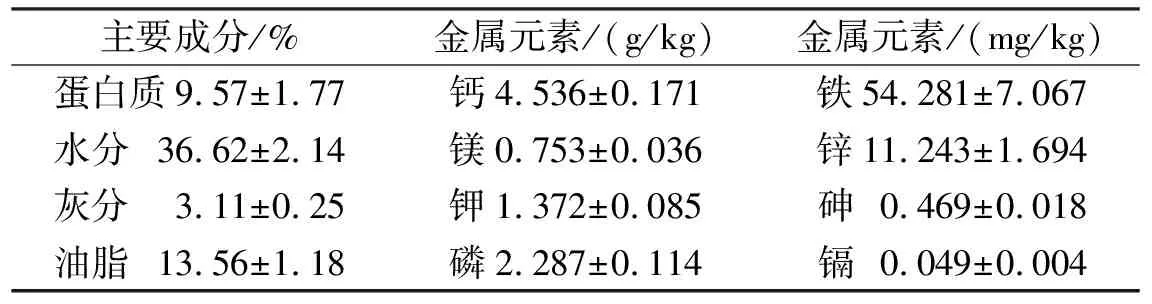
主要成分/%金属元素/(g/kg)金属元素/(mg/kg)蛋白质9.57±1.77钙4.536±0.171铁54.281±7.067水分 36.62±2.14镁0.753±0.036锌11.243±1.694灰分 3.11±0.25钾1.372±0.085砷 0.469±0.018油脂 13.56±1.18磷2.287±0.114镉 0.049±0.004
葡萄籽中蛋白质含量丰富,约占总重的1/10,同时水分及油脂含量超过了50%(表1).因此,葡萄籽经过榨油等工艺后,籽粕中蛋白质含量会进一步提高.同时,葡萄籽中富含钙、磷、钾及镁,砷含量低于粮食国家限量标准(0.7 mg/kg)及重金属镉含量低于谷物类欧盟限量标准(0.1 mg/kg)(表1).在原料产量及食品安全性方面为葡萄籽蛋白的开发及应用提供了保障.
2.2 葡萄籽高丰度蛋白鉴定
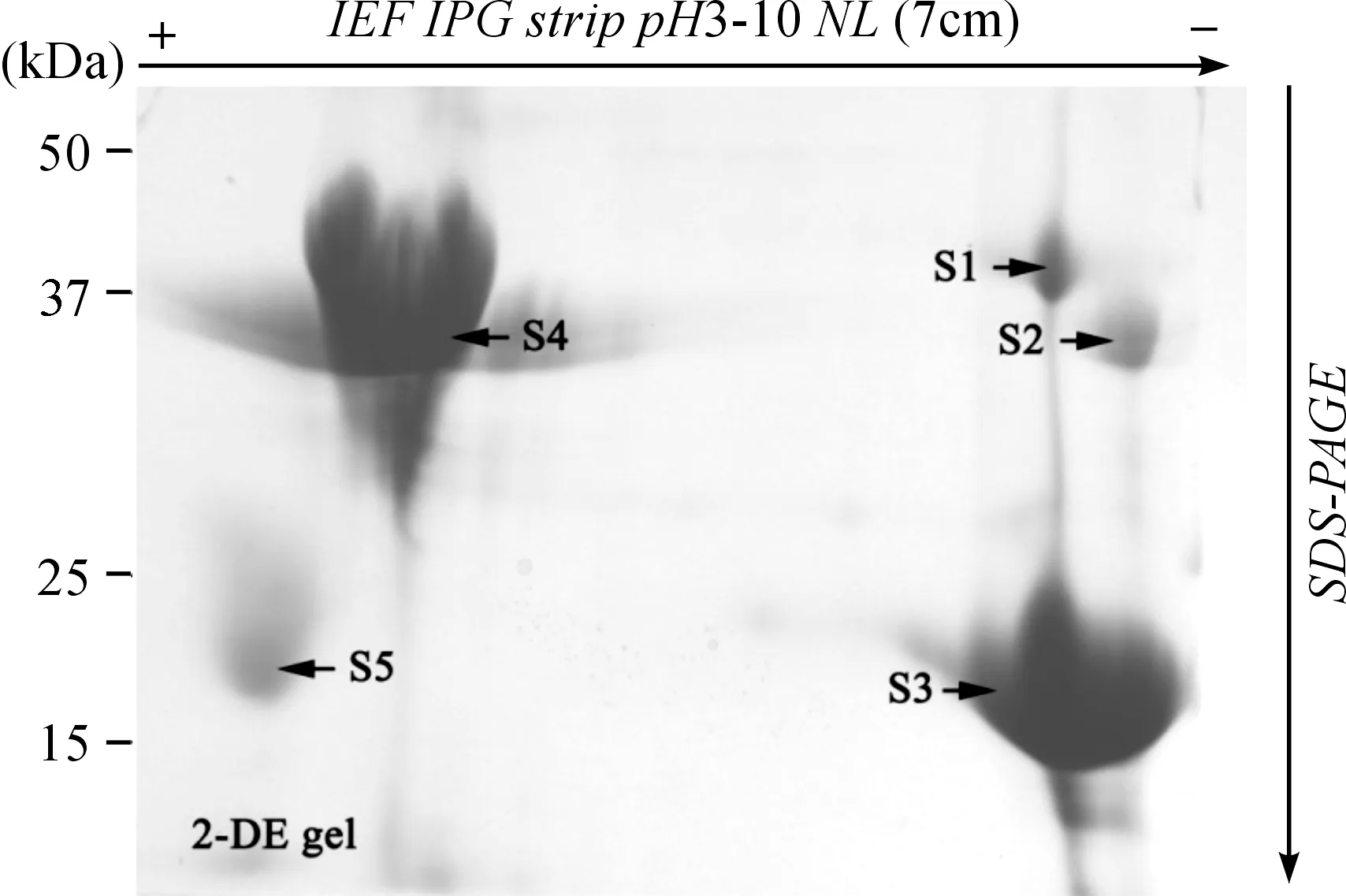
图1 葡萄籽蛋白双向电泳凝胶图谱
利用双向电泳分离葡萄籽总蛋白(图1),蛋白点主要分布在15~50 kDa之间,酸性端(正极)及碱性端(负极)均有分布,通过Image Master 2D Elite software软件识别分析,总数在30~40之间.蛋白点较少的原因可能是因为葡萄籽中高含量的多酚物质及油脂干扰,导致疏水性蛋白质的丢失.同时也可能因为葡萄籽中主要蛋白含量过高,导致凝胶背景较深,影响了软件对低丰度蛋白的识别.选择丰度最高的5个蛋白点进行串联质谱鉴定.鉴定结果(表2)通过数据库比对发现,5个蛋白点的Mascot值均超过阈值,同属于Vitisvinifera,肽段匹配数至少为9个,序列覆盖率超过20%.尽管实际分子量和等电点有所不同,但蛋白点S1和S3的鉴定结果均指向11S globulin subunit beta-like isoform 1,蛋白点S2、S4和S5鉴定结果均指向legumin A-like isoform 1,不同蛋白点鉴定为同一蛋白的现象可能与该蛋白质的结构变化、亚基组成或翻译后修饰有关.11S globulin subunit beta是一个种子贮藏蛋白,由一个11S globulin gamma chains 和11S globulin Delta chains通过一个二硫键形成,该蛋白是一个镁离子结合蛋白,翻译后修饰是通过N末端谷氨酰胺的环化完成.其功能主要是提供镁离子结合位点,同时具有营养贮藏功能,这与Zhou等的研究结果[17]是一致的.Legumin A也是属于11S种子贮藏蛋白,同样由Legumin A alpha chain 和Legumin A beta chain通过一个二硫键形成.该蛋白存在于许多豆科或非豆科植物种子中,作为膳食可提供丰富的含硫氨基酸,其主要功能也是贮藏营养(http://www.uniprot.org).因此可以推断,葡萄籽蛋白主要由11S球蛋白构成,其主要功能为营养贮藏.
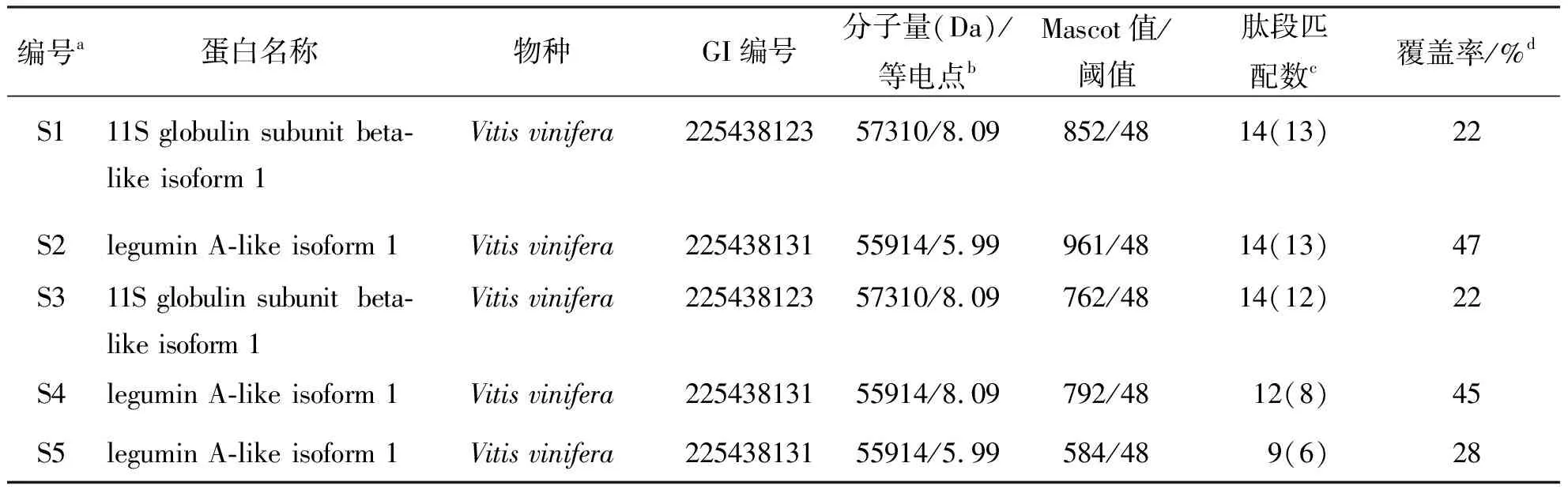
表2 葡萄籽高丰度蛋白质谱鉴定结果
b为匹配蛋白的理论分子量及理论等电点;
c括号外为与蛋白匹配上的肽段数量,括号内为分值超过阈值的肽段数量;
d肽段在匹配蛋白总序列中的覆盖率.
2.3 葡萄籽蛋白的氨基酸组成
葡萄籽蛋白中氨基酸的组成与其他很多植物种子11S球蛋白的氨基酸组成相近(表3),与大豆分离蛋白中含量相似的氨基酸是精氨酸、蛋氨酸、亮氨酸和异亮氨酸;与其他豆科类植物种子蛋白一样,葡萄籽总蛋白缺乏含硫氨基酸,甲硫氨酸和半胱氨酸含量分别仅为0.86%和0.90%;葡萄籽蛋白中酸性、碱性、不带电荷的极性氨基酸以及疏水氨基酸分别占总氨基酸含量的30.16%,8.56%,55.18%和36.25%;呈味氨基酸(天冬酰胺和谷氨酸)和甜味型氨基酸(甘氨酸和丙氨酸)分别占葡萄籽总蛋白中总氨基酸含量的30.16%和20.83%.此外,除了色氨酸,葡萄籽总蛋白中几乎含有人体所有的必需氨基酸,约占总氨基酸含量的27.43%.其中,亮氨酸(7.86%)、缬氨酸(6.53%)以及异亮氨酸(4.63%)是最丰富的必需氨基酸.因此,作为种子贮藏蛋白的葡萄籽蛋白,含有均衡的氨基酸组成和高含量的精氨酸,与大豆分离蛋白具有相似结构组成,具有成为蛋白质或者氨基酸的膳食补充剂的潜力.
表3葡萄籽蛋白和大豆分离蛋白中氨基酸组成比较
Tab.3Acomparisonofaminoacidcompositionbetweengrapeseedsproteinandsoybeanproteinisolate
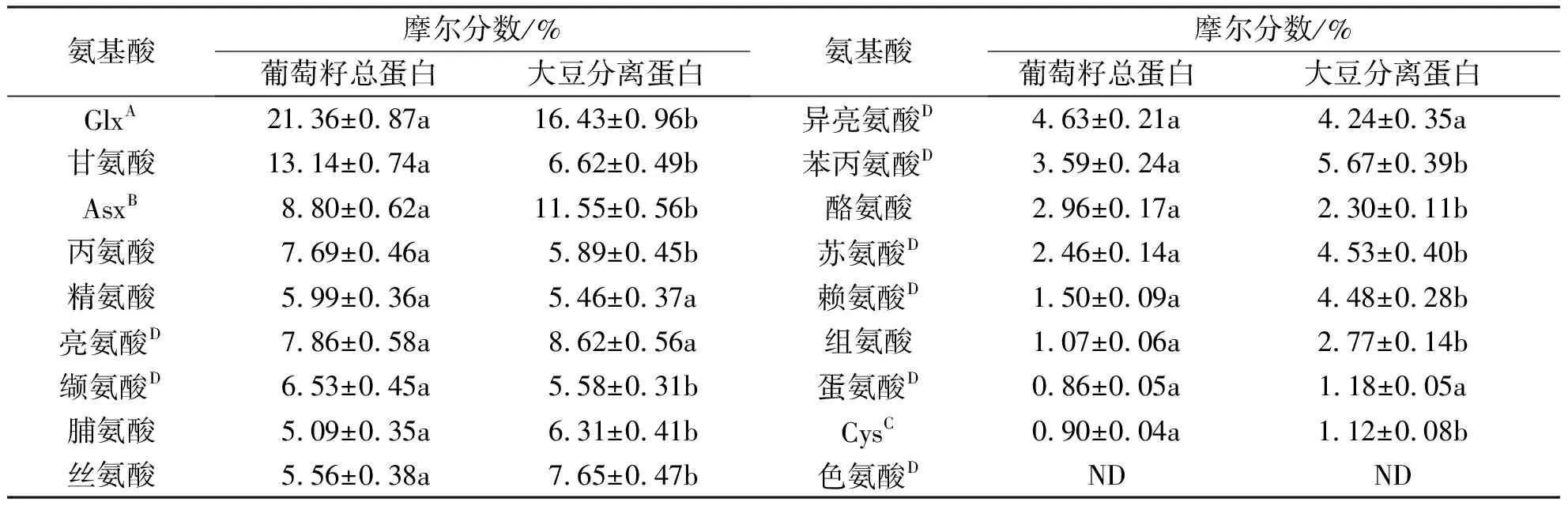
注:图中数值为3次重复的均值±标准方差,ND代表没有检测到;GlxA=谷氨酸+谷氨酰胺;AsxB=天冬氨酸+天冬酰胺;CysC:胱氨酸+半胱氨酸;D 代表必需氨基酸.
2.4 葡萄籽蛋白二级结构分析
通过红外光谱测定pH 7条件下的葡萄籽蛋白中蛋白质二级结构的变化(图2).根据蛋白质二级结构红外光谱特征谱带和蛋白质特征吸收峰的归属可知,1 660~1 669 cm-1谱峰是酰胺I带C=O的伸缩振动,1 535~1 539 cm-1谱峰是酰胺II带C—N的伸缩振动和N—H的面内变形振动,1 231~1 232 cm-1谱峰为酰胺III带C—N伸缩振动和N—H面内变形振动.葡萄籽蛋白光谱在3 300 cm-1左右有明显的单峰,是蛋白质N—H伸缩振动和O—H伸缩振动的特征吸收峰.在以无规则卷曲构象为特征吸收的酰胺I谱带1 660~1 669 cm-1处、酰胺II谱带1 535~1 539 cm-1和酰胺III谱带1 235 cm-1附近处都有明显较强的吸收峰,说明葡萄籽蛋白二级结构中都是以无规卷曲结构为主.葡萄籽蛋白在1 288~1 290 cm-1有明显的吸收,说明葡萄籽蛋白中也含有较多的α-螺旋结构(1 300~1 250 cm-1),葡萄籽蛋白在1 231 cm-1附近的吸收代表其中的β-折叠结构(1 240~1 230 cm-1)也较稳定,且含量少于α-螺旋结构.
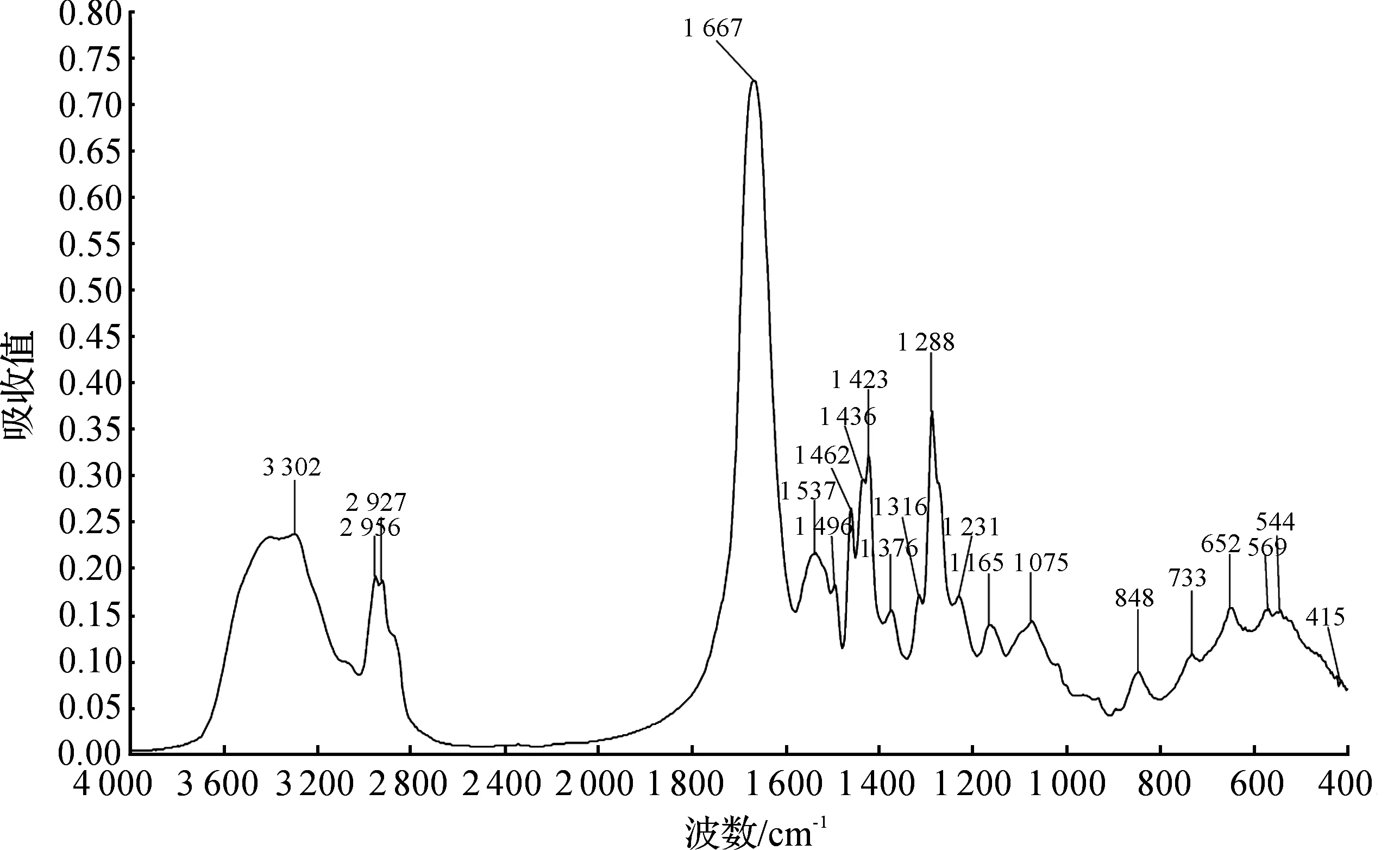
图2 傅里叶变换红外光谱分析葡萄籽蛋白的二级结构
3 讨 论
葡萄籽蛋白是葡萄籽的重要组分之一,其营养成分与其他油料作物或谷物种子蛋白具备一定的相似性,具有开发成膳食蛋白或功能蛋白的潜力.Wu和Lu通过电泳技术在葡萄籽中找到了一种Haze-Active蛋白[18];葡萄籽蛋白还具有一些功能活性,如良好的可溶性及乳化性[19],其蛋白提取物还可以用作葡萄酒的澄清剂[20],表明葡萄籽蛋白还拥有特有的功能活性.因此,加强葡萄籽蛋白组成、结构及功能的研究具有一定的现实意义.在此背景下,本研究首先对葡萄籽各主要成分和金属元素的含量进行了评估,确定了葡萄籽蛋白的应用基础;通过双向电泳结合质谱鉴定手段,确定了葡萄籽蛋白的主要成分为11S球蛋白,其功能主要是营养贮藏;通过氨基酸组成检测及比较分析,确定了葡萄籽蛋白的营养价值;最后利用红外光谱分析,对葡萄籽蛋白的二级结构进行了初步分析.研究结果将为葡萄籽蛋白的综合利用及功能性产品的研发提供理论基础.
[1]Prodanov M, Vacas V, Hernández T,etal. Chemical characterization of Malvar grape seeds (VitisViniferaL.) by ultrafiltration and RP-HPLC-PAD-MS[J]. Journal of Food Composition and Analysis,2013,31(2):284-292.
[2]Adámez J D, Samino E G, Sánchez E V,etal. In vitro estimation of the antibacterial activity and antioxidant capacity of aqueous extracts from grape-seeds(VitisviniferaL.)[J]. Food Control,2012,24(1):136-141.
[3]Su X, D’Souza D H. Grape seed extract for foodborne virus reduction on produce[J]. Food Microiology,2013,34(1):1-6.
[4]Afonso J, Passos C P, Coimbra M A,etal. Inhibitiory effect of phenolic compounds from grape seeds (VitisviniferaL.) on the activity of angiotensin I converting enzyme[J]. LWT-food Science and Technology,2013,54:265-270.
[5]Ahmad S F, Zoheir K M A, Abel-Hamied H E,etal. Grape seed proanthocyanidin extract has potent anti-arthritic effects on collagen-induced arthritis by modifying the T cell balance[J]. International Immunopharmacology,2013,17(1):79-87.
[6]Chen Q, Zhang R, Li W,etal. The protective effect of grape seed procyanidin extract against cadmium-induced renal oxidative damage in mice[J]. Environmental Toxicology and Pharmacology,2013,36(3):759-768.
[7]Raina K, Tyagi A, Kumar D,etal. Role of oxidative stress in cytotoxicity of grape seed extract in human bladder cancer cells[J]. Food and Chemical Toxicology,2013,61:187-195.
[8]Reddy G B B, Sen A R, Nair P N,etal. Effect of grape seed extract on the oxidative and microbial stability of restructured mutton slices[J]. Meat Science,2013,95(2):288-294.
[9]Shi C, Cui J, Yin X,etal. Grape seed and clove bud extracts as natural antioxidants in silver carp (Hypophthalmichthysmolitrix) fillets during chilled storage: Effect on lipid and protein oxidation[J]. Food Control,2014,40:134-139.
[10]Okaman I, Karagöz S, Tay T,etal. Activated carbons from grape seeds by chemical activation with potassium carbonate and potassium hydroxide[J]. Applied Surface Science,2014,293(28):138-142.
[11]Fazio G, Gattuso A M, Cilluffo V,etal. Preparation and characterization of protein materials from grape seed meals[J]. Journal of Agricultural and Food Chemistry,1983,12:469-478.
[12]Gianazza E, Tedesco G, Villa P,etal. Characterization of the major proteins fromVitisviniferaseeds[J]. Plant Science,1989,62(1):73-81.
[13]Pesavento I C, Bertazzo A, Flamini R,etal. Differentiation ofVitisviniferavarieties by MALDI-MS analysis of the grape seed protein[J]. Journal of Mass Spectrometry,2008,43(2):234-241.
[14]Gazzola D, Vincenzi S, Gastaldon L,etal. The protein of the grape (VitisviniferaL.) seed endosperm: Fractionation and identification of the major components[J]. Food Chemistry,2014,155:132-139.
[15]Marcone M F, Yada R Y, Aroonkamonsri W,etal. Physico-chemical properties of the purified isoforms of the “12s” seed globulin from mustard seed(Brassicaalba)[J]. Bioscience, Biotechnology, and Biochemistry,1997,61(1):65-74.
[16]Choi S M, Ma C Y. Conformational study of globulin from Common Buckwheat (FagopyrumesculentumMoench) by fourier transform infrared spectroscopy and differential scanning calorimetry[J]. Journal of Agricultural and Food Chemistry,2005,53(20):8046-8053.
[17]Zhou T, Li Q, Zhang J,etal. Purification and characterization of a new 11S globulin-like protein from grape(VitisviniferaL.) seeds[J]. European Food Research and Technology,2010,230(5):693-699.
[18]Wu L, Lu Y. Electrophoretic method for the identification of a haze-active protein in grape seeds[J]. Journal of Agricultural and Food Chemistry,2004,52(10):3130-3135.
[19]Zhou T, Zhang T, Liu W,etal. Physicochemical characteristics and functional properties (VitisviniferaL.) seeds protein[J]. International Journal of Food Science & Technology,2011,46(3):635-641.
[20]Vincenzi S, Dinnella C, Recchia A,etal. Grape seed proteins: a new fining agent for astringency reduction in red wine[J]. Australian Journal of Grape and Wine Research,2013,19(2):153-160.

