羟丙基-β-环糊精与青霉素酶的相互作用
余晓东, 邱燕子, 黄宗华, 陈 玉, 宋发军*
(1.中南民族大学 生命科学学院 武陵山区特色资源植物种质保护与利用湖北省重点实验室, 武汉 430074;
羟丙基-β-环糊精与青霉素酶的相互作用
余晓东1, 邱燕子1, 黄宗华1, 陈 玉2, 宋发军1*
(1.中南民族大学 生命科学学院 武陵山区特色资源植物种质保护与利用湖北省重点实验室, 武汉 430074;
2.中南民族大学 化学与材料科学学院, 武汉 430074)
应用紫外分光光度法、荧光分析法研究了羟丙基-β-环糊精(HP-β-CD)包合青霉素酶后酶活力的变化;荧光分析法检测不同温度下HP-β-CD对青霉素酶内在荧光的影响;将HP-β-CD与青霉素酶进行分子对接,分析青霉素酶与HP-β-CD相互作用的位点及作用方式;测定青霉素酶被HP-β-CD包合后对青霉素钠的分解速率.结果发现:HP-β-CD作用后的青霉素酶复合物的活力提高了2.12倍.荧光光谱研究发现:HP-β-CD对酶蛋白荧光有增敏作用,HP-β-CD包合青霉素酶的包合比为1∶1,包合反应自发进行.同步荧光结果显示:HP-β-CD与青霉素酶复合物同步荧光比青霉素酶强,酶蛋白荧光主要源于酪氨酸(Tyr)残基.分子对接实验结果显示:HP-β-CD与青霉素酶之间共形成了3对氢键,VAL39、ASN180和ASP183参与了氢键的形成.
羟丙基-β-环糊精; 青霉素酶; 分子对接
β-环糊精(β-Cyclodextrin,简称β-CD)是直链淀粉由芽孢杆菌产生的环糊精葡萄糖基转移酶作用下生成的环状低聚糖,含有7个D-吡喃葡萄糖单元.β-CD的外缘亲水而内腔疏水,它能够象酶一样提供一个疏水的结合部位,作为主体包络各种适当的客体,如有机分子、无机离子以及气体分子等.这种选择性的包络作用即通常所说的分子识别,其结果是形成主客体包络物(Host-Guest Complex).β-CD是迄今所发现的类似于酶的理想宿主分子,并且其本身就有酶模型的特性.因此,在催化、分离、食品以及药物等[1-3]领域中,β-CD受到了极大的重视和广泛应用.
羟丙基-β-环糊精( HP-β-CD) 是由β-CD和环氧丙烷在碱性条件下发生缩合反应的产物,由于其具有内疏水外亲水的特殊空腔结构及水溶性强的特点[4],已被广泛应用于食品、化妆品、环境和农业生产等领域[5].
青霉素酶 (EC 3.5.2.6) 是催化水解青霉素β-内酰胺环, 使青霉素变成无抗菌活性的青霉素酮酸的一类β-内酰胺酶[6].上个世纪40年代青霉素还未广泛应用于临床时, Abraham 等就从耐青霉素的E.coli K12中发现了青霉素酶[7].一方面细菌产生青霉素酶导致耐药性, 但另一方面,利用青霉素酶具有水解β-内酰胺类抗生素的特点, 可用于抗生素药品质量检验和新抗菌药物筛选.青霉素酶最具前景的用途是对牛奶中的青霉素残留的快速定量测定、对青霉素含量超标的牛乳除去青霉素的处理.国外在20世纪80年代中期就开展了青霉素酶固定化、处理青霉素超标牛乳的研究.由于青霉素酶具有价格低廉和灵敏度高等优点,可在酶联免疫分析(ELISA)中替代传统的辣根过氧化物酶和碱性磷酸酶.我国对青霉素酶的研究起步较晚.1999 年,中国药品生物制品检定所分离出1株能产生青霉素酶的蜡状芽孢杆菌CMCC(B)63301, 并对该酶的发酵方法、水解酶谱和保存稳定性等方面进行了研究[8].
本文用紫外及荧光分析法研究了青霉素酶和HP-β-CD的相互作用,测定了酶促反应速率的变化;通过荧光光谱法研究了不同温度下青霉素酶和HP-β-CD的相互作用,测定了青霉素酶与HP-β-CD作用前后内在荧光的变化;用分子对接方法和计算机辅助手段研究了青霉素酶与HP-β-CD的作用方式、作用位点及主要作用力.对青霉素酶HP-β-CD复合物的研究,以期提高青霉素酶的活力,增加青霉素酶检测青霉素残留的灵敏度,从而使青霉素酶的应用更加广阔.
1实验方法
1.1酶活性的测定
将青霉素钠溶液在紫外分光光度计中进行光谱扫描,确定青霉素钠的吸收峰位置.以pH=7.0磷酸缓冲液为参比,将青霉素钠溶液放置于37℃恒温水浴锅中保温5 min,加入预先保温的HP-β-CD溶液和青霉素酶液的混合液,于青霉素钠最大波长记录反应过程.

表1 HP-β-CD与青霉素酶活力测定样品配制Tab.1 The sample preparation of HP-β-CD and penicillinase mL
按表1操作,取4只离心管,分别将不同浓度的HP-β-CD加入离心管中,再往各管中加入20 μL青霉素酶溶液,混匀,于37℃恒温水浴1 h,形成稳定包合物后,再加入底物青霉素钠溶液,每隔5 s记录吸收值直至反应完全.青霉素酶浓度为1.2×106U/L, HP-β-CD浓度为1×10-2mol/L,青霉素钠浓度为1×10-5mol/L.
1.2荧光光谱分析
HP-β-CD浓度为1×10-2mol/L,青霉素酶浓度为1.2×106U/L,均用pH=7.0的磷酸缓冲液溶解,4℃保存备用.

表2 光谱测定样品配制Tab.2 The sample preparation of spectrometry mL
按表2操作:将各样品混合溶液混匀,静置1 h.在激发波长λex=280 nm处,记录λex=300~520范围的荧光发射光谱.分别设定Δλ=20 nm和Δλ=80 nm获得青霉素酶的酪氨酸(Tyr)和色氨酸(Trp)残基的同步荧光光谱.激发和发射缝隙宽度为10.0 nm, 0.2 mol/L(pH7.2)的Tris-HCl缓冲液为参照.
用荧光光谱法测定不同浓度的HP-β-CD对青霉素酶的内在荧光并进行表征.根据Benesi-Hildebrand公式(1),以1/(F-Fo)对1/[CD]作出双倒数图,再由线性关系图得到HP-β-CD与青霉素酶的包合比,计算出结合常数K和吉布斯自由能ΔG,其中结合常数K值为线性方程中的截距与斜率之比,ΔG=-RTlnK.
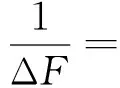
(1)
[G]0:青霉素酶的起始浓度;[CD]:HP-β-CD的浓度;ΔF=F-F0,其中F0和F分别为自由青霉素酶及HP-β-CD存在时青霉素酶的荧光强度;k和Q分别为仪器常数和荧光量子产率.
1.3分子对接
分子对接实验中所有软件参数均使用默认值(Studio Visualizer 2.5软件包).青霉素酶的蛋白质结构来源于蛋白质数据库(PDB-ID, 3111),含有227个氨基酸,仅有一条肽链组成;HP-β-CD的三维结构经过半经验量化计算(MOPAC)优化后用于分子模拟实验.
2结果与分析
2.1HP-β-CD对青霉素酶活力的影响
对青霉素钠样品进行紫外扫描,确定样品的最大吸收波长值在λ=233 nm处.20 μL青霉素酶催化水解青霉素钠溶液时间超过6 min之后,吸光度值不再改变,因此确定反应所需的时间为6 min.

(A:none HP-β-CD; B:HP-β-CD=0.667×10-7 mol/L; C:HP-β-CD=1.33×10-7 mol/L;D:HP-β-CD=3.33×10-7 mol/L)图1 HP-β-CD对青霉素酶活力的影响Fig.1 HP-β-CD enhance enzymatic activity of penicillinase表3 酶活力测定线性方程Tab.3 The linear equations of enzymatic activity determination

名称线性方程相关系数标准差Ay=0.7048-0.0787x0.9980.0034By=0.7096-0.1325x0.9990.0019Cy=0.6700-0.1441x0.9990.0034Dy=0.6897-0.1662x0.9990.0046
实验均在37℃、pH=7.0条件下进行,随着HP-β-CD的浓度增加,青霉素酶的活性增强,酶促反应速率增快.由图1中可以看出:HP-β-CD对青霉素酶的活力有促进作用.
由表3可知分别加入不同浓度的HP-β-CD,对青霉素酶活力的影响也不同,当HP-β-CD终浓度分别为:0、0.667×10-7mol/L、1.33×10-7mol/L和3.33×10-7mol/L时,青霉素钠每分钟的分解反应速率变化分别是:0.078 7、0.132 5、0.144 1和0.166 2.HP-β-CD浓度为3.33×10-7mol/L,青霉素钠的分解反应速率为原来的2.12倍.实验表明,HP-β-CD对青霉素酶进行包合后,青霉素酶的酶活性得到提高.
2.2HP-β-CD对青霉素酶酶蛋白荧光的影响
图2为HP-β-CD与青霉素酶相互作用的荧光光谱,当λem=280 nm时,青霉素酶最大荧光发射峰出现在330 nm附近.

Penicillinase:3×104U/L;HP-β-CD:(0~9)×10-6 mol/L图2 HP-β-CD与青霉素酶相互作用的荧光光谱Fig.2 The fluorescence spectrum of interaction between HP-β-CD and penicillinase
磷酸缓冲液和HP-β-CD无荧光光谱,但HP-β-CD对磷酸缓冲液的溶剂峰有一定的增强作用;因此本实验选择Tris-HCl缓冲液为溶剂,以排除溶剂对荧光强度的干扰.由图2可知随着HP-β-CD终浓度的升高,青霉素酶的荧光强度也逐渐增强,发射峰蓝移.

The linear equation is:y=71.33+88.41x, r=0.998;y=51.41+84.81x, r=0.999; y=31.65+81.10x,r=0.998, in 293 K,303 K,313 K respectively.图3 不同温度下的HP-β-CD与青霉素酶 复合物的荧光极值的线性关系图Fig.3 The linear equations of HP-β-CD- penicillinase complex fluorescence maximum value in differently temperature
由图3可知:直线的斜率随温度升高而下降,即随着温度的升高,青霉素酶的荧光强度下降;相关系数均大于0.99,线性关系良好.当温度为293 K时,HP-β-CD对青霉素酶的荧光增敏作用最明显.可见,温度对复合物的荧光值有一定的影响,温度较低时,青霉素酶及其复合物的荧光值较大.

图4 荧光增加值(ΔF)与HP-β-CD浓度的关系Fig.4 The relationship of ΔF and HP-β-CD concentration
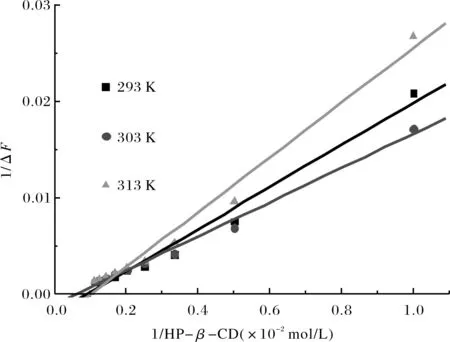
图5 不同温度下的双倒数图Fig.5 The double reciprocal plot in differently temperature表4 不同温度下的双倒数方程、结合常数、自由能Tab.4 The double reciprocal plot equations,binding constant and free energy in differently temperature
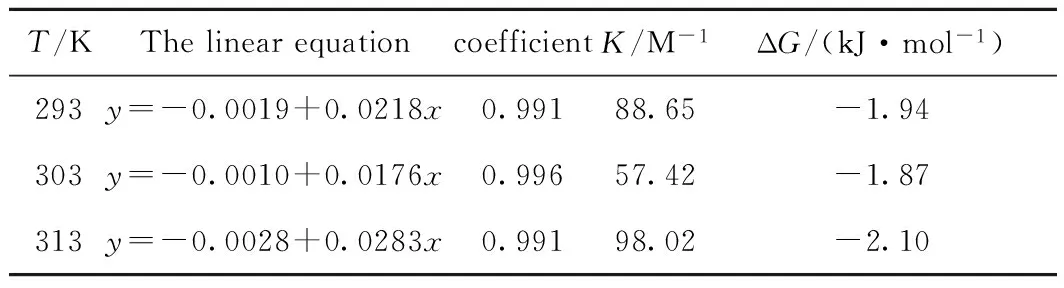
T/KThelinearequationcoefficientK/M-1ΔG/(kJ·mol-1)293y=-0.0019+0.0218x0.99188.65-1.94303y=-0.0010+0.0176x0.99657.42-1.87313y=-0.0028+0.0283x0.99198.02-2.10
由图4可以看出:ΔF与HP-β-CD的浓度关系表现出Langmuir单分子吸附等温线规律:ΔF先线性增加,后趋近平衡,推测HP-β-CD与青霉素酶的包结化学计量比为1∶1,即HP-β-CD与青霉素酶1∶1包合.根据公式(1),以1/(F-Fo)对1/[CD]作图得到图5.结合常数K等于截距与斜率之比;由ΔG=-RTlnK,计算各温度下的自由能变化值.图5和表4中,双倒数图的线性方程相关系数均大于0.99,线性关系良好;证明HP-β-CD与青霉素酶包结物的化学计量比为1∶1,且与温度相关.根据表4可知,当温度分别为293 K、303 K和313 K时,结合常数分别为88.65 M-1、57.42 M-1和98.02 M-1,同时其吉布斯自由能(ΔG)分别为-1.94 kJ/mol、-1.87 kJ/mol和-2.10 kJ/mol.当计量比为1∶1时,在293 K与313 K的结合常数明显大于303 K;由此可以认为在293 K与313 K时,比303 K时更有利于复合物的形成.包合常数的差异说明客体对主体的包合能力不同,温度对复合物的化学计量比有极大的相关性.由于HP-β-CD包结青霉素酶过程的ΔG均为负值,表明包合反应均能自发进行.总的来讲,各温度下的包合常数和吉布斯自由能的差值均不明显.
2.3HP-β-CD对青霉素酶酶蛋白酪氨酸和色氨酸残基荧光的影响
由Δλ=λem-λex,得到同步荧光谱图,当Δλ=20 nm时,仅显示青霉素酶酪氨酸残基的同步荧光光谱特征;当Δλ=80 nm时,仅显示青霉素酶色氨酸残基的同步荧光光谱特征.

图6 HP-β-CD与青霉素酶相互作用的同步荧光光谱Fig.6 The synchronous fluorescence spectrum of HP-β-CD-penicillinase complex
图6中,曲线l是青霉素酶的酪氨酸(Tyr)同步荧光光谱;曲线3是青霉素酶色氨酸(Trp)残基的同步荧光光谱;曲线2是加入HP-β-CD作用青霉素酶后,酪氨酸(Tyr)的同步荧光光谱;曲线4是加入HP-β-CD作用青霉素酶后,色氨酸(Trp)的同步荧光光谱.酪氨酸(Tyr)在280 nm左右有最大峰,而色氨酸(Trp)在360 nm处出现最大峰.由图6可以看出,加入HP-β-CD后,酪氨酸和色氨酸残基的同步荧光均增大,可以看出实验中青霉素酶的荧光主要源于酪氨酸(Tyr)残基,且其最大吸收峰蓝移.表明HP-β-CD和青霉素酶发生了相互作用,且对酪氨酸(Tyr)残基的影响更为明显.
2.4HP-β-CD与青霉素酶相互作用的分子对接分析
分子对接研究为HP-β-CD和青霉素酶之间相互作用提供了主体HP-β-CD和青霉素酶氨基酸残基相互作用的精确信息.根据分子对接研究可知,HP-β-CD分子作用于青霉素酶分子的表面.
图7显示了0.2 nm范围内主要的青霉素酶氨基酸残基与HP-β-CD之间氢键供体和氢键受体轮廓图.从图7中可以看出,在0.2 nm范围内的氨基酸有:VAL39、TRP59、HIS88、ALA89、ASP90、ASP177、LEU178、GLY179、ASN180、VAL181、ALA182、ASP183和HIS210,总共13个氨基酸.其

图7 HP-β-CD和青霉素酶(PDB-ID,3111)特异性作用区域及HP-β-CD 主体0.2 nm范围内标记的蛋白残基及氢键作用力Fig.7 The specificity region and amino acid residues and hydrogen bonds of HP-β-CD-penicillinase complex
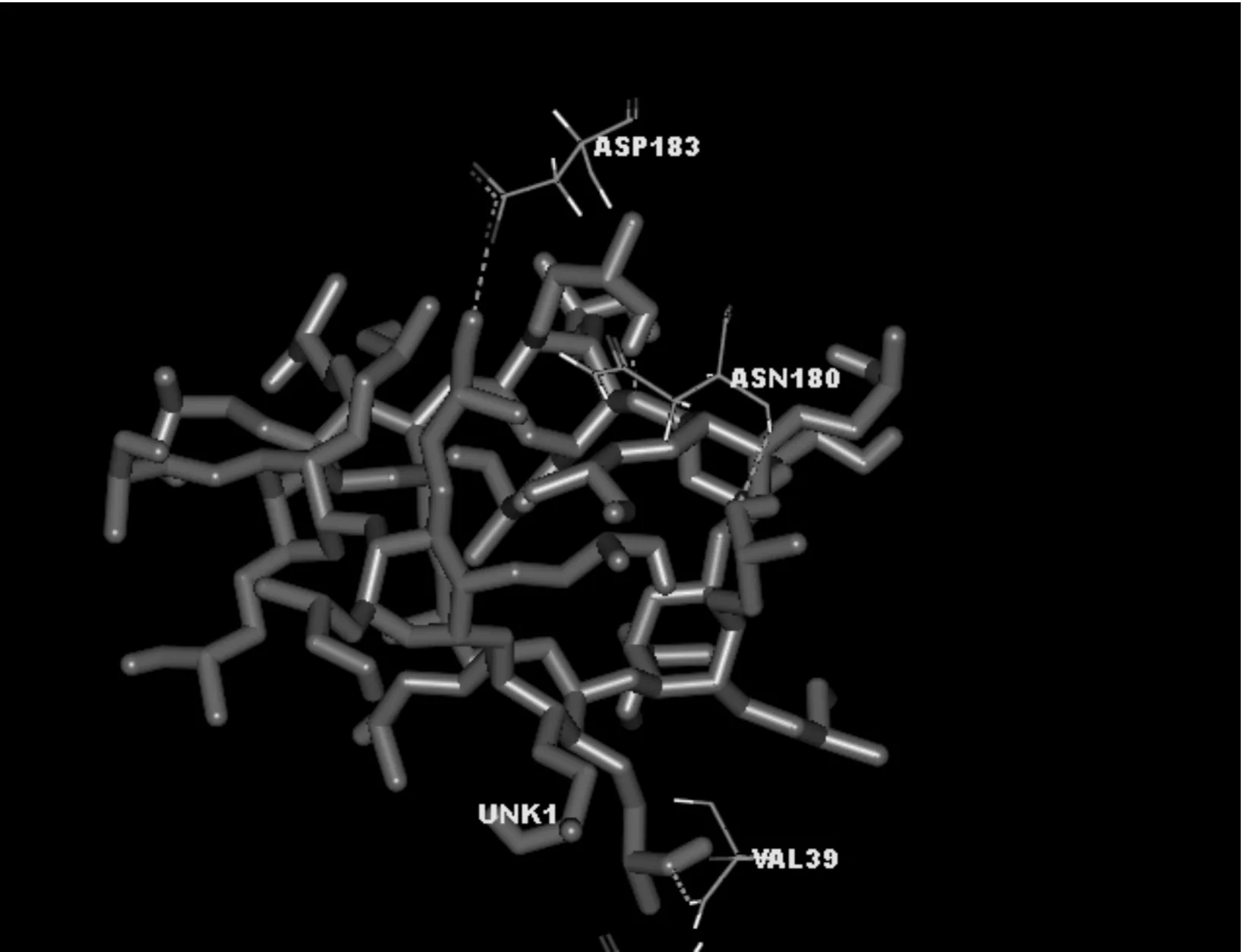
图8 在Studio Visualizer 2.5中标记HP-β-CD和 青霉素酶(PDB-ID,3111)氢键作用的残基和位点Fig.8 The amino acid residues and sites of hydrogen bond formation were marked with Studio Visualizer 2.5 software

图9 青霉素酶(PDB-ID,3111)与HP-β-CD相互 作用的特异位点(Studio Visualizer 2.5)Fig.9 The distinctive sites of HP-β-CD- penicillinase complex were marked on this protein surface with Studio Visualizer 2.5 software
中疏水性氨基酸的百分比约占46%,表明疏水作用力是HP-β-CD和青霉素酶的主要相互作用之一.
图8反映了HP-β-CD和青霉素酶(PDB-ID,3111)之间的相互作用,可能形成了3组氢键.参与的氨基酸残基有VAL39、ASN180和ASP183,其中为VAL39和ASN180是质子供体,氢键距离分别为0.202 nm 和 0.242 nm;ASP183为质子受体,氢键距离值为0.208 nm.
为了更好的观察HP-β-CD和青霉素酶分子之间的相互作用,用Studio Visualizer 2.5软件处理后得到图9的蛋白质二级结构,蛋白质骨架被描绘成一条缎带或管状结构,圆柱状表示α螺旋,可以看出,HP-β-CD主体0.2 nm范围内仅有α螺旋结构,且ASN180和ASP183在同一段α螺旋上.
3结论
HP-β-CD作为一种外加试剂与青霉素酶作用,测定作用前后青霉素酶活力的变化,发现作用后的青霉素酶复合物酶活力升高.当HP-β-CD浓度分别为:0、0.067×10-7mol/L、0.133×10-7mol/L和 3.33×10-7mol/L时,活力分别是:0.078 7、0.132 5、0.144 1和0.166 2.当HP-β-CD浓度为3.33×10-7mol/L,青霉素酶复合物的酶活力为青霉素酶的2.12倍.
测定青霉素酶的固有荧光强度以及青霉素酶与不同浓度HP-β-CD的复合物的荧光强度,用Benesi-Hildebrand公式、吉布斯自由能公式计算,得出温度分别为293 K、303 K和313 K时,结合常数分别为88.65 M-1、57.42 M-1和98.02 M-1,吉布斯自由能(ΔG)分别为-1.94 kJ/mol、-1.87 kJ/mol和-2.10 kJ/mol.在293 K与313 K的结合常数明显大于303 K.可以认为在293 K与313 K时,比303 K时更有利于复合物的形成.
双倒数作图得出了HP-β-CD与青霉素酶包合比为1∶1,实验表明HP-β-CD与青霉素酶包结过程的ΔG均为负值,说明包合反应可以自发进行.
同步荧光结果显示酪氨酸(Tyr)残基和色氨酸(Trp)残基分别在280 nm和345 nm处出现发射峰,HP-β-CD-青霉素酶复合物的同步荧光强度均增强,青霉素酶的荧光主要源于酪氨酸(Tyr)残基,其最大吸收峰位置蓝移.表明HP-β-CD和青霉素酶的相互作用位点同时接近色氨酸(Trp)残基和酪氨酸(Tyr)残基,且HP-β-CD对酪氨酸(Tyr)残基的影响更为明显.
分子对接显示:HP-β-CD与青霉素酶之间共形成了3对氢键,其中为VAL39和ASN180是质子供体,氢键键长分别为0.202 nm 和 0.242 nm,ASP183为质子受体,氢键键长为0.208 nm.
[1] 宋发军, 曾小英, 罗 衡, 等.β-环糊精衍生物与核糖核酸酶的相互作用[J]. 华中师范大学学报:自然科学版, 2010, 44(1):76-79.
[2] Qiu Yanzi, Huang Zonghua, Song Fajun. Enzymatic activity enhancement of non-covalent modified superoxide dismutase and molecular docking analysis [J]. Molecules, 2012, 17: 3945-3956.
[3] 邱凤仙, 顾晓仙, 郭小瑞, 等. 基于β-环糊精的共聚物无磷阻垢剂的制备及性能评价[J]. 湖北大学学报:自然科学版, 2012, 34(2):154-157.
[4] Wang L,Jiang X H,Xu W J,et al. Complexation of tanshinone Ⅱ. A with 2-hydroxypropyl-cyclodextrin:effect on aqueous solubility,dissolution rate,and intestinal absorption behavior in rats[J]. Int J Pharmaceutics, 2007, 341(1-2):58-67.
[5] 何仲贵.环糊精复合物技术[M].北京:人民卫生出版社, 2008:3.
[6] 张凤凯, 张 枫. 蜡状芽孢杆菌CMCC(B)63301产生青霉素酶的特性及其应用的研究[J]. 药物分析杂志, 1999, 19(3):158.
[7] Schroen C G P H, Nierstrasz V A , Kroon P J, et al. Thermodynamically controlled synthesis ofβ-lactam antibiotics equilibrium concentrations and side-chain properties [J]. Enzyme Microb Techonol, 1999, 24: 498.
[8] 戚 薇, 王晓媛, 王建玲, 等. 青霉素酶分离纯化及酶学性质研究[J]. 中国抗生素杂志, 2007, 32(8): 466-469.
Study on interactions between hydroxypropyl-β-cyclodextrins and penicillinase
YU Xiaodong1, QIU Yanzi1, HUANG Zonghua1, CHEN Yu2, SONG Fajun1
(1. Hubei Provincial Key Laboratory for Protection and Application of Special Plants in Wuling Area of China,College of Life Science, South Central University for Nationalities, Wuhan 430074;2.College of Chemistry and Materials Science, South-Central University for Nationalities ,Wuhan 430074)
Uv-vis and fluorescence analysis methods were applied to determine enzyme activity of penicillinase and HP-β-CD-penicillinase complex. Fluorescence analysis was used to study the influence of HP-β-CD on the inner fluorescent of penicillinase at different temperatures. The molecular docking was employed to study the interaction sites and modes between penicillinase and HP-β-CD. By comparing the influences on the hydrolysis rate of penicillin sodium brought by penicillinase and HP-β-CD-penicillinase complex, it could be found that the catalysis rate of HP-β-CD-penicillinase complex increased 2.12 times than penicillinase. The fluorescent spectrometry indicated that HP-β-CD could improve the sensitization of the fluorescence of penicillinase. When the inclusion rate of penicillinase and HP-β-CD was 1∶1, the inclusion reaction could act spontaneously. The synchronous fluorescence revealed that the complex of HP-β-CD and penicillinase was more intensity than that of penicillinase, and the fluorescence of penicillinase was mainly derived from tyrosine (Tyr) residue. The results of molecular docking showed that there were only three amino acid residues involved in the hydrogen bond formation, which were VAL39, ASN180 and ASP183.
HP-β-CD; penicillinase; molecular docking
2013-11-28.
国家自然科学基金项目(31370379).
1000-1190(2014)04-0532-06
O629.12
A
*通讯联系人. E-mail: songfajun@mail.scuec.edu.cn.

