印度3种畅销植物药的开发利用
姚霞,肖伟,何春年,彭勇,肖培根*
(1.中国药材公司,北京 100195;2.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193)
健康产业
印度3种畅销植物药的开发利用
姚霞1,肖伟2,何春年2,彭勇2,肖培根2*
(1.中国药材公司,北京 100195;2.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193)
印度阿育吠陀传统医药体系历史悠久,博大精深,植物药在阿育吠陀医药理论中占有重要地位,印度药用植物约有7 263种,常用约960种。本文从资源分布、传统应用、化学成分和药理作用等方面对3种具有开发前景的印度畅销植物药——长叶紫荆木、兰桑山檨子及白背黄花稔进行介绍,为相关新药研发、中国亲缘相近的药用植物的开发利用、扩大中国药用植物资源及引种新资源提供参考。
印度;植物药;传统应用;长叶紫荆木;兰桑山檨子;白背黄花稔
印度是传统医药大国之一,印度阿育吠陀(Ayurveda)传统医药体系可以追溯到公元前5000年的吠陀时代,被认为是世界上最古老的医学体系。植物药在阿育吠陀医药理论中占有重要地位,印度药用植物约有7 263种,常用约960种[1]。印度当地消费量较大(年消费量大于5 000 t)的常用植物药有6种:余甘子EmblicaofficinalisGaertn.、长叶紫荆木MadhucaindicaGmel.、兰桑山檨子BuchananialanzanSpr.、诃子TerminaliachebulaRetz.、小决明CassiatoraL.及白背黄花稔SidarhombifoliaL.。其中余甘子、诃子、小决明3种在中国有分布,应用也很广泛,在2010版《中国药典》均有收录[2]。另外3种印度植物药——长叶紫荆木、兰桑山檨子及白背黄花稔中国无分布或使用较少,但具有很好的开发前景,在此对其资源分布、传统应用、化学成分和药理作用分别进行介绍,以便为相关新药研发、中国亲缘相近的药用植物的开发利用、扩大中国药用植物资源及引种新资源提供参考。
1 长叶紫荆木
长叶紫荆木MadhucaindicaGmel.[BassialatifoliaRoxb.;MadhucalatifoliaMacb.] 山榄科Sapotaceae紫荆木属Madhuca植物,印度称“Mahua”。分布于印度半岛的北部、中部和南部,斯里兰卡和缅甸。印度传统药用部位:花、树皮、种子。印度阿育吠陀传统医药理论认为Mahua是万能灵药[3],其花具有滋补镇痛、祛痰、驱风作用,可用于感冒、咳嗽、支气管炎、烧伤、心脏、胆及耳朵疾患的治疗;干花经油煎后食用可缓解痔疮症状;鲜花汁擦涂可以治疗皮肤疾病,也作滴鼻剂治疗鼻窦炎;鲜花亦可食用。果实具有收敛止血功效,果实汁液可用于慢性溃疡、急慢性扁桃体炎和咽炎的治疗。种子具有催奶功效。种子油具有润肤、催吐和泻下作用,可用于皮肤病、风湿病、头痛、习惯性便秘及痔疮的治疗;种子油亦可食用。树皮具有收敛止痒、止血、滋补、促进伤口愈合的作用,可用于发热、慢性扁桃体炎、糖尿病、麻风病的治疗[4-5]。
1.1 长叶紫荆木的化学成分
长叶紫荆木的种子、种子油、果实、花、树皮、根皮的化学成分均有系统研究,该草药主要含有三萜及皂苷类、甾醇类、黄酮类、有机酸类化合物。
三萜及皂苷类:羽扇豆醇(lupeol)、熊果酸(ursolic acid)、齐墩果酸(oleanolic acid)、桦木醇(betulin)[3]、桦木酸(betulinic acid)、高根二醇(erythrodiol)、3β-辛酰-齐墩果酸-12-烯-28-醇(3β-caproxy-olean-12-en-28-ol)、3β-棕榈酰-齐墩果酸-12-烯-28-醇(3β-palmitoxy-olean-12-en-28-ol)、3β-caproxyolcan-12-en-28-ol、齐墩果酸(oleanolic acid)[3][6]、madhucic acid(3β-capryloxy-11-oxo-olean-12-en-28-oic acid)、2β,3β,23-三羟基乌苏-5,12,20-三烯-28-酸(madhunolic acid)、2β,3β,23-三羟基乌苏-5,12,20-三烯-28-酸乙酰酯(acetylation of madhunolic acid)[7]、醋酸羽扇豆醇酯(lupeolacetate)、α-香树脂醇(α-amyrin)、β-香树脂醇(β-amyrin)、α及β-香树脂醇乙酸酯(α-andβ-amyrin acetates)、β-香树脂醇肉桂酸酯(β-amyrin cinnamate)、β-香树脂醇癸酸酯(β-amyrin decanoate)、β-香树脂醇-3β-辛酸酯(β-amyrin-3β-carylate)、β-香树脂(β-amyrinone)、木栓酮(friedelin)、常春藤苷元(hederagenin),异乔木萜醇(isoarborinol)、熊果酸-3β-辛酸酯(ursolic acid-3β-caprylate)、高根二醇-3β-辛酸酯(erythrodiol-3β-decanoate)、正己基-3-乙酰基-桦木酸酯(n-hexyl-3-acetyl-betulinic acid easter)、桦木酸-3β-辛酸酯(betulinic acid-3β-caprylate)、21-羟基-3-齐墩果烷-肉豆蔻酸酯(21-hydroxy-3-olean-myristate)、齐墩果酸棕榈酸酯(oleanolic acid palmitate)、齐墩果酸-3β-辛酸酯(oleanolic acid-3β-caprylate)[3][8]、椴树酸(bassic acid)、2β,3β,6β,23-四羟基-12-齐墩果烯-28-酸(原椴树酸;protobassic acid)、椴树酸-2,3-二-O-吡喃葡萄糖苷(bassic acid-2,3-di-O-glucopyranoside)、吡喃鼠李糖基-(1→4)-吡喃木糖基-(1→2)-吡喃阿拉伯糖-(1→OOC)(28)-2,3-椴树酸-二-O-吡喃葡萄糖苷(bassic acid-rhamnopyranosyl-1→4-xylopyranosyl-1→2-arabopyranosyl-1→OOC(28)-2,3-di-O-glucopyranoside]、3-O-β-D-吡喃葡萄糖-原椴树酸(3-O-β-D-glucopyranosyl-protobassic acid)、枪弹木皂苷(mimusopside)、Madlongiside A-D[8-9]、3-O-β-D-呋喃芹糖基-(1→2)-β-D-吡喃葡萄糖基-28-O-[β-D-吡喃木糖基-(1→2)-[α-L-吡喃鼠李糖基-(1→4)]-β-D-吡喃葡萄糖基-(1→3)-α-L-吡喃鼠李糖基-(1→2)-α-L-吡喃阿拉伯糖基]-原椴树酸(Madhucosides A)、3-O-β-D-呋喃芹糖基-(1→2)-β-D-吡喃葡萄糖基-28-O-[β-D-吡喃木糖基(1→2)-[α-L-吡喃鼠李糖基-(1→4)]-β-D-吡喃葡萄糖基-(1→3)-α-L-吡喃鼠李糖基-(1→2)-α-L-吡喃阿拉伯糖基]-原椴树酸(Madhucosides B)[10]、6-O-(3,4,5-三羟基苯甲酰)-熊果苷[6-O-(3,4,5-trohydroxybenzoyl)-arbutin]、4′-O-(3,4,5-三羟基苯甲酰)-熊果苷[4′-O-(3,4,5-trohydroxybenzoyl)-arbutin]、6-O-[4-O-(β-D-吡喃葡萄糖基)-苯甲酰]-熊果苷(madhuglucoside)、6-O-(4-羟基苯甲酰基)-熊果苷[6-O-(4-hydroxybenzoyl)arbutin]、Mi-saponin A、Mi-saponin B、3-O-β-D-吡喃葡萄糖基-28-O-[3-O-α-L-吡喃鼠李糖-4-O-β-D-吡喃葡萄糖-β-D-吡喃木糖基-(1→4)-α-L-吡喃鼠李糖基-(1→2)]-α-L-吡喃阿拉伯糖基]-原椴树酸(Mi-saponin C)[11]等。皂苷类化合物主要存在于长叶紫荆木的种子、果实、根皮或树皮中,长叶紫荆木中部分皂苷类化合物结构见图1。

图1 长叶紫荆木中部分皂苷类化合物结构图
甾醇及其衍生物:β-谷甾醇(β-sitosterol)、豆甾醇(stigmasterol)、菜油甾醇(campesterol)、α-菠菜固醇(α-spinasterol)、α-菠菜固醇葡萄糖苷(α-spinasterol-β-D-glucoside)、燕麦甾醇(avenasterol)[7]、胡萝卜苷(daucosterol)、豆甾醇葡萄糖苷(stigmasterol-β-D-glucoside)[3][8][12]。此类化合物主要存在于长叶紫荆木的果实、种子油中。
黄酮类:槲皮素(quercetin)、槲皮素-3-半乳糖苷(quercetin-3-galactoside)、二氢槲皮素(dihydroquercetin)、3′,4′-二羟基-5,2′-二甲氧基-6,7-亚甲二氧基-异黄酮(3′,4′-dihydroxy-5,2′-dimethoxy-6,7-methylendioxy)、杨梅黄素(myricetin)、杨梅黄素-3-O-鼠李糖苷(myricetin-3-O-L-rhamnoside)、杨梅黄素3-O-阿拉伯糖苷(myricetin-3-O-L-arabinoside)、madhushazone(5,2′,3′,6′-tetramethoxy-6,7-methylenedioxy isoflavone)、madhusalmone[5,5″,3′,3‴,4′,4‴,5′,5‴-Octamethoxy-(6→7″)(7→6″)-bis(methylenedioxy)isoflavone]、3′ 4′-dihydroxy-5,2′-dimethoxy-6,7-methylendioxy isoflavone[3][6][8][13-14]。黄酮类化合物主要存在于长叶紫荆木的果实、叶子中。
芳香酸类:苹果酸(malic acid)、琥珀酸(succinic acid)、4-羟甲基苯甲酸(4-hydroxymethyl benzoate)、没食子酸(gallic acid)、表儿茶酸(epicatechin)、阿魏酸(ferulic acid)[7]。此类化合物主要存在于长叶紫荆木的花、种子中。
脂肪酸类:油酸(oleic acid)、亚油酸(linoleic acid)、棕榈酸(palmitic acid)、硬脂酸(stearic acid)等[8][15]。此类化合物主要存在于长叶紫荆木的种子中。
其他成分:对羟基苯乙酮(p-hydroxyacetophenone),4-O-β-D-葡萄糖基-苯乙酮(4-O-β-D-glucosyl-acetophenone)、对苯二酚(hydroquinone)、β-胡萝卜素(β-carotene)、叶黄素(xanthophylls)、正二十六烷醇(n-hexacosanol)、正二十八烷醇(n-octacosanol)、二十九碳烷(nonacosane)[8]、糠醛(furfural)[3][6]、2-乙酰基-1-吡咯啉(2-acetyl-1-pyrroline)、甜菜碱(betaine)[7]、角鲨烯(squalene)、甘油三酯、甘油单酯、色素及营养成分:包括糖类、维生素、酶类、氨基酸、微量元素、粗纤维、蛋白质等[4][8][13][16-18]。
1.2 长叶紫荆木的药理作用
长叶紫荆木的现代药理研究表明其具有抗菌、降糖、抗氧化、抗肿瘤、杀虫等活性,其中降糖和抗肿瘤作用值得进一步深入研究。
抗菌作用:根皮的石油醚脱脂后的乙醇提取物其对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌和铜绿假单胞菌具有很强的抗菌作用,最大抑菌圈分别是20.6 mm、18.3 mm、16.6 mm、15.6 mm[5]。根皮提取物对CCl4所致肝损伤具有显著保护作用[22]。
降糖作用:树皮的甲醇提取物降糖作用强于格列苯脲,可开发治疗糖尿病药物;叶乙醇提取物也具有一定的降糖作用;该植物根皮提取物也具有抗糖尿病作用,且水提取物的作用大于乙醇提取物[3][13]。
抗氧化作用:Mahua树皮和叶的乙醇提取物均具有很强的自由基清除及抗氧化作用[3][5]。Madhucosides A和 Madhucosides B具抑制巨噬细胞释放自由基的活性[10]。
抗肿瘤作用:Mahua甲醇提取物对人乳腺癌细胞株MDA-MB-231,MDA-MB-435及MDA-N具有抑制作用,可用于抗肿瘤;叶乙醇提取物抗肿瘤作用与抗癌药物5-氟尿嘧啶相当,是一个有潜力的抗肿瘤药[23]。
杀虫作用:Mahua种子中三萜皂苷类化合物,对两种植物寄生的线虫:肾形线虫(Rotylenchulusreniformis)和根结线虫(Meloidogyneincognita)具有很强的抑制作用,可作为植物源性农药应用[20]。
其他药理作用:Mahua花、叶、茎和茎皮具有抗菌活性;粗皂苷具有显著的抗炎活性;地上部分的甲醇粗提物具有退热作用[3];种子中所含的Mi-saponin A具有很强的杀精作用[11];树皮乙醇提取物具有促使伤口愈合和恢复作用[3];种子油可以作为生物燃油替代品应用[21]。
2 兰桑山檨子
兰桑山檨子BuchananialanzanSpr. 漆树科Anacardiaceae山檨子属Buchanania植物,印度称“Chironji”。分布于热带亚洲(印度——马来西亚):印度、斯里兰卡、缅甸、泰国、中南半岛、印度尼西亚、加里曼丹、加里曼丹、菲律宾及新几内亚等地。印度传统药用部位:果实(种子)、叶、树皮和地上部分,以果实(种子)为主。阿育吠陀传统医药理论中,兰桑山檨子的树皮用于毒蛇咬伤;种子糊用于皮肤病;树胶用于治疗痢疾、腹泻和肋间疼痛;果仁制成的膏剂有止痒功效,可治疗痱子;叶子可促进伤口愈合;地上部分可抗癌、增强呼吸和心血管系统功能[24]。
2.1 兰桑山檨子的化学成分
兰桑山檨子的化学成分研究不多,仅叶、果实、种子油有少量研究,其他部位及该草药的整体化学成分有待深入系统研究。
黄酮类:杨梅素-3′-鼠李糖-3-半乳糖苷(myricetin-3′-rhamnoside-3-galactoside)、山柰酚(kaempferol)、山柰酚-7-O-葡萄糖苷(kaempferol-7-O-glucoside)、槲皮素(quercetin)、槲皮素-7-O-鼠李糖苷(quercetin-7-O-rhamnoside)、槲皮素-3-O-芸香糖苷(quercetin-3-O-rhamnoglucoside)等[24-27]。 此类化合物主要存在于兰桑山檨子的叶子中。
酯类:兰桑山檨子的果仁中含有甘油三酯(triacylglycerols)、甘油二酯(diacylglycerols)、单酰甘油(monoacylglycerols)、单半乳糖二酰甘油酯(acylmonogalactosyl diacylglycerol)、磷脂酰甘油(phosphatidylglycerol)、二半乳糖二酰基丙三醇(digalactosyldiacylglycerol)、磷酸肌醇(phosphatid-ylinositol)、磷脂酰乙醇胺(phosphatidylethanola-mine)、磷脂酰胆碱(phosphatidylcholine)、溶血磷脂酰乙醇胺(lysophosphatidylethanolamine)、溶血磷脂胆碱(lysophosphatidylcholine)、乙酰豆甾醇糖苷(acylatedsterylglucoside)、糖脂(glycolipids)类、磷脂(phospholipids)类成分[28]。
脂肪酸类:肉豆蔻酸(myristic acid)、棕榈酸(palmitic acid)、硬脂酸(stearicaicd)、棕榈油酸(palmitoleic acid)、亚油酸(linoleic acid)[29]。此类化合物主要存在于兰桑山檨子的果仁、种子油中。
其他成分:兰桑山檨子中还含有没食子酸(gallic acid)、腰果酚(cardanol)、强心酚(cardol)、槚如酸(anacardic acid)[25]、松醇(pinitol)、白屈菜醇(celidoniol)、番木鳖次碱(vomicine)、β-香树脂醇(β-amyrin)等成分[29],兰桑山檨子中部分化合物结构见图2。
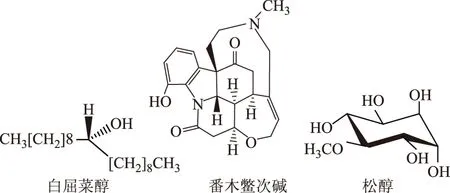
图2 兰桑山檨子部分化合物结构图
2.2 兰桑山檨子的药理作用
研究表明兰桑山檨子的茎皮乙醇提取物具有强抗氧化活性[30],其种子油可以缓解颈部肿胀[24],叶子甲醇提取物有显著的抗压力作用[31]。根乙醇提取物可以预防和治疗胃溃疡,并呈剂量相关性[32]。根茎乙醇提取物可以促进伤口愈合[33]。该草药的抗氧化及促进伤口愈合作用值得进一步深入研究。
3 白背黄花稔
白背黄花稔SidarhombifoliaL. 锦葵科Malvaceae黄花稔属Sida植物,印度称“Bala”,印度草药市场上同属植物黄花稔Sidaacuta、心叶黄花稔Sidacordifolia、长梗黄花稔Sidacordata的根或全草也都作为“Bala”交易。分布于中南半岛、印度、斯里兰卡、越南、老挝、柬埔寨和中国等地;中国产台湾、福建、广东、广西、贵州、云南、四川和湖北等省区。印度传统药用部位:根和叶。阿育吠陀传统医药理论认为白背黄花稔的根和叶具有健胃、镇痛、发汗、利尿、滋补的功效;叶子可用于改善发烧、心脏疾患、痔疮、及关节炎症;茎和根有助于治疗关节炎、哮喘、肺结核、性功能障碍等症[35-36]。中国传统药用部位是全草,中医理论认为其有消炎解毒、祛风除湿、止痛之功效[34]。
3.1 白背黄花稔的化学成分
白背黄花稔化学成分研究主要集中在全草、地上部分及种子油,但其根和叶的研究不多,鉴于印度传统药用部位为根及叶,有必要对白背黄花稔根和叶的化学成分进行系统研究,搞清其发挥功用的物质基础。
甾类:从白背黄花稔的全草中得到β-谷甾醇(β-sitosterol)、谷甾醇-3-O-β-D-吡喃葡萄糖苷(sitosterol-3-O-β-D-glucopyranoside)、豆甾醇(stigmasterol)、豆甾醇-3-O-β-D-吡喃葡萄糖苷(stigmasterol-3-O-β-D-glucopyranoside)、胡萝卜苷(daucosterol)[41-42]、20-羟基蜕皮激素-3-O-β-D-吡喃葡萄糖苷(20-hydroxyecdysone-3-O-β-D-glucopyranoside)、20-羟基蜕皮激素(20-hydroxyecdysone),2-脱羟-20-羟基蜕皮激素-3-O-β-D-吡喃葡萄糖苷(2-deoxy-20-hydroxyecdysone-3-O-β-D-glucopyranoside)、孕甾酮-3-O-β-D-吡喃葡萄糖苷(pterosterone-3-O-β-D-glucopyranoside)、蜕皮激素-3-O-β-D-吡喃葡萄糖苷(ecdysone-3-O-β-D-glucopyranoside)、蜕皮激素(ecdysone)、20-羟基-25-乙酰基-蜕皮激素-3-O-β-D-吡喃葡萄糖苷(20-hydroxy-(25-acetyl)-ecdysone-3-O-β-D-glucopyranoside)等甾醇类化合物[36-38]。
黄酮类:从白背黄花稔的地上部分分离得到山柰酚(kaempferol )、5-羟基-7,4′-二甲氧基二氢黄酮(5-hydroxy-7,4′-dimethoxyflavanone)、5,7-二羟基-7-甲氧基黄酮(5,7-dihydroxy-4′-methoxyflavone)、3-O-β-D-葡萄糖-(6-O-对羟基反式香豆酰基)-山柰酚苷(tiliroside)等黄酮类化合物[41-42]。
有机酸及其衍生物:间-羟基苯甲酸(m-hydroxybenzoic acid )、丁香酸(syringic acid)、没食子酸(gallic acid)、苹婆酸(sterculic acid)、锦葵酸(malvalic acid)、棕榈酸(palmitic acid)、棕榈酸1-甘油酯(glyceroyl monopalmitate)[41-44]。此类化合物主要存在于白背黄花稔的地上部分、种子、种子油中。
其他成分:白背黄花稔的地上部分含有卟啉类化合物:phaeophytin A,173-ethoxypheophorbide A,132-hydroxyphaeophytin B,173-ethoxypheophorbide B[42];白背黄花稔的根和地上部分中含有胆碱(choline)、甜菜碱(betaine)、刺桐碱(erythrine)、白叶藤碱盐(salt of cryptolepine)、cryptolepinone、β-苯乙胺类、喹诺里西啶类、羧化色胺类、吲哚类等生物碱类化合物及东莨菪内酯(scopoletin)[39-42]等成分,白背黄花稔中部分化合物结构见图3。
3.2 白背黄花稔的药理作用
白背黄花稔的现代药理研究表明其具有杀虫、抗氧化、抗菌、清除胆红素、抗肿瘤、抑制酪氨酸单酚酶等作用。其抗氧化、抗肿瘤及抑制酪氨酸单酚酶活性值得深入研究。
杀虫作用:白背黄花稔甲醇提取物对柑桔粉虱DialeurodescitriAshmead 具良好触杀活性[45]。化合物棕榈酸1-甘油酯(glyceroyl monopalmitate)对白纹伊蚊4幼龄虫具有较好的杀虫活性,24 h和8 h的IC50值分别是28.66和13.50 μg·mL-1[41]。叶中总生物碱具有抗阿米巴作用,其MAC值小于5 μg·mL-1[46]。
抗氧化作用:白背黄花稔根、茎、叶、全草均具有清除自由基、抗氧化活性,其中根的抗氧化活性最强[47]。地上部分具有良好的自由基清除活性,且甲醇提取物作用强于水提取物[48]。
抗菌作用:白背黄花稔叶乙酸乙酯提取部位具有细胞毒性,与对照品没食子酸比较,其LC50值是5.41 ppm。叶子石油醚、氯仿、乙酸乙酯萃取部位及萃取后水部位在200 μg·disc-1浓度时对革兰氏阳性菌和阴性菌均有抗菌作用,且乙酸乙酯部位>氯仿部位>石油醚部位>萃取后水部位[40]。
清除胆红素作用:白背黄花稔水提取物50 mg·kg-1浓度时,口服3天即能显著降低高胆红素症大鼠血清的胆红素水平(2.37±0.30 mg·dL-1~ 0.89±0.08 mg·dL-1),提示白背黄花稔水提取物具有清除胆红素作用,可开发为治疗高胆红素症及黄疸病的药物[51]。
其他药理作用:白背黄花稔茎和叶的总黄酮提取物体外可抑制黄嘌呤氧化酶(XO)的活性,LC50值是501 mg·L-1,抑制率是48~71%(100~800 mg·L-1),提示其可用于治疗痛风[49]。叶对人白血病细胞株-60(HL-60)具有细胞毒活性,提示该植物具有抗肿瘤作用[23]。地上部分甲醇提取物在200 mg·kg-1时显示显著的降血糖作用(P<0.01)[48]。地上部分乙醇和水提取部位可明显改善关节炎的症状,提示其可用于治疗关节炎[50]。白背黄花稔具抑制酪氨酸单酚酶作用,抑制率达90%以上,可应用于食品化妆品工业[52]。
4 长叶紫荆木、兰桑山檨子、白背黄花稔3种植物药的开发利用
上述3种植物药具有多种传统药用价值,在印度广泛使用,现代化学和药理研究也为其药用物质基础及作用机理提供了一定的科学依据。
长叶紫荆木在中国无分布,该植物药种子中的三萜皂苷类化合物具有多种药理活性,值得关注;其降糖作用非常明显,对其深入研究,明确其作用机理及活性部位或活性化合物,有助于开发降糖类天然药物;长叶紫荆木在抗肿瘤方面也具有很大潜力。中国紫荆木属Madhuca植物有2种(见表1),但主要是种子油食用、木材和化工方面的应用[52]。可以考虑将长叶紫荆木作为新资源引种,并对中国紫荆木属植物作为药用资源进一步开发利用。
兰桑山檨子在中国没有分布,在印度几乎全树都有传统药用历史,果实(种子)、叶、树皮和地上部分均可药用,具有促进伤口愈合、治疗溃疡、抗癌等药理作用。中国山檨子属Buchanania植物有4种(见表2),几乎没有药用历史[53]。该草药的现代研究不是很多,亟待深入研发,充分发挥其药用价值;也可考虑将中国山檨子属植物作为药用资源的进一步开发利用,或引种兰桑山檨子,丰富中国药用植物资源。

表1 中国紫荆木属植物资源概况

表2 中国山檨子属植物资源概况
白背黄花稔在中国有分布,印度与中国药用传统药用价值相近。该植物药具有很强的清除胆红素及细胞毒活性,有必要搞清其发挥作用的物质基础,进一步开发治疗高胆红素症、黄疸病及抗肿瘤的新药;白背黄花稔全草还具有抗氧化及抑制酪氨酸单酚酶作用,可考虑功能性食品、保健品及化妆品的开发。中国黄花稔属Sida植物有13种(见表3),资源丰富,其中2种有传统药用历史[53]:白背黄花稔全草入药,有消炎解毒、祛风除湿、止痛之功用;榛叶黄花稔全草入药有抗菌消炎之功用。该属其他11种植物也可尝试作为药用资源开发研究。

表3 中国黄花稔属植物资源概况
[1] Ved D K,Goraya G S.Demand and supply of medicinal plants in India[M].National Medicinal Plants Board,Department of AYUSH & The Foundation for Revitalisation of Local Health Traditions,India.2008.
[2] 国家药典委员会.中国药典[S].一部.北京:中国医药科技出版社.2010:135,167,173.
[3] Akshatha K N,Mahadeva S,Lakshmidevi N.Ethnomedical uses of Madhuca longifolia-a review[J].International Journal of Life Science & Pharma Research,2013,3(1):44-53.
[4] Patel M; Naik S N.Flowers ofMadhucaindicaJ.F.Gmel.:present status and future perspectives[J].Indian Journal of Natural Products and Resources.2010,1(4):438-443.
[5] Kaushik P,Kaushik D,Khokra S L,et al.Evaluation of antioxidant and antimicrobial activity ofmadhucaindica[J].Pharmacologyonline,2010,2:1-8.
[6] Sattar M A,Chakraborty A K,Al-Reza S M,et al.Shaharul Islam Extraction and Estimation of furfural from Decorative Plants Grown in Bangladesh[J].J Sci Ind Res,2007,42(4),495-498.
[7] Siddiqui B S,Khan S,Kardar M N,et al.A new triterpenoid,madhunolic acid,from the seeds ofMadhucalatifolia[J].J Asian Nat Prod Res,2007,9(3-5):293-297.
[8] Shazia K.Studies on the chemical constituents of the fruits of Madhuca indica(Mahua).H.E.J.Research institute of Chemstry International Center for Chemical and Biological Sciences.University of Karachi[D].2008.
[9] Khan S,Kardar M N,Siddiqui B S.Arbutin derivatives from the seeds ofMadhucalatifolia[J].Nat Prod Commun,2011,6(11):1661-1664.
[10] Pawar R S,Bhutani K K.Madhucosides A and B,protobassic acid glycosides fromMadhucaindicawith inhibitory activity on free radical release from phagocytes[J].J Nat Prod,2004,67(4):668-671.
[11] Saha P,Majumdar S,Pal D,et al.Evaluation of spermicidal activity of MI-saponin A[J].Reprod Sci. 2010,17(5):454-464.
[12] Rupali D,Dipak K B,Mahua G.Analysis of Sterol and Other Components Present in Unsaponifiable Matters of Mahua,Sal and Mango Kernel Oil[J].Journal of Oleo Science,2010,59(4):169-176.
[13] Ganapaty S,Nandeesh R,Veerapur V P,et al.Invivo and Invitro Anti-Diabetic Effects of Madhuca indica Roxb.,in Alloxan-Induced Diabetic rats[J].International Journal of advances in pharmacy,biology and chemistry,2013,2(2):282-290.
[14] Siddiqui B S,Khan S,Nadeem K M.A new isoflavone from the fruits ofMadhucalatifolia.Nat Prod Res.2010,24(1):76-80.
[15] Singh A; Singh I S.Chemical evaluation of mahua(Madhucaindica)seed[J].Food Chemistry,1991,40(2):221-228.
[16] Dhara R,Bhattacharyya D K,Ghosh M.Analysis of sterol and other components present in unsaponifiable matters of mahua,sal and mango kernel oil[J].J Oleo Sci,2010,59(4):169-176.
[17] Wakte K V,Kad T D,Zanan R L,et al.Mechanism of 2-acetyl-1-pyrroline biosynthesis in Bassia latifolia Roxb.Flowers[J].Physiol Mol Biol Plants,2011,17(3):231-237.
[18] Neha S,Rekha V.Comparative study of primary metabolites in different plant parts ofClitoriaternatea(L.),Guazumaulmifolia(Lam.)&Madhucaindica(Gmel.)[J].J Chem Pharm Res,2010,2(2):168-171.
[19] Neha S,Rekha V.Investigation of Anti-Inflammatory,Analgesic and Antipyretic Properties of Madhuca indica GMEL[J].International Journal of Molecular Medicine and Advance Sciences,2010,6(2):26-30.
[20] Saha S,Walia S,Kumar J,et al.Synergistic/potentiation interaction between nematostatic constituents fromAzadirachtaindica,MadhucaindicaandSapindusmukorossi[J].Archives of Phytopathology and Plant Protection,2010,43(4),357-367.
[21] Puhan S,Nagarajan G,Vedaraman N,et al.Mahua oil(madhucaindicaoil)derivatives as a renewable fuel for diesel engine systems in India:a performance and emissions comparative study[J].International Journal of Green Energy,2007,4(1):89-104.
[22] Anu Chaudhary,Anil Bhandari,Pandurangan A.Hepatoprotective activity of methanol extracts of Madhuca indica on carbon tetrachloride-induced hepatotoxicity in rats[J].Pharmacologyonline,2011,1:873-880.
[23] Muanza D N,Euler K L.Williams L,et al.Screening for antitumor and anti-HIV activities of nine medicinal plants from Zaire J[J].International Journal of Pharmacognosy,1995,33(2):98-106.
[24] Mehta S K,Mukherjee S,Jaiprakash B.Preliminary phytochemical investigation on leaves ofBuchananialanzan(Chironji)[J].International Journal of Pharmaceutical Sciences Review and Research,2010,3(2):55-59.
[25] Mehta S K,Jaiprakash B,Nayeem N.Isolation & phytochemical investigation on leaves ofBuchananialanzan(Chironji)[J].Annals of Biological Research,2011,2(3):469-473.
[26] Nasim K T,Arya R,Babu V,et al.Myricetin 3′-rhamnoside-3-galactoside fromBuchananialanzan(anacardiaceae)[J].Phytochemistry,1992,31(7):2569-2570.
[27] Arya R,Babu V,Ilyas M,et al.Flavonoids from the leaves ofBuchananialanzan(Anacardiaceae)[J].Journal of the Indian Chemical Society,1988,65(12):882-883.
[28] Hemavathy J,Prabhakar J V.Lipid composition of chironji(Buchananialanzan)kernel[J].Journal of Food Composition and Analysis,1988,1(4):366-370.
[29] Banerjee A,Jain M.Investigations on Buchananialanzan seed oil[J].Fitoterapia,1988,59(5):406.
[30] Jain R,Jain S K.Total phenolic contents and antioxidant activities of some selected anticancer medicinal plants from Chhattisgarh State,India[J].Pharmacologyonline,2011,(2):755-762.
[31] Mehta S K,Nayeem N, Bains N.Adaptogenic activity of methanolic extract of Buchanania lanzan leaves an experimental study in rat model[J].Pharmacia Sinica.2011,2(3):107-112.
[32] Kodati D,Pareta S K,Patnaik A.Antidiarrhoeal activity of alcoholic extract of Buchanania lanzan Spreg.Roots[J].Pharmacologyonline,2010,(3):720-726.
[33] Chitra V,Dharani P P,Pavan K K,et al.Wound healing activity of alcoholic extract of Buchananialanzan in Albino rats[J].International Journal of ChemTech Research,2009,1(4):1026-1031.
[34] 中国科学院中国植物志编辑委员会.中国植物志:第49卷[M].北京:科学出版社,2004:20-21.
[35] Logeswari P,Dineshkumar V,Pratha P,et al.In Vivo anti-inflammatory effect of aqueous and ethanolic extract ofSidarhombifoliaL.[J].International Journal of Pharmaceutical Sciences and Research,2013,4(1):316-321.
[36] Wang Y H,Avula B,Atul N,et al.Structural characterization and identification of ecdysteroids fromSidarhombifoliaL.in positive electrospray ionization by tandem mass spectrometry[J].Rapid Commun.Mass Spectrom.,2008,22:2413-2422.
[37] Jadhav A N,Pawar R S,Avula B,et al.Ecdysteroid glycosides from Sida rhombifolia L.[J].Chem Biodivers,2007,4(9):2225-2230.
[38] Bharathi A,Vaishali J,Wang Y H,et al.Quantitative determination of ecdysteroids inSidarhombifoliaL.and various other Sida species using LC-UV,and their anatomical characterization.Natural Product Communications, 2008,3(5):705-710.
[39] Prakash R K,Varma S.Ghosal Alkaloid Constituents ofSidaacuta,S.humilis,S.rhombifoliaandS.spinosa[J].Planta Med.1981,43(12):384-388.
[40] Islam M E,Haque M E,Mosaddik M A.Cytotoxicity and antibacterial activity ofSidarhombifolia(Malvaceae)grown in Bangladesh[J].Phytother Res. 2003,17(8):973-975.
[41] 陈维权,张恒,徐汉虹.白背黄花稔Sidarhombifolia的生物活性及化学成分研究[J].农药学学报.2012,14(4):377-382.
[42] Chaves O S,Gomes R A,Tomaz AC,et al.Secondary metabolites from Sida rhombifolia L.(Malvaceae)and the vasorelaxant activity of cryptolepinone[J].Molecules,2013,18(3):2769-2777.
[43] Oliveira S,Ana C,Morais O,Antonio F,et al.An approach to chemotaxonomy to the fatty acid content of some Malvaceae species[J].Biochemical Systematics and Ecology,2010,38(5):1035-1038.
[44] Ahmad M U,Husain S K,Ahmad M,et al.Cyclopropenoid fatty acids in seed oils ofSidaacutaandSidarhombifolia(malvaceae)[J].Journal of the American Oil Chemists’ Society,1976,53(11):698-699.
[45] 李丽芬.柑桔粉虱防治药剂研究[D].桂林:广西师范大学,2010.
[46] Tona G L,Cimanga R K,Kambu O K,et al.Phytochemical screening and in vitro antiamoebic activity of extracts from some antidiarrhoeal medicinal plants used in Kinshasa,Democratic Republic of Congo[J].Recent Progress in Medicinal Plants,2009,25,209-224.
[47] Kamlesh D,Yogesh S D,Ajit PP.Evaluation of In Vitro Antioxidant Activity ofSidarhombifolia(L.)Ssp.retusa(L.)[J].J Med Food,2007,10(4):683-688.
[48] Ghosh G,Subudhi B B,Mishra S K,Antihyperglycemic activity of root bark of Polyalthia longifolia var.pendula and aerial parts of Sida rhombifolia Linn.and its relationshi Pwith antioxidant property[J].Asian Journal of Chemistry,2011,23(1):141-144.
[49] Iswantini D,Darusman L K,Hidayat R.Indonesian Sidaguri(SidarhombifoliaL.)as Antigout and Inhibition Kinetics of Flavonoids Crude Extract on the Activity of Xanthine Oxidase[J].Journal of Biological Sciences,2009,9(5):504-508.
[50] Gupta S R,Nirmal S A,Patil R Y,et al.Anti-arthritic activity of various extracts ofSidarhombifoliaaerial parts[J].Natural Product Research,2009,23(8):689-695.
[51] Faizah M F,Habsah A K,Saad T.Bilirubin Clearance in Temporarily Hyperbilirubinemic Rats Treated with Aqueous Extract ofSidarhombifolia[J].Life Science Journal,2012,9(3):2254-2256.
[52] Chiari M E,Joray M B,Ruiz G,et al.Tyrosinase inhibitory activity of native plants from central Argentina:Isolation of an active principle from Lithrea molleoides[J].Food Chemistry,2010,120(1):10-14.
[53] http://frps.eflora.cn/
Introduction of 3 Indian Medicinal Herbs with Good Developing Prospect
YAO Xia1,XIAO Wei2,HE Chunnian2,PENG Yong2,XIAO Peigen2*
(1.ChinaNatioanlCorp.ofTraditional&HerbalMedicine,Beijing100195,China;2.InstituteofMedicinalPlantDevelopment,ChineseAcademyofMedicalSciencesandPekingUnionMedicalCollege,Beijing100193,China)
India Ayurvedic traditional medicine system has centuries-old history,it is broad and profound,medicinal plants use in India Ayurvedic system is meaningful to China.There are 7 263 medicinal plants in India,and 960 of them are commonly used.The current paper introduces 3 bestseller India medicinal plants:MadhucaindicaGmel.,BuchananialanzanSpr.andSidarhombifoliaL.from their resources,traditional uses,chemical compounds and pharmacology study.This work provides evidence for developing new drug,introducing new resources or fully utilizing the related medicinal plants in China.
India; Medicinal plants; Traditional uses;MadhucaindicaGmel.;BuchananialanzanSpr.;SidarhombifoliaL.
*[通讯作者] 肖培根,院士,博士生导师,研究方向:中药资源与药用植物亲缘学,Tel:(010)62894462;E-mail:xiaopg@public.bta.net.cn
10.13313/j.issn.1673-4890.2014.01.018
2013-12-03)

