逍遥散干预肝损伤小鼠的代谢组学研究
张 宁,杨祎楠,刘海洋,王业秋,李建民,耿 放
(1.黑龙江中医药大学,黑龙江哈尔滨 150040;2.哈尔滨师范大学,黑龙江哈尔滨 150025)
逍遥散出自《太平惠民和剂局方》,功效为疏肝解郁、健脾和营,是调和肝脾的经典方,临床上广泛用于肝损伤的治疗。肝损伤是临床常见的危害人类健康的疾病。代谢组学方法是从系统生物学角度研究相对分子质量1000以下的内源性小分子 (氨基酸、有机酸、糖类及脂肪酸等)受到外界干扰或扰动后的变化情况[1]。气相色谱-质谱 (GCMS)具有高灵敏度、分离效果好及代谢物易于鉴定等优点,是近年来代谢组学主要的研究手段[2]。为了全面揭示逍遥散保肝、护肝的作用,本研究不仅检测常用的各种血清酶指标,而且还借助代谢组学的方法,利用GC-MS分析小鼠肝组织匀浆及血清的代谢物谱,寻找潜在标记物。为临床应用逍遥散治疗肝损伤提供理论依据。
1 实验材料及仪器
1.1 动物 雄性昆明种小鼠42只,体质量 (18~25)g,购自黑龙江中医药大学GLP实验室 (实验动物生产许可证号:SCXK(黑)2008-004)。
1.2 药物及制备 处方饮片均购自北京同仁堂制药集团哈尔滨药店,经黑龙江中医药大学陈孝忠副教授鉴定。遵照《太平惠民和剂局方》原文,逍遥散的制备方法为:准确称取柴胡15 g,当归15 g,白芍15 g,白术15 g,茯苓15 g,甘草7.5 g,于中草药粉碎机中粉碎成最粗粉,加水1500 mL煮沸,保持沸腾20 min,加入5 g煨姜和5 g薄荷,再保持沸腾煎煮10 min,煎煮液过5层纱布,滤液浓缩至2 g/mL(按生药量计)。
1.3 主要试剂 硅烷化试剂N-甲基-(三甲基硅烷基)-三氟乙酰胺 (MSTFA)(Apollo Scientific Limited UK),三甲基氯硅烷 (TMCS)(98%Acros Organics USA),甲氧胺盐酸盐,二十二烷 (均购自Fluka公司);吡啶 (天津光复科技发展有限公司);正庚烷 (天津市申泰化学试剂有限公司);甲醇 (色谱级,购自Merck公司);丙氨酸氨基转换酶 (ALT)、天门冬氨酸氨基转换酶 (AST)、超氧化物歧化酶 (SOD)、丙二醛 (MDA)试剂盒均购自南京建成工程生物研究所;其他试剂均为分析纯。
1.4 主要仪器 MS-500A型半自动生化分析仪 (成都美生科技有限公司);CTC自动进样器及自带顶空装置 (瑞士CTC股份有限公司);Agilent6890N-5975B气相色谱-质谱仪(美国安捷伦公司)。
2 实验方法
2.1 分组、造模及给药 将42只雄性小鼠随机分为3组,即正常对照组、模型组、逍遥散组;逍遥散组按20 g/kg早晚给予逍遥散;正常对照组及模型组给予蒸馏水;连续给药7 d。第7天末次给药1 h后逍遥散组和模型组小鼠同时腹腔注射0.2%CCl4花生油溶液 (10 mL/kg),正常对照组腹腔注射等量花生油。
2.2 指标测定
2.2.1 小鼠血清中ALT、AST的活性测定 实验第8天,摘除小鼠眼球取血,常规分离血清,按试剂盒说明书测定ALT、AST的水平。
2.2.2 小鼠肝组织匀浆中SOD、MDA的水平测定 实验第8天,处死小鼠后立即取出肝脏,常规制成肝组织匀浆,按试剂盒说明书测定SOD、MDA的水平。
2.2.3 小鼠肝组织病理形态学检测 取完整肝脏中叶,10%甲醛固定。按常规方法制备切片,在光镜下进行病理学检查。
2.3 GC-MS样品处理 取解冻后血清样品100 μL(10%肝组织150 μL),加入500 μL甲醇,旋涡3 min,冰浴30 min后离心 (10000 r/min,4℃,10 min)。取上清液450 μL(10%肝组织400 μL)置Eppendorf管中,N2吹干。加15 mg/mL甲氧胺吡啶溶液50 μL,涡旋混匀,密封后室温下反应12 h,加衍生化试剂 (MSTFA∶TMCS=100∶1,V/V)75 μL,涡旋混匀,密封70℃反应1 h。室温冷却后加含二十二烷 (内标,0.10 mg/mL)的正庚烷150 μL,混匀后离心 (10000 r/min,4℃,10 min),移取上清液置Eppendorf管中,供 GC-MS 分析[3-4]。
2.4 GC-MS分析条件 升温程序:85℃保持5 min,以8℃/min升至 120℃,以 2℃/min升至 125℃,以 10℃/min升至190℃保持10 min,以10℃/min升至280℃保持7 min;进样量1 μL,不分流进样;载气为高纯氦气,体积流量为1.0 mL/min;进样口温度为270℃;离子源温度为230℃;四级杆温度为150℃;调谐方式为自动调谐;扫描方式为全扫描;质量扫描范围为30~600 aum;阈值为30。
2.5 数据处理 根据GC-MS总离子流图中各峰的保留时间挑选共有峰,获取各峰与内标峰的峰面积数据,用相对峰面积 (各峰与内标峰的比值)表示代谢物的量。各组模式识别采用主成分分析 (PCA)应用Matlab 7.0.1软件。统计方差分析应用SPSS 18.0软件。
3 结果
3.1 小鼠血清中ALT、AST活性的测定 与正常对照组相比,模型组小鼠血清ALT和AST活性明显升高 (P<0.01);与模型组相比,逍遥散组血清ALT和AST活性显著降低 (P<0.01)。结果见表1。
表1 逍遥散对急性肝损伤小鼠血清ALT、AST活性的影响(,n=8)

表1 逍遥散对急性肝损伤小鼠血清ALT、AST活性的影响(,n=8)
注:与正常组比较,**P<0.01;与模型组相比,#P<0.05,##P<0.01
组 别 ALT/(IU·L-1) AST/(IU·L-1)22.96 ± 6.23 31.89 ± 7.26模型组 136.46±15.75** 145.37±16.39**逍遥散组 89.38± 6.96## 119.04±20.44正常组#
3.2 小鼠肝组织匀浆SOD、MDA水平 与正常对照组小鼠相比,模型组肝组织匀浆SOD的活性显著降低,MDA的活性明显升高 (P<0.01)。与模型组相比,逍遥散组肝组织MDA的活性显著降低,SOD活性明显升高 (P<0.01)。结果见表2。
表2 逍遥散对急性肝损伤小鼠肝匀浆SOD、MDA活性的影响(,n=8)

表2 逍遥散对急性肝损伤小鼠肝匀浆SOD、MDA活性的影响(,n=8)
注:与正常组比较,**P<0.01;与模型组相比,##P<0.01
组 别 SOD/(IU·mg-1) MDA/(nmol·mg-1)336.73±25.34 4.22±1.08模型组 261.60±20.29** 17.48±3.45**逍遥散组 304.77±31.71## 10.30±2.22正常组##
3.3 肝组织病理切片结果 正常对照组小鼠肝小叶结构正常、清晰,细胞排列整齐,大小均匀,细胞核位于细胞中央,圆而边界清;模型组小鼠肝细胞明显水肿,细胞核浓缩,部分细胞由多角形变为圆球形,胞质疏松呈网状、半透明,细胞膜界不分明,排列紊乱拥挤,有严重的肝细胞坏死现象,可见明显的结节状再生细胞。与模型组比较,逍遥散组小鼠肝细胞水肿减轻,细胞排列较为整齐,结节状再生细胞减少。结果见图3。

图3 肝损伤小鼠肝组织病理改变 (HE×400)
3.4 GC-MS分析结果 各峰挑选后发现血清中共有内源性代谢物38种。取同一样品连续进样6次,计算各相对峰面积的相对标准偏差 (RSD)。血清各峰的RSD为3.14%~14.37%。小鼠血清GC-MS分析总离子流图见图4所示。

图4 小鼠血清GC-MS分析总离子流图
3.5 代谢物鉴定 使用NIST05 a标准谱库对共有的代谢物进行鉴定,一般认为匹配度大于800(最高值为1000)且可能性大于80%的鉴定结果较为可信。见表3。
3.6 代谢物谱模式识别及水平变化 将正常对照组与模型组血清中的所有内源性代谢物进行PCA(主成分分析),主成分积分值集中分布在椭圆形散点图的两个区域,模型组明显偏离正常对照组,无交叉和重叠,正常对照组分布在左方,模型组分布在右方。用T检验判断各组代谢物水平差异,共有11个明显差异代谢物。与正常对照组相比,模型组除肌醇升高 (P<0.05)外,其他10个共有代谢物均明显升高 (P<0.01)。与模型组相比,逍遥散组丙氨酸、甘氨酸、苏氨酸、氨基丙二酸、苹果酸、谷氨酰胺、赖氨酸、肌醇降低 (P<0.05),丝氨酸、天门冬氨酸、鸟氨酸明显降低 (P<0.01)。见表4及图5。
4 讨论
逍遥散常用于临床慢性肝炎、肝硬化等肝损伤疾病的治疗,对于其保肝护肝的药效物质研究大多只停留在病理生理指标的检测[5],一两个指标的变化只能从宏观上证明逍遥散的干预作用,无法全面系统的揭示逍遥散的作用机制。代谢组学是研究生物体受到外界扰动后内源性代谢物动态变化的,可以从微观的角度揭示逍遥散调节生物体各个系统发挥药物疗效的作用机制[6]。本实验建立在CCl4致小鼠肝损伤模型的基础上,首先检测常规肝功能指标ALT、AST、SOD、MDA,证明肝损伤模型成功及逍遥散对特异指标的宏观作用。然后参考黄欣等[8]样品处理方法利用GCMS高通量、高精密度的优点从微观方面对各组血清进行代谢组学研究,采用PCA方法对各组进行模式识别。最后以T检验寻找肝损伤发病机制及逍遥散干预作用的潜在标记物。
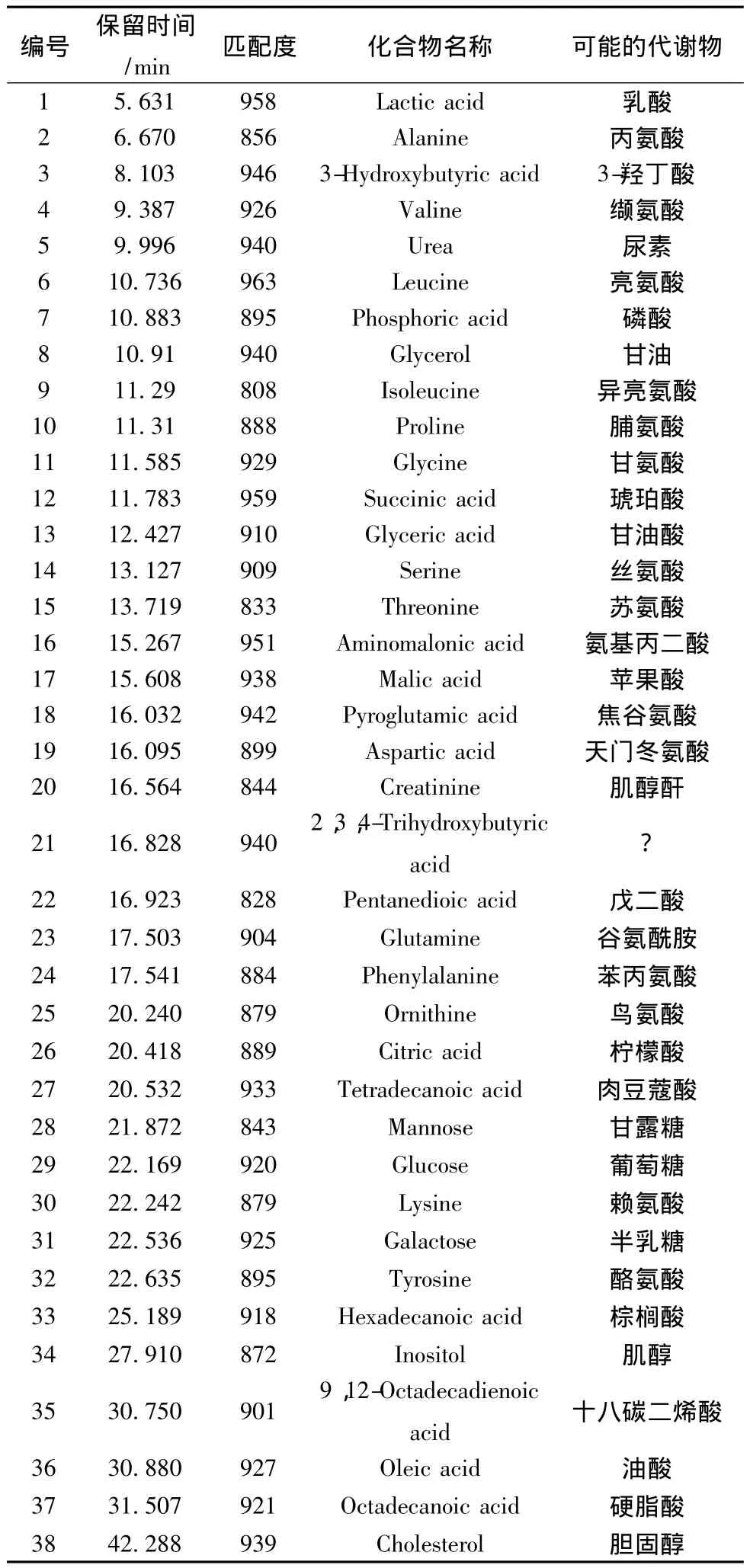
表3 小鼠血清内源性代谢物的鉴定
表4 各组血清中明显差异代谢物变化 (,n=8)
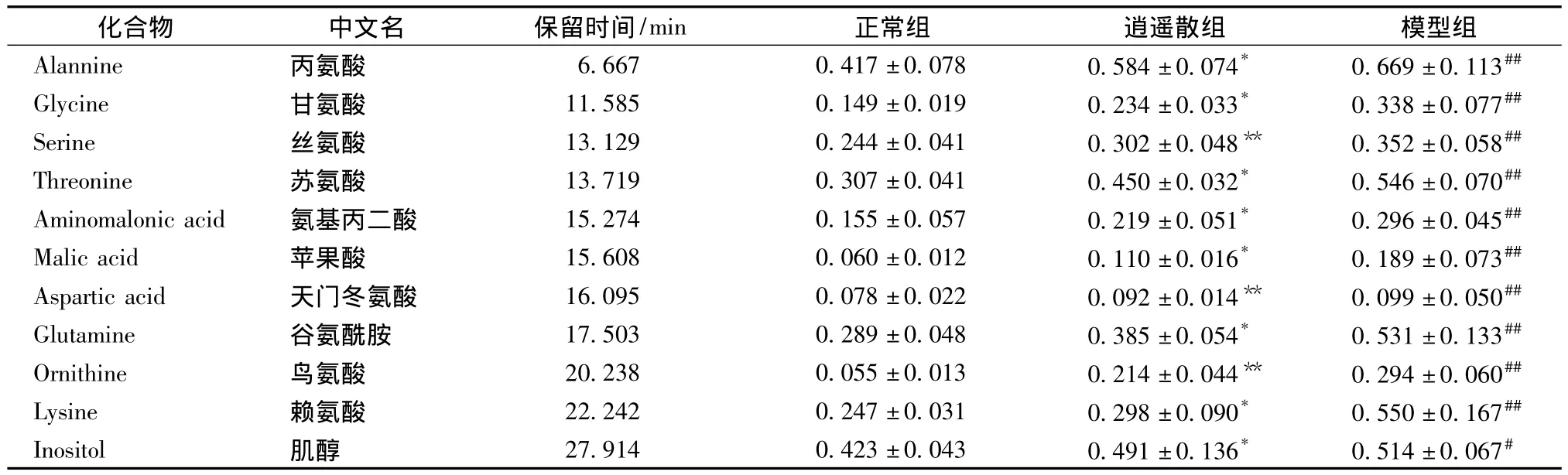
表4 各组血清中明显差异代谢物变化 (,n=8)
注:与正常组比较,*P <0.05,**P <0.01;与模型组相比,#P <0.05,##P <0.01
正常组 逍遥散组 模型组Alannine 丙氨酸 6.667 0.417±0.078 0.584±0.074* 0.669±0.113化合物 中文名 保留时间/min##Glycine 甘氨酸 11.585 0.149±0.019 0.234±0.033* 0.338±0.077##Serine 丝氨酸 13.129 0.244±0.041 0.302±0.048** 0.352±0.058##Threonine 苏氨酸 13.719 0.307±0.041 0.450±0.032* 0.546±0.070##Aminomalonic acid 氨基丙二酸 15.274 0.155±0.057 0.219±0.051* 0.296±0.045##Malic acid 苹果酸 15.608 0.060±0.012 0.110±0.016* 0.189±0.073##Aspartic acid 天门冬氨酸 16.095 0.078±0.022 0.092±0.014** 0.099±0.050##Glutamine 谷氨酰胺 17.503 0.289±0.048 0.385±0.054* 0.531±0.133##Ornithine 鸟氨酸 20.238 0.055±0.013 0.214±0.044** 0.294±0.060##Lysine 赖氨酸 22.242 0.247±0.031 0.298±0.090* 0.550±0.167##Inositol 肌醇 27.914 0.423±0.043 0.491±0.136* 0.514±0.067#
研究表明,模型组小鼠血清ALT、AST明显升高,证明肝损伤模型复制成功[7];模型组肝组织匀浆SOD降低,MDA明显升高,说明肝细胞发生脂质过氧化反应;肝细胞水肿、坏死,细胞排列紊乱,明显可见结节状再生细胞;灌胃给予逍遥散后,小鼠AST降低,ALT、MDA显著降低,SOD升高;肝细胞水肿减轻,细胞排列较为整齐,结节状再生细胞减少。推测逍遥散有降酶,抗脂质过氧化,促进细胞再生及修复细胞的作用。
肝脏是物质代谢的枢纽,同时也是氨基酸代谢的中心器官,当肝功能受损时,可导致氨基酸代谢过程的紊乱,实验结果显示在CCl4引起肝损伤时,模型组血清甘氨酸、丙氨酸、丝氨酸、苏氨酸、天门冬氨酸、赖氨酸、鸟氨酸均明显升高[8-10]。产生这些结果的原因可能是脂质过氧化作用,导致溶酶体酶大量释放入血,组织蛋白分解加强,部分肝细胞结构破坏,使肝细胞合成蛋白质的功能降低,肝对氨基酸清除率降低,造成血中氨基酸水平明显升高。另一方面受损的肝脏对胰高血糖素的灭活降低,导致内源性蛋白处于高分解状态,释放出大量的氨基酸,使血中氨基酸水平增高[11-12]。苹果酸是三羧酸循环的中间产物,它的水平上升,可能是肝损伤状态下体内三羧酸循环发生紊乱所致[13-14]。肌醇是一种水不溶性维生素,在相同的肝损伤报道中首次发现,其代表的生物学意义还需要进一步的实验研究与验证。
尿素循环是氮元素代谢与排泄的重要途径。生物体内多余的氮首先转化成氨,其中大部分氨再通过肝细胞尿素循环途径转化成无毒的尿素,也有一小部分的氨代谢为谷氨酰胺。在急性肝功能衰竭的情况下,尿素循环也被破坏,这就导致血清中尿素量的减少以及血氨水平的上升,从而激发谷氨酰胺的合成[15]。
逍遥散组丙氨酸、甘氨酸、苏氨酸、氨基丙二酸、苹果酸、谷氨酰胺、赖氨酸、肌醇降低,丝氨酸、天门冬氨酸、鸟氨酸显著降低。说明逍遥散能有效调节氨基酸的水平。综上所述,推测逍遥散的作用机制是降酶,清除自由基,抑制脂质过氧化;有效调节三羧酸循环、尿素循环,使体内部分氨基酸及肌醇恢复正常。
[1]Nicholson J K,Lindon J C,Holmes E.‘Metabonomics':understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J].Xenobiotica,1999,29(11):1181-1189.
[2]齐 炼,文李萍,赵 静.代谢组学与中医药现代研究[J].世界科学技术:中医药现代化,2006,8(6):79-86.
[3]黄 欣,龚益飞,王 毅,等.代谢组学方法研究水飞蓟宾对四氯化碳致小鼠肝损伤的保护作用[J].高等学校化学学报,2008,29(4):714-719.
[4]黄 欣,龚益飞,虞 科,等.基于气相色谱-质谱的代谢组学方法研究四氯化碳致小鼠急性肝损伤[J].分析化学,2007,35(12):1736-1740.
[5]吴 涛,蒋 岚,孙玉华.护肝布祖热颗粒提取新工艺及其对小鼠肝损伤保护作用的研究[J].中国中药杂志,2011,36(4):429-433.
[6]Dettmer K,Aronov P A,Hammock B D.Mass spectrometrybased metabolomics[J].Mass Spectrom Rev,2007,26(1):51-78.
[7]齐艳萍,李和平.急性肝损伤动物模型制备的概述[J].甘肃畜牧兽医,2008,38(2):37-39.
[8]黄 欣.基于GC-MS代谢组学的肝脏毒理研究及数据处理方法[D].杭州:浙江大学,2008.
[9]龚益飞.肝损小鼠代谢组的GC-MS分析方法研究[D].杭州:浙江大学,2007.
[10]林景超.化学性肝损伤及肝癌的代谢组学研究[D].上海:上海交通大学,2008.
[11]胡迎青,顾君一.小鼠CCl4急性肝损伤体内氨基酸水平的改变[J].南通医学院学报,1995,15(3):372-374.
[12]陈贤明,尹 镭,许瑞令,等.暴发性肝损伤肝性脑病大鼠血浆及脑游离氨基酸变化的相关分析[J].中国病理生理杂志,1993,9(3):24-27.
[13]薛文新.基于代谢组学的当归及其不同炮制品多糖对肝损伤保护作用的研究[D].兰州:甘肃农业大学,2012.
[14]Fancy S A,Beckonert O,Darbon G,et al.Gas chromatography/flame ionisation detection mass spectrometry for the detection of endogenous urine metabolites for metabonomic studies and its use as a complementary tool to nuclear magnetic resonance spectroscopy[J].Rapid Commun Mass Sp,2006,20(15):2271-2280.
[15]Singh H K,Yachha S K,Saxena R,et al.A new dimension of1H-NMR spectroscopy in assessment of liver graft dysfunction[J].Nmr Biomed,2003,16(4):185-188.

