行辅助生殖技术患者流产胎儿人白细胞抗原-G基因14bp插入/缺失多态性分析
李观贵,吴彤华,朱元昌,尹彪,宋成,陈晓燕,曾勇,林奇
(广东深圳中山泌尿外科医院生殖医学中心,深圳市围着床期生殖免疫重点实验室,深圳中山生殖与遗传研究所,深圳 518045)
约有10%~15%的人妊娠后流产,其中大部分的流产是由胎儿的遗传学异常,如染色体非整倍体、基因突变或多态性等引起。流产越早发生,胎儿的遗传学异常机率也越高[1]。研究表明,50%~80%的流产胎儿染色体为非整倍体,是引起流产的最主要原因[1]。然而,对于染色体数目正常的流产胎儿,其流产原因往往难以确定。
人类白细胞抗原G(HLA-G)属于I类非经典主要组织相容性复合物,限制性表达于母胎界面的外滋养层细胞。其可抵制自然杀伤细胞(NK细胞)、T淋巴细胞及树突状细胞等免疫细胞的功能,在胚胎种植及妊娠维持中发挥重要作用[2,3]。与其他HLA基因的高多态性不同,HLA-G的基因的多态性非常低,讫今仅发现23种等位基因。其中,HLA-G基因3’端非翻译区(3’-untranslated region,3’-UTR)的14bp插入/缺失多态性与 HLA-G的表达及功能密切相关[4,5]。
HLA-G基因14bp插入可导致其转录产生的mRNA在3’-UTR区缺失92bp长度的片段,影响mRNA的稳定性及翻译,从而使HLA-G的合成及浓度降低[5]。此外,行辅助生殖技术患者胚胎体外培养的培养液中可溶性HLA-G分子(由胚胎分泌)的浓度与胚胎着床成功与否呈正相关,表明胚胎分泌足够浓度的可溶性HLA-G分子对胚胎种植及妊娠维持至关重要[6,7]。因此,胚胎 HLA-G基因14bp多态性可能影响胚胎HLA-G的合成,进而导致胎儿流产。
有学者研究表明,母方的 HLA-G基因14bp插入/缺失多态性与复发性流产呈相关性,提示其在流产中发挥重要作用,然而这些研究未能排除胎儿的非整倍体情况[5,8]。胚胎滋养层细胞是表达HLA-G的主要来源,流产后的胎儿在排除染色体非整倍体后,其HLA-G基因14bp插入/缺失多态性情况与流产的相关性可能更为重要。
材料与方法
一、研究对象
2011年3月至2012年12月,于我院生殖中心行体外受精(IVF)或卵胞浆内单精子注射(ICSI)技术治疗的患者,符合以下条件者入选:生殖系统无器质性病变;性激素正常;无已知的免疫性疾病;妊娠后12周内流产;流产物经多重连接依赖式探针扩增技术(MLPA,检测相关结果另文发表)检测23对染色体数目均正常[9]。共82例流产胎(IVF+ICSI流产组)符合条件入选,其中通过IVF方式妊娠的流产胎47例(IVF流产组),通过ICSI方式妊娠的单胎胎儿35例(ICSI流产组)。同时,自然单胎妊娠且孕周≤12的患者于我院妇科行选择性人工流产,经MLPA技术检测23对染色体正常的胎儿共49例作为对照组。
二、样本收集
刮宫产物于生理盐水中清洗数遍,在体视镜下用剪刀分离绒毛或胎儿组织,并于生理盐水中冲洗3遍,以去除血块等母体成份的污染。胎儿组织用QIAamp DNA Mini Kit(Qiagen,德国)提取 DNA,按说明书操作。DNA保存于-80℃备用。
三、HLA-G基因14bp多态性分析
根据GenBank公布的人类HLA-G基因序列设计引物,正向引物序列:5’-GTG ATG GGC TGT TTA AAG TGT CAC C-3’(5’末端用荧光素标记),反向引物序列:5’-GGA AGG AAT GCA GTT CAG CAT GA-3’。应用上述引物使用 PCR 方法扩增 HLA-G基因3’-UTR区,PCR扩增条件为:95℃预变性5min;然后95℃变性30s,68℃复性30s,72℃延伸1min,共35个循环;最后72℃再延伸5min。聚合酶链反应(PCR)产物用 Hidi-formamide(Applied Biosystems,美国)变性,以 LIZ-500(Applied Biosystems,美国)为标准品,于 AB 3500遗传分析仪(Applied Biosystems,美国)进行片段分析。PCR产物有224bp和210bp两种片段,其中224bp长度的序列代表14bp插入(+14bp),而210bp长度片段代表14bp缺失(-14bp)。
四、统计学分析
用SPSS 16.0软件行t检验及卡方检验分析数据。如P<0.05则认为有统计学差异。
结 果
一、PCR扩增与产物分析
通过PCR技术成功扩增到 HLA-G基因3’-UTR特异性片段,其中+14bp片段长度位于224bp位置附近,-14bp片段长度位于210bp位置附近,与预期大小相符(图1)。两种片段产物经回收纯化后测序鉴定,确认与目标序列相符(图2)。
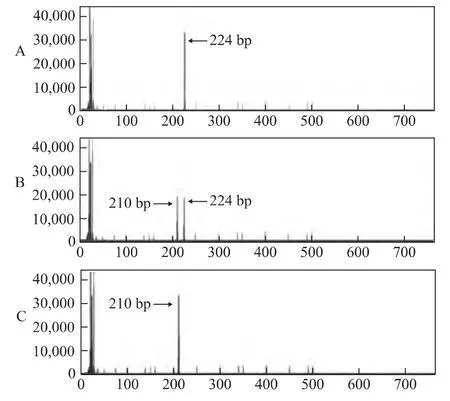
图1 HLA-G基因14bp多态性片段分析
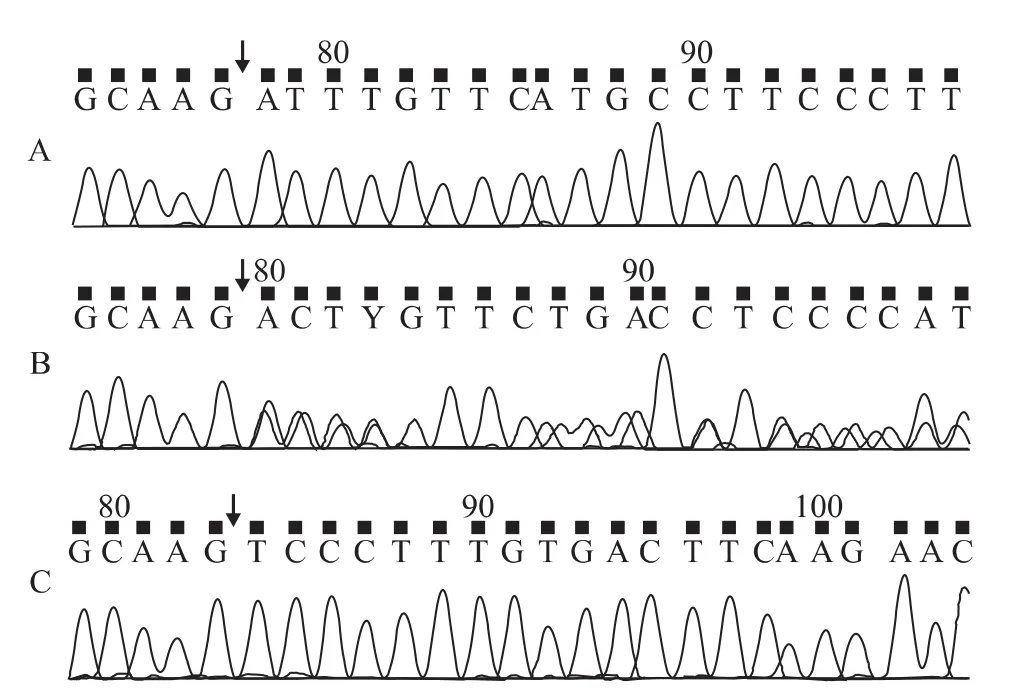
图2 HLA-G基因14bp多态性测序结果
二、等位基因频率分析
IVF流产组HLA-G基因14bp插入的频率为35.11%,14bp缺失的频率为64.89%;ICSI流产组HLA-G基因14bp插入的频率为31.43%,14bp缺失的频率为68.57%;IVF+ICSI流产组 HLA-G基因14bp插入的频率为33.54%,14bp缺失的频率为66.46%;对照组HLA-G基因14bp插入的频率为41.84%,14bp缺失的频率为58.16%。各组间等位基因多态性频率均无统计学差异(P>0.05)(表1)。
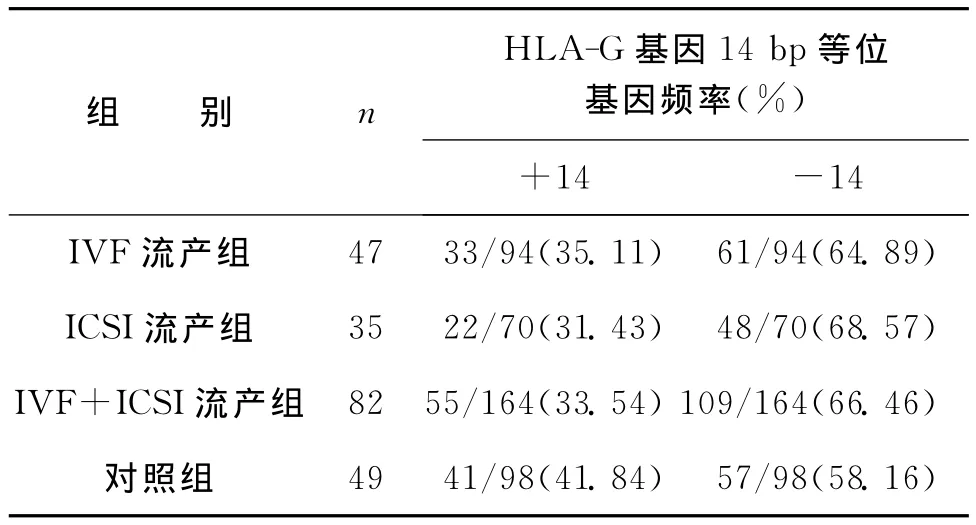
表1 流产组及对照组HLA-G基因14bp等位基因型频率分布比较
三、基因型频率分析
IVF流产组 HLA-G 基因+14/+14、+14/-14和-14/-14的基因型频率分别为10.64%、48.94% 和 40.43%;ICSI 流 产 组 HLA-G 基 因+14/+14、+14/-14和-14/-14的基因型频率分别为5.71%、51.43%和42.86%;IVF+ICSI流产组 HLA-G基因+14/+14、+14/-14和-14/-14 的 基 因 型 频 率 分 别 为 8.54%、50.00% 和41.46%;对照组 HLA-G 基因+14/+14、+14/-14和-14/-14的基因型频率分别为18.37%、46.94%和34.69%。各组间基因型频率均无统计学差异(P>0.05)(表2)。
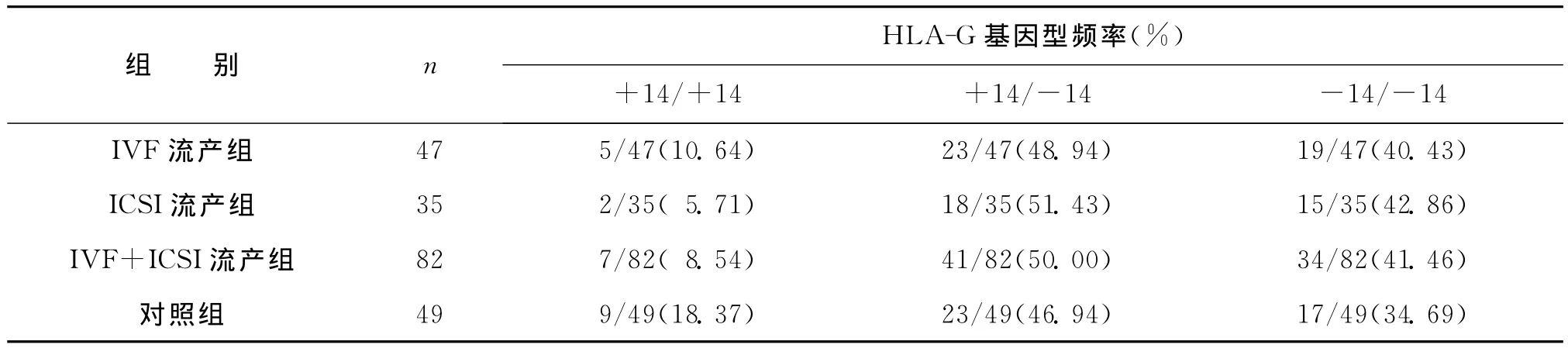
表2 流产组及对照组HLA-G基因型频率分布比较
讨 论
辅助生殖技术已成为治疗不孕不育最有效的方法之一,然而治疗妊娠后的患者约有10%~15%会发生早期流产,是当前辅助生殖技术面临的主要问题之一。流产原因众多,其中染色体非常倍体最为常见,是引起流产的最主要原因[1],但其他流产病因至今大部分仍不明确。HLA-G作为影响胚胎着床及妊娠维持的重要因子,其表达或功能异常可能是导致流产的原因之一。
在妊娠期间,胎儿能在母体宫腔内顺利发育而不被排斥,其主要原因是滋养细胞不表达经典的主要组织相容性复合体(MHC)I、II和III类分子,只表达非经典的MHC I类分子如HLA-G等。HLAG维持妊娠的机理包括:(1)直接或间接抑制NK细胞;(2)与蜕膜组织中的T细胞结合,抑制T细胞杀伤;(3)调节T辅助性细胞因子分泌,促使Th2偏移;(4)可溶性 HLA-G分子通过激活Fas/FasL旁路,引起活化母体CD8+T细胞的凋亡[10]。1993年由Harrison等[11]首次报道了 HLA-G第8外显子(14-bp/14+bp)多态性,在对灵长类动物的MHC-G进化过程研究中发现,这种14bp多态性属于缺失性多态,而非插入性多态。
早期研究主要关注母方或父母双方的HLA-G基因3’-UTR中14bp插入/缺失多态性与复发性流产的相关性,多数研究认为其与复发性流产的发生相关[5,8],但也有文献报道两者无相关性[12]。 本文则对行辅助生殖技术后流产,经MLPA方法检测染色体数目正常的胎儿 HLA-G基因3’-UTR中14bp插入/缺失多态性进行分析,以期揭示其与流产发生的相关性。结果显示,HLA-G的等位基因频率及基因型频率在流产组及对照组中相当,无统计学差异,提示其可能不是导致流产发生的原因。Moreau等[13]研究发现,流产胎盘的 HLA-G基因14bp多态性与对照组相似,我们的研究结果与其一致。但是,本文仅对基因多态性进行检测,未对其表达产物进行定量分析。后期研究可进一步研究流产胎儿的不同14bp基因型的HLA-G的蛋白表达情况及其与流产的关系。
本研究观察到的一个现象:在对照组中HLAG基因+14/+14纯合基因型的频率较IVF组或ICSI组均高,这与我们的预期结果相反。Sipak-Szmigiel等[12]对波兰复发性流产患者进行研究时同样发现,对照组的+14/+14纯合基因型频率较复发性流产患者高,我们的结果与其类似。出现这种情况的原因目前仍不明确,可能与研究的样本数较少或人种有关。
[1]Simpson JL.Causes of fetal wastage[J].Clin Obstet Gynecol,2007,50:10-30.
[2]Le Gal FA,Riteau B,Sedlik C,et al.HLA-G-mediated inhibition of antigen-specific cytotoxic T lymphocytes[J].Int Immunol,1999,11:1351-1356.
[3]Contini P,Ghio M,Poggi A,et al.Soluble HLA-A,-B,-C and-G molecules induce apoptosis in T and NK CD8+cells and inhibit cytotoxic T cell activity through CD8ligation[J].Eur J Immunol,2003,33:125-134.
[4]Hviid TV,Hylenius S,Rorbye C,et al.HLA-G allelic variants are associated with differences in the HLA-G mRNA isoform profile and HLA-G mRNA levels[J].Immunogenetics,2003,55:63-79.
[5]Tripathi P,Abbas A,Naik S,et al.Role of 14-bp deletion in the HLA-G gene in the maintenance of pregnancy[J].Tissue Antigens,2004,64:706-710.
[6]Rebmann V,Switala M,Eue I,et al.Soluble HLA-G is an independent factor for the prediction of pregnancy outcome after ART:a German multi-centre study[J].Hum Reprod,2010,25:1691-1698.
[7]Desai N,Filipovits J,Goldfarb J.Secretion of soluble HLA-G by day 3human embryos associated with higher pregnancy and implantation rates:assay of culture media using a new ELISA kit[J].Reprod Biomed Online,2006,13:272-277.
[8]Wang X,Jiang W,Zhang D.Association of 14-bp insertion/deletion polymorphism of HLA-G gene with unexplained recurrent spontaneous abortion:a meta-analysis[J].Tissue Antigens,2013,81:108-115.
[9]吴彤华,尹彪,朱元昌,等 .辅助生殖和自然妊娠中早期自然流产胚胎染色体数目异常的研究[J].生殖与避孕,2013,33:16-23.
[10]Hunt JS,Petroff MG,McIntire RH,et al.HLA-G and immune tolerance in pregnancy[J].FASEB J,2005,19:681-693.
[11]Harrison GA,Humphrey KE,Jakobsen IB,et al.A 14bp deletion polymorphism in the HLA-G gene[J].Hum Mol Genet,1993,2:2200.
[12]Sipak-Szmigiel O,Cybulski C,Lubiński J,et al.HLA-G polymorphism in a Polish population and reproductive[J].Tissue Antigens,2008,71:67-71.
[13]Moreau P,Contu L, Alba F,et al.HLA-G Gene Polymorphism in Human Placentas:Possible Association of G*0106Allele with Preeclampsia and Miscarriage[J].Biol Reprod,2008,79:459-467.

