用胶原纤维分离含不同糖基数的黄酮苷类化合物
丁平平,廖学品,张文华,石 碧*
1四川大学化工学院化工系;2 四川大学制革清洁技术国家工程实验室;3 四川大学生物质化学与工程系,成都 610065
黄酮苷是由糖或糖的衍生物(如氨基酸、糖醛糖等)与黄酮通过脱水缩合而成的化合物,是自然界中分布最广泛的一类黄酮化合物,在众多植物提取物中大量共存[1]。黄酮苷类化合物的分子结构相似,具有基本相同的母体结构,仅母体各位点取代基有所不同,这使其分离困难。目前大多采用柱层析法对黄酮苷类化合物进行分离纯化,但传统的柱层析填料如聚酰胺、硅胶和葡聚糖等存在洗脱难和不易再生等缺陷。近年来,广泛使用大孔吸附树脂进行这类天然产物的分离纯化。
胶原纤维是一种天然高分子,来自家畜动物的皮,原料易得,使用安全,生物相容性好,可生物降解性。它含有大量的活性基团如肽键、-OH、-COOH、-NH2等[2],能与多酚、黄酮类化合物上的酚羟基形成氢键。本课题组的前期研究表明,用胶原纤维制备的分离材料能选择性除去植物提取物中的单宁,这是因为单宁富含酚羟基,能与胶原纤维以多点氢键结合,而其他化合物与胶原纤维形成的氢键作用力较弱[3]。胶原纤维分离材料也能有效分离黄酮苷和含吡啶环的生物碱混合物[4],这也是因为与生物碱相比,黄酮苷与胶原纤维的氢键作用更强。研究还表明,胶原纤维能分离黄酮和黄酮苷的混合物,这是由于两者的结构差异较大,与胶原的氢键结合能力不同[5]。这些研究表明,胶原纤维分离材料主要基于对被分离物的氢键作用力差异而将其分离。被分离化合物所含可形成氢键的活性基团的数目和位置,能极大的影响氢键作用力。黄酮苷类化合物中的糖基能与胶原纤维的活性基团形成氢键,通过调控胶原纤维与黄酮苷类化合物之间的氢键作用强度,有可能将不同的黄酮苷类化合物分离开。
为了使研究结果具有代表性,本文选用分别含1 个、2 个和3 个糖基的黄酮苷(槲皮苷、芦丁和刺槐素)作为黄酮苷类化合物的代表,研究了胶原纤维分离材料(GCF)对黄酮苷类混合物体系的分离特性。从卫生和环保角度考虑,采用蒸馏水和乙醇作为洗脱剂。
1 实验部分
1.1 试剂与仪器
试剂:无水乙醇等试剂均为分析纯。HPLC 分析用甲醇和甲酸为色谱纯(Fisher Chemicals),实验用水经Millipore 超纯水制备系统净化。槲皮苷和芦丁,购自陕西慧科植物开发有限公司,含量均为98%以上;刺槐素,购自湖州恩贝希生物原料有限公司,含量95%以上。三种黄酮苷的分子结构式见图1。仪器:Alliance2996 高效液相色谱仪,美国Waters公司;Aichrom bond-AQ C18 反相色谱柱(150 mm ×4.6 mm,5 μm);UV751GD 紫外可见分光光度计,美国PerkinElmer 公司;BSZ-100 型自动收集器、HL-2型恒流泵,上海沪西分析仪器厂;层析柱(16 mm ×50 cm),成都凌云玻璃厂。
1.2 胶原纤维分离材料的制备

图1 槲皮苷(1)、芦丁(2)和刺槐素(3)的分子结构Fig.1 Molecular structures of quercitrin(1),rutin (2)and robinin (3)
胶原纤维分离材料的制备按课题组建立的方法进行[6]。其简要步骤为:以牛皮为原料,按常规方法经清洗、碱处理、片皮、脱碱、干燥、研磨等操作制得胶原纤维;取胶原纤维15 g,用300 mL 蒸馏水浸泡12 h,加入10 mL 50%的戊二醛,先于25 ℃下反应1 h,然后于30 ℃下反应4 h。过滤后用蒸馏水洗涤3 次,再用无水乙醇洗涤,过滤,于45 ℃下干燥12 h 得到胶原纤维分离材料(GCF)。
1.3 乙醇浓度对GCF 吸附刺槐素、槲皮苷和芦丁的影响
由于三种黄酮苷化合物难溶于水,易溶于乙醇,因此采用乙醇浓度高于30%溶液进行静态吸附实验。分别采用乙醇浓度为30%、40%、50%、60%、70%、80%、90%和100%(v/v)的乙醇-水溶液配制100.0 mL 刺槐素、槲皮苷和芦丁混合溶液(溶液中各成分浓度均为30 mg/L)。取上述各溶液15.0 mL,加入0.15 g GCF,在298 K 下振荡吸附12 h。用HPLC 检测吸附前后溶液中各成分的浓度,用公式(1)计算吸附率E。

式中,E 为吸附率,C0为吸附前HPLC 峰面积,Ce为吸附后HPLC 峰面积。
1.4 柱分离
用无水乙醇配制刺槐素-芦丁、槲皮苷-芦丁、刺槐素-芦丁-槲皮苷的混合溶液,混合溶液中各成分的浓度均为5 mg/mL。这些混合溶液为柱分离上样液。
称取10.0 g GCF,用无水乙醇浸泡12 h,以湿法装柱的方式装入直径为16 mm 的层析柱内,柱高为30 cm,柱体积为60 mL,空隙体积为14.7 mL。先用洗脱液预平衡色谱柱2 BV,然后分别取上述上样液1 mL 进行上样(无需过滤)。上样结束后在0.5 BV/h 的恒定流速下对色谱柱进行分步洗脱。用自动收集器定时收集流出液,并HPLC 检测流出液中各成分的浓度。
1.5 GCF 的重复使用性
选用对刺槐素-芦丁-槲皮苷的分离考察GCF 的重复使用性。上样液的配制和柱分离方法同1.5,用自动收集器定时收集流出液,用HPLC 测定合并洗脱段中槲皮苷、芦丁和刺槐素的浓度,根据公式(2)和(3)计算纯度P 和回收率R。

其中,mi 为单独组分质量(μg);m 为分离得到的组分总质量(μg);

其中M 为槲皮苷(芦丁或者刺槐素)上样质量(mg);m 为分离得到的槲皮苷(芦丁或者刺槐素)的质量(mg)。
每次分离结束后,分别用180 mL 90%(v/v)乙醇水溶液以0.25 BV/h 的恒定流速洗涤和平衡色谱柱,然后再重复进行分离实验。
2 结果与讨论
2.1 乙醇浓度对吸附的影响
图2 为刺槐素、芦丁和槲皮苷在不同浓度的乙醇水溶液中的静态吸附率。当乙醇浓度低于70%时,GCF 对三种黄酮苷的吸附率均低于30%;当乙醇浓度高于80%时,吸附率均明显增加。这表明,GCF 在高乙醇溶液中对三种黄酮苷具有较高的吸附选择性。对图2 综合分析可以发现,芦丁在50%~70%乙醇水溶液中吸附率都较低,因此可以该浓度范围的乙醇水溶液作为芦丁的洗脱液;而刺槐素在50%乙醇水溶液中吸附率最低,因此50%乙醇水溶液可作为其洗脱液。根据上述结果推测通过分步洗脱的方式(改变洗脱液中乙醇浓度)能够在GCF上将三种物质分离开。

图2 三种黄酮苷化合物在不同浓度乙醇-水溶液中的吸附率Fig.2 Adsorption extents of three flavone glycosides on GCF in different aqueous ethanol solutions
2.2 吸附机理
已有的研究表明,胶原纤维和植物多酚主要通过分子间多点氢键和疏水键的协同作用而结合[6]。因此,氢键和疏水作用可能是GCF 吸附黄酮苷类化合物的主要机理。在水含量较高的溶液中,水分子作为良好的氢键受体和供体,能够分别与GCF、黄酮苷类化合物形成氢键,这种竞争反应导致GCF 与黄酮苷类化合物之间的氢键作用力减弱。因此,在乙醇浓度小于50%的溶液中,GCF 的脂肪侧链与吸附质疏水区之间的疏水作用是吸附质在GCF 上吸附的主要驱动力。由于黄酮苷类化合物的疏水性差别不大,因此在低浓度的乙醇水溶液中,GCF 对黄酮苷类化合物的吸附率均较低。
乙醇浓度大于70%时,GCF 与吸附质之间的疏水作用受到抑制,而它们之间的氢键却更容易形成。这是因为乙醇的极性小于水的极性,乙醇参与氢键竞争反应的能力小于水。在纯乙醇中,氢键是GCF与吸附质之间的主要作用力,这时三种黄酮苷的吸附率都达到最大。如图2 所示,GCF 对三种黄酮苷的吸附率大小顺序为:刺槐素>芦丁>槲皮苷。三种化合物的氢键活性位点主要是羟基,含3 个糖基的刺槐素有更多的氢键活性位点,因此GCF 对刺槐素的吸附率最大。芦丁C-3 位上连接二糖(β-D-葡萄糖基-7-L-鼠李糖),形成氢键的活性基团多于槲皮苷,因而芦丁的吸附率次之;槲皮苷C-3 位上连接的单糖,故而吸附率最低。以上结果表明,在高乙醇浓度溶液中,GCF 与吸附质之间的主要作用力是氢键,GCF 对黄酮苷化合物具有较高的吸附选择性。
以上实验结果和分析表明,在低浓度乙醇溶液中,疏水作用是GCF 与吸附质(黄酮苷类化合物)之间的主要作用力;而在高浓度乙醇溶液和纯乙醇中,氢键是其主要作用力。这与一些学者在研究蚕丝蛋白吸附黄酮类化合物、交联琼脂糖凝胶分离EGCG 及大孔树脂吸附胺类化合物时的吸附机理一致[7,8]。
2.3 两组分体系柱分离
根据三种黄酮苷化合物的结构,把它们分成两组合(槲皮苷-芦丁和刺槐素-芦丁),每组中的两个黄酮苷相差一个糖环,考察分离效果。根据静态吸附实验结果,用90%~70%乙醇水溶液以梯度洗脱的方式对芦丁-槲皮苷混合物进行分离,用70%~50%乙醇水溶液以梯度洗脱方式对刺槐素-芦丁混合物进行分离。分离色谱曲线如图3 和4 所示。

图3 芦丁-槲皮苷化合物在GCF 柱上的分离色谱图Fig.3 Separation chromatograms of rutin-quercitrin mixture on GCF column
由图3 可见,在芦丁-槲皮苷分离中,槲皮苷在90%乙醇洗脱段被全部洗脱,而芦丁在70%乙醇水溶液段被洗脱。这是由于采用90%乙醇作洗脱液时,GCF 与含羟基较少的槲皮苷之间的氢键作用较弱,而与含羟基较多的芦丁之间的氢键作用强,因此芦丁保留在GCF 柱上。随着洗脱液中水的比例的增加,GCF 与芦丁之间的氢键被破坏,使之被洗脱下来。
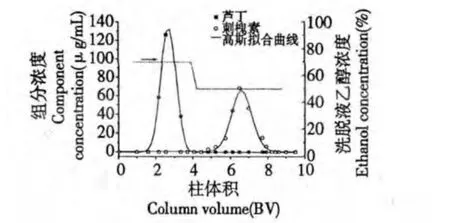
图4 刺槐素-芦丁化合物在GCF 柱上的分离色谱图Fig.4 Separation chromatogram of robinin-rutin mixture on GCF column
在刺槐素-芦丁混合物分离中,芦丁在70%乙醇水洗脱段被全部洗脱,而刺槐素被保留在柱上。这表明刺槐素与GCF 的吸附作用更强,这与刺槐素含更多可形成氢键的-OH 是一致的。实验结果表明,通过改变洗脱液的组成,可以调节三种黄酮苷化合物在GCF 柱上的保留时间,通过分步洗脱的方式使它们在GCF 柱上得到分离。
为了进一步研究三种黄酮苷化合物在GCF 柱上的分离特性,计算了色谱峰分离度这一重要参数。采用Gaussian 方程[9]对色谱曲线进行拟合,从而获得分离度。Gaussian 方程是较常用的拟合模型,该模型假设色谱流出曲线符合高斯分布函数,即是左右对称的峰。

其中A 为峰面积;w 为半峰宽;xc 为峰中心值。
拟合参数如表1 所示。Gaussian 方程对两组分体系色谱曲线的拟合相关系数都大于0.97,槲皮苷-芦丁和刺槐素-芦丁体系在GCF 柱上的色谱曲线符合Gaussian 分布,表明在GCF 柱上的色谱峰较对称,没有明显的区带扩散现象,柱效较高。根据Gaussian 方程拟合得到的数据,按分离度公式(5)计算两组分体系在GCF 柱上的分离度。

其中V1 和V2 分别为相邻两物质各自的洗脱体积;W1 和W2 分别为两个化合物对应的色谱峰的半峰宽度。
槲皮苷-芦丁和刺槐素-芦丁体系在GCF 柱上的分离度如表1 所示。分离度是色谱柱总分离效能的衡量指标,分离度越大,表明相邻组分分离越好。当分离度小于1 时,两组分有部分重叠;当分离度等于1 时,两组分有较好的分离;当分离度等于1.5 时,两组分完全分开,也称为基线分离[10]。槲皮苷和芦丁在GCF 柱上的分离度为3.60,而芦丁和刺槐素的分离度为2.47,表明GCF 柱能实现刺槐素-芦丁和芦丁-槲皮苷两组份的完全分离,且具有较高的分离效能。

表1 两组分黄酮苷混合物分离曲线的Gaussian 方程拟合参数Table 1 Gaussian fitting parameters for separation curve of two-component mixture of flavone glycosides
2.4 三组分柱分离
根据两组分黄酮苷混合物的分离结果,考察了GCF 柱对刺槐素-芦丁-槲皮苷构成的三组分的分离效果,采用90%-70%-50%乙醇水溶液分步洗脱分离。由图5(a)可见,在90%乙醇水溶液洗脱段,实现槲皮苷与芦丁、刺槐素分离;采用70%乙醇水溶液可以将芦丁洗脱,而刺槐素被保留在GCF 柱上;50%乙醇水可将刺槐素的洗脱。这表明三种黄酮苷类化合物能够在不同的溶剂中被洗脱从而实现分离,这是因为它们与GCF 之间形成氢键的能力存在差异。
当用30%乙醇水溶液洗脱时,三种化合物几乎同时从色谱柱上流出,没有达到分离效果,如图5(b)所示。该对比实验结果进一步证实:在无水乙醇及高浓度乙醇溶液中,GCF 与吸附质之间以氢键作用为主,在水中则以疏水作用为主。且基于氢键作用,GCF 能够有效地分离含不同糖基数量黄酮苷类化合物,基于疏水作用则没有分离效果。

图5 刺槐素-芦丁-槲皮苷混合物在GCF 柱上的分离色谱图Fig.5 Separation chromatograms of robinin-rutin-quercetin mixture on GCF column
2.5 GCF 柱的重复使用性
分离材料的重复使用性对其实际应用具有非常重要的意义,故对GCF 柱的重复使用性能进行了研究。图6 是GCF 柱第1 次和第5 次重复使用分离刺槐素-芦丁-槲皮苷混合物的色谱图。可以看出,第1 次和第5 次分离中,三组分体系的保留时间基本一致。在5 次重复分离中,三种黄酮苷化合物的回收率均大于75%,如表3 所示。上述的实验结果表明,GCF 柱在黄酮苷类化合物分离中具有良好的重复使用性和稳定性。
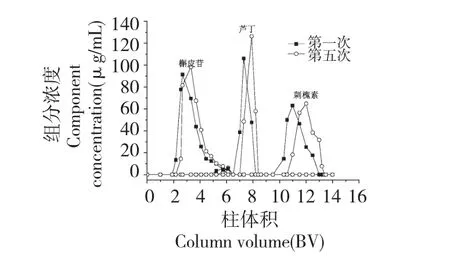
图6 刺槐素-芦丁-槲皮苷混合物在重复使用GCF 柱上的色谱图Fig.6 Separation chromatograms of robinin-rutin-quercitrin mixture on regenerated GCF column

表3 重复使用GCF 分离三种黄酮苷化合物时产物的纯度和回收率Table 3 Purity and recovery of flavone glycosides separated by regenerated GCF column
3 结论
戊二醛交联胶原纤维分离材料对黄酮苷类化合物的吸附分离主要是基于氢键作用。含不同糖基数量的黄酮苷类化合物与胶原纤维之间的氢键作用力不同,因此可以用胶原纤维分离材料对它们的类混合物进行分离纯化。同时,胶原纤维分离材料用于黄酮苷类化合物分离时,表现出良好的可重复使用性,因此具有良好的实用价值。
1 Zhao YY,Wang JH,Fu XT,et al.Simultaneous determination of eleven flavonoid glycosides in Ginkgo biloba leaves collected in different seasons by UPLC PDA method.Acta Pharm Sin,2013,48:98-103.
2 Liao LL(廖隆理).Leather Chemistry and Engineering(制革化学与工艺学).Beijing:Science Publishing House,2005:107-118.
3 Liao XP(廖学品),Ma HW(马贺伟),Lu ZB(陆忠兵),et al.Selective removal of tannins from extracts of Chinese medicinal herbs.Nat Prod Res Dev(天然产物研究与开发),2004,16:10-15.
4 Li J,Liao XP,Liao GH,et al.Separation of flavonoid and alkaloid using collagen fiber adsorbent.J Sep Sci,2010,33:2230-2239.
5 Zhang QX(张琦弦),Liao XP(廖学品),Shi B(石碧),et al.Separation of flavanoneglycosides and aglyconesmixture using collagen fiber adsorbent.J Sichuan Univ,Eng Sci Ed(四川大学学报,工程科学版),2012,44:244-254.
6 Liao XP,Lu ZB,Shi B.Selective adsorption of vegetable tannins onto collagen fibers.Ind Eng Chem Res,2003,42:3397-3402.
7 Baycin D,Altiok E,Ulku S,et al.Adsorption of olive leaf(Olea europaea L.)antioxidants on silk fibroin.J Agric Food Chem,2007,55:1227-1236.
8 Xu J,Tan TW,Janson JC.Mixed-mode retention mechanism for (-)-epigallocatechin gallate on a 12% cross-linked agarose gel media.J Chromatogr A,2006,1137:49-55.
9 Zhang YK(张玉奎),Dong LF(董礼孚),Bao MS(包绵生),et al.色谱流出曲线的曲线拟合法.J Instru Anal(分析测试通报),1984,2:16-19.
10 Chen HL(陈欢林).The new separation technology(新型分离技术).Beijing:Chemical Industry Publishing House.2005,268-275.
——以高中化学“氢键”的教学为例

