狗脊化学成分及抑制乙酰胆碱酯酶生物活性研究
殷帅文 ,何旭梅,王 伟,赖 强,马 宁,王安萍
1井冈山大学生命科学学院;2 井冈山大学电信学院,吉安 343009
狗脊(Woodwardia japonica)为乌毛蕨科(Blechnaceae)狗脊属植物。该属共12 种,除弗吉尼亚狗脊[Woodwardia virginia(L.)J.Sm.]外,我国均有分布。狗脊分布地域广阔,为丘陵地区常见的酸性土指示植物,生物资源十分丰富[1]。狗脊是我国应用已久的中草药品种。现代一般认为它是中草药“贯众”的基源植物之一,而在古代的本草著作它却是中药“狗脊”的基源。民间记载狗脊具有清热解毒、止血、杀虫、散淤和消肿等功效。主治虫积腹痛,湿热便血,血崩、痢疾、疗疮肿痛、感冒等症[2]。迄今为止,人们对中药“狗脊”和中草药“贯众”的许多基源植物进行了化学成分研究,但对狗脊化学成分的研究则较少[3],而活性研究方面,仅有狗脊提取液的抗菌抗病毒初步研究以及水煎剂对小白鼠的毒性试验[4],其他活性未见报道。为此,本文对其进行了化学成分研究并首次报道了其抑制乙酰胆碱酯酶活性。
1 材料与仪器
1.1 材料
狗脊(Woodwardia japonica)全草于2010 年7~8 月份采集于江西井冈山地区,在阴凉通风处晾干、粉碎。样品由井冈山大学生命科学学院周兵副教授鉴定。凭证标本(C.20100001)保存于井冈山大学生命科学学院标本室。
1.2 仪器与试剂
FAB-MS 测试采用VG-ZAB 型质谱仪,HR-FABMS 测试采用热电公司MAT95XP 型质谱仪,EI-MS测试和GC-MS 分析采用HP 5988A GC/MS 型质谱仪;NMR 测定采用Bruker AM-400 型超导核磁共振仪;吸光度测定采用日本Shimadzu 公司UV2550 紫外可见分光光度计。柱层析硅胶(200~300 目)及薄层层析(TLC)硅胶GF254(10~40 μm)为青岛海洋化工厂出品,用254 nm 紫外灯检测,辅以喷5%H2SO4-乙醇溶液后加热显色。乙酰胆碱酯酶、二硫二硝基苯甲酸(DTNB)、硫代乙酰胆碱、4%十二烷基硫酸钠和阳性对照tacrine 均为Sigma 公司产品,其余化学试剂均为分析纯。
2 实验方法
2.1 提取和分离
将粉碎的狗脊全草(1.5 kg)以95%乙醇浸泡提取3 次,每次3 d,将提取液合并后减压浓缩得浸膏(150 g)。浸膏溶于1 L 蒸馏水中,依次用石油醚和乙酸乙酯萃取3 次,分别得到石油醚萃取物(22 g)和乙酸乙酯萃取物(25 g)。石油醚萃取物经硅胶柱层析(石油醚-乙酸乙酯梯度洗脱)后得到共约5个组分,其中,组分2 经硅胶柱层析(石油醚-乙酸乙酯5∶1),得到化合物3(1 g)和4(35 mg),组分3 经硅胶柱层析(石油醚-丙酮5∶1),得到化合物5 (50 mg),乙酸乙酯部分经减压柱层析(石油醚-乙酸乙酯洗脱)后分为极性递增的4 个部分,组分2 拌样上硅胶柱用氯仿∶丙酮=5∶1 洗脱,得到化合物1(23 mg)和2(45 mg),组分3 拌样上硅胶柱,用氯仿∶丙酮=5∶2 洗脱,得到化合物6(30 mg)和7(27 mg)。
2.2 活性测试方法
实验采用改良的Ellman 方法[5]进行:将2.65 mL PBS(pH 8.0),50 μL AChE(0.85 U/mL,buffer pH 8),100 μL 15 mM DTNB 和样品溶液100 μL 加入试管,37 ℃预热2 min,然后加入100 μL 15 mM ATch,在37 ℃保温20 min 后立即加入1 mL 0.4%SDS 终止反应,将所得溶液立即在412 nm 下测量吸光值并根据下式计算抑制率。

这里A对照是指样品溶液为没有添加样品的50%乙醇溶液时的吸光值,A样品是指添加样品溶液的吸光值,而A样品空白则表示添加样品溶液但没有添加底物ATch 时的吸光值。所有实验重复三次并计算平均值和标准差,阳性对照为他克林。
3 结构鉴定
化合物1 白色固体,无荧光,在TLC 上5%浓硫酸-无水乙醇溶液加热显紫红色。红外谱图提示羟基信号(3382 cm-1)、酯羰基(1736 cm-1)信号和烯键信号(1645、1463 和888 cm-1),氢谱和碳谱提示含1 个β-谷甾醇信号,1 个葡萄糖信号和1 个长链脂肪酰基信号,推测该化合物为糖基上接有长链脂肪酰基的胡萝卜苷。其FAB-MS 提示分子量为868,并出现明显的甾醇碎片峰m/z 397,故长链脂肪酰基可推测为20 碳单烯酰基。由于糖基上6'-H 的化学位移向低场移动到δ 4.3-4.4,提示与化合物2相同,长链脂肪酰基取代在葡萄糖的6'位。样品甲醇解反应后经GC-MS 分析,长链脂肪酸被确定为二十碳-9Z-烯酸,故化合物最终被鉴定为3-O-[6'-O-(9Z-二十碳烯酰)-β-D-葡萄糖酰]-谷甾醇(结构见图1),化合物1 的结构迄今还未见报道,其波谱数据如下:[α]D20=-36 (c=2,氯仿);UV (氯仿):246 (2.065);IR (KBr):3382,2925,2852,1737,1645,1463,1376,1171,1117,888,721 cm-1;1H NMR(CDCl3,400 MHz)δ:5.35 (3H,m,H-6,H-8'',H-9''),4.38 (1H,m,H-6'a),4.30 (1H,dd,J,=12.0,1.8Hz,H-6' b),3.56 (1H,m,H-3'),3.54(1H,m,H-4'),3.47 (1H,m,H-3),3.38 (1H,m,H-2'),3.37 (1H,m,H-5'),2.32 (2H,t,J=6.6 Hz,H-2''),1.01 (3H,s,H-19),0.91 (3H,d,J=6.5 Hz,H-21),0.87 (3H,m,H-20''),0.84 (3H,s,H-26),0.82 (3H,s,H-27),0.80 (3H,t,J=6.3 Hz,H-29),0.65 (3H,s,H-18);13C NMR (CDCl3,100 MHz)δ:37.3 (C-1),31.9 (C-2),79.8 (C-3),38.9(C-4),140.4 (C-5),122.0 (C-6),31.9 (C-7),31.9 (C-8),50.1 (C-9),36.5 (C-10),21.1 (C-11),39.8 (C-12),42.3 (C-13),56.8 (C-14),24.3(C-15),28.2 (C-16),56.1 (C-17),11.8 (C-18),19.4 (C-19),36.1 (C-20),18.8 (C-21),33.9 (C-22),26.1 (C-23),45.8 (C-24),29.2 (C-25),19.8(C-26),19.0 (C-27),23.1 (C-28),12.0 (C-29),101.3 (C-1'),70.5 (C-2'),76.6 (C-3'),73.3 (C-4'),73.6 (C-5'),63.8 (C-6'),174.1 (C-1''),34.3(C-2''),31.5 (C-3''),29.1-29.8 (C-4''-C8''),130.0 (C-9''),128.0 (C-10''),29.1-29.8 (C-11''-C17''),25.0 (C-18''),22.7 (C-19''),14.1 (C-20'');FAB (positive)m/z:869 [M +H]+(8),397[M-acyl-glucosyl]+(13),253 (13),201 (20),161(39),145 (60),107 (100).HR-FAB-MS (positive)m/z:397.3805 ([M-acyl-glucosyl]+,calcd.for C29H49:397.3834)。
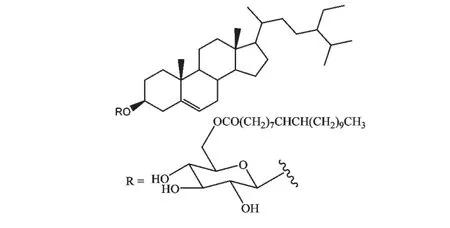
图1 化合物1 的化学结构Fig.1 Chemical structures of compounds 1
化合物2 白色固体,无荧光,mp.146~147℃,在TLC 上5%浓硫酸-无水乙醇溶液加热显紫红色。其EI-MS m/z:414[M-Glc+H]+(18),397(19),381(14),303(15),255(16),231(8),213(21);1H NMR (CDCl3,400 MHz)δ:5.35 (1H,s,H-6),4.37 (1H,m,H-6'a),4.30 (1H,dd,J,=12.0,1.8Hz,H-6' b),3.55 (1H,m,H-3'),3.54(1H,m,H-4'),3.47 (1H,m,H-3),3.38 (1H,m,H-2'),3.36 (1H,m,H-5'),2.32 (2H,t,J=6.6 Hz,H-2''),1.01 (3H,s,H-19),0.92 (3H,d,J=6.5 Hz,H-21),0.87 (3H,m,H-16''),0.84 (3H,s,H-26),0.82 (3H,s,H-27),0.80 (3H,t,J=6.3 Hz,H-29),0.65 (3H,s,H-18);13C NMR (CDCl3,100 MHz)δ:37.2(C-1),31.9 (C-2),79.7 (C-3),38.9(C-4),140.3 (C-5),122.0 (C-6),31.9 (C-7),31.9 (C-8),50.1 (C-9),36.4 (C-10),21.1 (C-11),39.7 (C-12),42.3 (C-13),56.8 (C-14),24.3(C-15),28.3 (C-16),56.1 (C-17),11.5 (C-18),19.4 (C-19),36.1 (C-20),18.8 (C-21),33.9 (C-22),26.1 (C-23),45.8 (C-24),29.2 (C-25),19.8(C-26),19.0 (C-27),23.1 (C-28),12.0 (C-29),101.4 (C-1'),70.6 (C-2'),76.6 (C-3'),73.3 (C-4'),73.8 (C-5'),63.8 (C-6'),174.2 (C-1''),34.3(C-2''),31.5 (C-3''),29.1-29.8 (C-4''-C13''),25.1(C-14''),22.8 (C-15''),14.2 (C-16''),上述波谱数据与文献报道数值基本一致[6],故鉴定为β-谷甾醇-3-O-α-L-(6'-O-正十六酰基)-葡萄糖苷。
化合物3 无色针状晶体,易溶于氯仿,mp.132~134 ℃,薄层喷硫酸-乙醇溶液加热显紫红色。该化合物经TLC 与β-谷甾醇的对照品对照,在3 种溶剂体系下其Rf值一致,故鉴定为β-谷甾醇。
化合物4 白色粉末,mp.275~278 ℃,EI-MS m/z :456[M]+,189(100),237(40),219(10),175(30),218(15),1H NMR (C5D5N)显示有6 个甲氧基δ:1.85 (3H,s,Me),1.71 (3H,s,Me),1.45(3H,s,Me),1.02 (3H,s,Me),0.92 (3H,s,Me),0.73(3H,s,Me),一个双键氢4.99(2H,s,H-30),13C NMR (C5D5N)δ:16.3 (C-Me),16.8 (C-Me),16.9(C-Me),19.1(C-Me),20.0(C-Me),25.2(Me-24)为六个甲基峰,与羟基相连的碳信号为66.7(C-3),双键信号为110.6(C-22)和148.7(C-30),羧基信号181.8(C-23)。上述波谱数据与文献报道数值基本一致[3],故鉴定为狗脊酸。
化合物5 白色结晶粉末(甲醇),mp.295~298 ℃,易溶于吡啶,Liebermann-Burchard 反应呈阳性,与胡萝卜苷已知对照品进行共薄层,显色过程相同,Rf值一致,故鉴定该化合物为胡萝卜苷。
化合物6 黄色结晶(甲醇),mp.215~217 ℃,EI-MS m/z:286 [kaempferol]+(100),285[kaempferol-H]+(25),258 [kaempferol-CO]+(10),257 [kaempferol-COH]+(12),153 [C7H4O4+H]+(6)。其1H NMR 和13C NMR 数据显示该化合物由山柰素和两个鼠李糖构成。1H NMR(C5D5N)δ:6.44(1H,d,J=2.0 Hz,H-6),6.69(1H,d,J=2.0 Hz,H-8),7.74(2H,d,J=9.5 Hz,H-2',6'),6.91(2H,d,J=9.5 Hz,H-3',5'),5.38(1H,d,J=1.5 Hz,H-1''),4.21(1H,dd,J=3.0,1.5 Hz,H-2''),3.70(1H,dd,J=9.5,3.5 Hz,H-3''),3.30(1H,t,J=9.5 Hz,H-4''),3.28(1H,m,H-5''),0.90(1H,d,J=6.0 Hz,H-6''),5.55(1H,d,J=1.5 Hz,H-1'''),4.00(1H,dd,J=3.0,1.5 Hz,H-2'''),3.8(1H,dd,J=9.5,3.5 Hz,H-3'''),3.45(1H,t,J=9.5 Hz,H-4'''),3.55(1H,m,H-5'''),1.25(1H,d,J=6.0 Hz,H-6''');13C NMR (C5D5N)δ:159.8(C-2),136.5(C-3),179.8(C-4),163.0(C-5),100.6(C-6),163.6(C-7),95.7(C-8),158.1(C-9),103.6(C-10),122.5(C-1'),132.0(C-2',6'),116.6(C-3',5'),161.7(C-4'),107.6(C-l”),71.3,71.7,71.9,72.1,72.1,72.2,73.3,73.7(rham -2''-5'',2'''-5'''),17.7(C-6''),99.9(C-l'''),18.1(C-6'''),上述波谱数据与文献报道数值基本一致[3],故鉴定为山柰素-3-O-α-L-鼠李糖基7-O-α-L-鼠李糖苷。
化合物7 黄色结晶(甲醇),mp.215~217 ℃,EI-MS m/z:286 [kaempferol]+(100),285[kaempferol-H]+(25),258 [kaempferol-CO]+(12),257 [kaempferol-COH]+(10),153 [C7H4O4+H]+(6);1H NMR 和13C NMR 数据显示该化合物由山柰素、两个鼠李糖和一个乙酰基构成。1H NMR(C5D5N)δ:6.44 (1H,d,J=2.0 Hz,H-6),6.68(1H,d,J=2.0 Hz,H-8),7.73 (2H,d,J=9.5 Hz,H-2',6'),6.92 (2H,d,J=9.5 Hz,H-3',5'),5.48 (1H,d,J=1.5 Hz,H-1''),4.21 (1H,dd,J=3.0,1.5 Hz,H-2''),3.82 (1H,dd,J=9.5,3.5 Hz,H-3''),4.55 (1H,t,J=9.5 Hz,H-4''),3.28(1H,m,H-5''),0.80 (1H,d,J=6.0 Hz,H-6''),5.55(1H,d,J=1.5 Hz,H-1'''),4.00 (1H,dd,J=3.0,1.5 Hz,H-2'''),3.65 (1H,dd,J=9.5,3.5 Hz,H-3'''),3.45 (1H,t,J=9.5 Hz,H-4'''),3.82 (1H,m,H-5'''),1.22 (1H,d,J=6.0 Hz,H-6'''),2.06 (3H,s,H-AC);13C NMR (C5D5N)δ:159.9(C-2),136.0(C-3),179.8(C-4),163.0(C-5),100.5(C-6),163.6(C-7),95.7(C-8),158.0(C-9),103.2 (C-10),122.5 (C-1'),132.0 (C-2',6'),116.6 (C-3',5'),161.8 (C-4'),107.6 (C-l”),71.4(C-2''),71.0 (C-3''),74.9 (C-4''),69.6 (C-5''),17.1 (C-6''),99.9 (C-l'''),71.5 (C-2'''),71.3(C-3'''),73.4 (C-4'''),72.1 (C-5'''),18.1 (C-6'''),21.0 (COCH3),172.5 (COCH3)。上述波谱数据与文献报道数值基本一致[3],故鉴定为山柰素-3-O-α-L-(4-O-乙酰基)-鼠李糖基7-O-α-L-鼠李糖苷。
4 结果与讨论
化合物狗脊酸,在浓度为0.1 mg/mL 时,其对乙酰胆碱酯酶活性的抑制率为70.5%,而其在浓度为0.25 mg/mL 时,其对乙酰胆碱酯酶活性的抑制率为87.5%,而化合物山柰素-3-O-α-L-鼠李糖基7-O-α-L-鼠李糖苷和山柰素-3-O-α-L-(4-O-乙酰基)-鼠李糖基7-O-α-L-鼠李糖苷的抑制率在浓度为0.1 mg/mL 时,其对乙酰胆碱酯酶活性的抑制率为61.2%和40.8%,而其在浓度为0.25 mg/mL 时,其对乙酰胆碱酯酶活性的抑制率为77.6%和51.4%。而其余的化合物在浓度为0.25 mg/mL 和0.5 mg/mL时,其对乙酰胆碱酯酶活性的抑制率均小于50%。
早老性痴呆症(又称阿尔茨海默氏病,Alzheimer's Disease,AD)是发生于老年和老年前期以进行性神经退化为特征的大脑退行性病变,是中枢神经系统变行性疾病,其主要临床表现为进行性认知功能减退并伴有行为障碍和情绪异常等,严重者直至失去生活自理能力[7,8]。目前的研究认为AD 是一种多病因疾病,胆碱能假说是目前最为被广泛接受的病理理论[9-11]。因此,乙酰胆碱酯酶抑制剂(Acetylcholinesterase Inhibitor,AChEI)药物是目前研究最多、最为活跃的抗早老性痴呆症药物[9-13]。然而,从植物中筛选并开发出的抗老年性痴呆症的药物并不多,系统的进行植物乙酰胆碱酯酶抑制活性研究的报道也很少[9],本实验对狗脊乙醇提取物进行了系统的化学研究,并对其化学成分进行了乙酰胆碱酯酶抑制活性研究,实验结果显示部分化合物具有一定的的抑制乙酰胆碱酯酶活性。
1 Wu ZH (吴兆洪).Flora of China(中国植物志).Beijing:Science Press,1999.203-206.
2 Zhang HY(张惠源),Zhang ZY(张志英),Yue JS(岳俊三),et al.Chinese herbal medicine resources (中国中药资源志要).Beijing:Science Press,1994.112.
3 Luan X(栾欣),Wang H(王皓),Wen YY(温远影).Studies on the chemical constituents of Woodwardia japonica.J Tropic Subtropic Botany (热带亚热带植物学报),2002,10:361-365
4 Ma BZ(马秉智),Gao ZP(高增平).Research progress of chemical constituents and pharmacological effects of Woodwardia genus.Drug Evaluation(药品评价),2004,1:383-384.
5 Perry NSL,Houghton PJ,Theolad A,et al.In vitro inhibition of human erythrocyte acetylcholinesterase by Salvia lavandulaefolia essential oil and constituent terpenes.J Pharm Pharmacol,2000,52:895-902.
6 Chaurasia N,Wichtl M.Sterols and steryl glycosides from Urtica dioica.J Nat Prod,1987,50:881-885.
7 Jann MW.Preclinical pharmacology of metriphonate.Pharmacotherapy,1998,18:55-67.
8 Aisen PS,Davis KL.The search for disease-modifying treatment for Alzheimer's Disease.Neurology,1997,48:35-41.
9 Ma XQ,Tan CH,Zhu DY,et al.A survey of potential huperzine A natural resources in China the Huperziaceae.J Ethnopharm,2006,104:54-67.
10 Paraoanu LE,Steinert G,Klaczinski J,et al.On functions of cholinesterases during embryonic development.J Mol Neurosci,2006,30:201-204.
11 Duysen EG,Lockridge O.Phenotype comparison of three acetylcholinesterase knockout strains.J Mol Neurosci,2006,30:91-92.
12 Silveyra MX,Garcia-Ayllon MS,Calero M,et al.Altered glycosylation of acetylcholinesterase in the creutzfeldt-jakob cerebrospinal fluid.J Mol Neurosci,2006,30:65-66.
13 Ma XQ,Gang DR.The Lycopodium alkaloids.Nat Prod Rep,2004,21:752-772.

