拟康氏木霉菌YIM PH30002 铁载体活性化学成分
陈金莲,刘 凯,苗翠萍,官会林,赵立兴*,孙世中*
1 云南师范大学能源与环境科学学院,昆明 650092;2云南大学省微生物研究所 教育部微生物多样性可持续利用重点实验室,昆明 650091
木霉菌属丝孢目(Moniliales)丛梗孢科(Moniliaceae)木霉属(Trichoderma)真菌,是典型的丝状真菌,具有较强环境适应能力,易于生长繁殖,在各种环境中有着广泛的分布与种群有优势,尤其在森林与农业土壤环境中极易分离得到[1]。木霉菌具有重寄生、分泌胞外酶降解病原真菌细胞壁、产生抑菌活性次生代谢产物等生物学特性,木霉菌作为生物防治菌剂在全球农业领域应用已取得瞩目的成效[2]。
微生物产生的具有铁离子螯合活性的次生代谢产物即铁载体(siderophores)对依赖铁离子的病原菌有显著抑制作用[3],铁载体通路已成为抑制病原菌的潜在新靶标。Vinale 等[4]人从哈茨木霉(Trichoderma harzianum)代谢产物中还发现了一个对马铃薯具有促生作用的新型铁载体化合物harzianic acid。自然环境中许多微生物具有产生铁载体成分的能力,其具体功能与作用已获得了阶段性的阐释[5],微生物铁载体活性成分的研究对药物研发与农业种植有着重要意义。
拟康氏木霉Trichoderma koningiopsis YIMPH 30002 分离自健康三七(Panax notoginseng)植物,通过双层琼脂平板法与发酵粗提物的铁载体活性检测,发现其在PDB 培养基中的代谢产物表现出对铁离子较强的螯合活性。从其发酵液的乙酸乙酯粗提物中分离得到5 个聚酮类化合物,经波谱解析分别鉴定为:konginginin A(1)、konginginin B(2)、konginginin D(3)、konginginin F(4)、konginginin M(5)。对单体化合物进行了抑菌与铁载体活性分析,化合物均无明显抑菌活性,但化合物2 的铁离子螯合活性相对较强。
1 仪器与材料
1.1 菌株来源
菌株YIM PH30002 分离于三七植物的茎部,综合其ITS 基因序列(GenBank 登录号:KM 190127)系统发育分析与形态学特征观察结果,确定为拟康氏木霉菌(Trichoderma koningiopsis YIM PH30002)。标本菌株保存于云南大学省微生物研究所菌种保藏库。
1.2 培养基
PDA 培养基(g/L):马铃薯200.0,葡萄糖15.0,琼脂12.0,蒸馏水,液体培养基(PDB)不加琼脂。改良马丁培养基(g/L):K2HPO41.0,MgSO4·7H2O 0.5,蔗糖10.0,蛋白胨5.0,酵母浸膏2.0,琼脂12.0,蒸馏水,液体培养基不加琼脂。察氏培养基(g/L):蔗糖30.0,NaNO32.0,K2HPO41.0,MgSO4·7H2O 0.5,KCl 0.5,琼脂12.0,蒸馏水,液体培养基不加琼脂。LB 培养基(g/L):胰蛋白胨10.0,酵母膏5.0,NaCl 10.0,蒸馏水,pH 7.2-7.4。
1.3 主要仪器与试剂
柱色谱硅胶(200~300 目)和GF254薄层色谱硅胶板均由青岛海洋化工有限责任公司生产;Sephadex LH-20 为瑞典GE Healthcare Bio-Sciences AB 公司生产;MCI gel(75~150 μm)为英国Hichrom 公司生产;分析型与半制备型HPLC 为安捷伦1200 Series,色谱柱为Phenomenex C18(250 mm×4.60 mm,5 μm)与YMC C18(250 mm×10 mm,5 μm)柱;核磁共振波谱由Bruker AV-400 和DRX-500 测定,TMS(四甲基硅烷)为内标;质谱分析由Agilent G3250AA spectrometer 质谱仪测定;显色方法为荧光灯下波长254 nm 和365 nm 处观察荧光,碘蒸气显色与硫酸茴香醛处理后加热显色;分析纯试剂石油醚,乙酸乙酯,丙酮,氯仿,甲醇由天津化学试剂有限公司生产;色谱纯甲醇由德国Merck 公司生产;铁载体活性检测试剂CAS 溶液:首先将60.5 mg 铬天青S(Chrome azurol S,CAS),溶解于50 mL 去离子水中,加入10 mL Fe3+溶液(1 mM FeCl3·6H2O,10 mM HCl)混匀后,记为“A 液”;其次称取72.9 mg 十六氨基烷基溴化铵(HTDMA)溶解于40 mL 去离子水中,加热充分溶解后,记为“B 液”;最后将A 液与B 液缓慢混合摇匀后得到CAS 检测溶液。
1.4 铁载体活性检测
菌株YIM PH30002 产铁载体固体平板检测参照文献[6,7],采用双层琼脂法,上层为培养基(分别为PDA、改良马丁、察氏3 种),下层为添加有4 %的CAS 溶液的水琼脂,用直径为5 mm 的打孔器从YIM PH30002 菌株平板内移取菌块接入双层平板中央,接种后放置28 ℃培养箱培养3 d,观察菌落周围特征晕圈颜色变化。菌株YIM PH30002 在以上3 种液体培养基的发酵液乙酸乙酯粗提物铁载体活性成分检测参照文献[8],将粗提物用甲醇溶解,粗提物的浓度检测范围设置为10~1000 μg/mL,按等体积比与CAS 溶液加入96 孔板内,反应总体系80 μL,以溴化十六烷基三甲铵(CTAB)作为阳性对照,甲醇作为阴性对照,每个处理设三个重复,并同时观察特征颜色变化,将能引起CAS 检测液出现特征颜色变化时的粗提物浓度记为最小检测浓度(Minimum test concentration,MTC)值。单体化合物铁载体活性的MTC 值测定同粗提物的检测方法与步骤一致。
1.5 发酵与提取分离
将菌株接种斜面活化培养5 d,接种于500 mL锥形瓶中(含有150 mL PDB 培养基)置摇床上130 rpm,28 ℃培养3 d;将种子培养液按8%~10%(v/v)接种量接于发酵培养基(PDB)中,置摇床上130 rpm,28 ℃培养10 d,共发酵50 L。发酵后用纱布过滤分离发酵液与菌丝体。用等体积的乙酸乙酯萃取发酵液三次,合并提取液,并真空浓缩蒸干,菌丝体使用过量丙酮浸泡并超声破壁15 min,用等体积的乙酸乙酯萃取丙酮提取物三次并浓缩蒸干。两部分萃取物经TLC 和HPLC 检测分析后合并得到总浸膏43.6 g。粗提物用等体积比的石油醚相与甲醇/水相(9∶1,v/v)溶解分离萃取3 次,甲醇/水相经真空浓缩蒸干后,经正向硅胶色谱,以氯仿/甲醇(1∶0、100∶1、50∶1、20∶1、10∶1、5∶1,v/v)梯度洗脱得到六个组分(Fr.1~6)。其中组分Fr.1 经Sephadex LH-20 柱色谱以甲醇洗脱,得到四个组分(Fr.1.1~1.4),其中Fr.1.2 进一步经Sephadex LH-20 柱色谱以甲醇洗脱得到化合物2,konginginin B(20.1 mg),Fr.1.2 剩余组分经硅胶柱色谱以石油醚/丙酮(10∶1-5∶1)梯度洗脱得到化合物1,konginginin A(18.1 mg),Fr.1.1 组分经Sephadex LH-20 柱色谱以甲醇洗脱后经硅胶柱色谱以石油醚/丙酮(10∶1~1∶1)梯度洗脱得到化合物5,konginginin M(14.3 mg)。组分Fr.2 经MCI 柱色谱以甲醇/水(10%~100%)梯度洗脱得到三个组分Fr.2.1~Fr.2.3,其中组分Fr.2.1 经半制备HPLC 以甲醇/水(10%~100%)作为流动相梯度洗脱,流速为3.0 mL/min,分别得到化合物3,konginginin D(7.5 mg)和4,konginginin F(8.6 mg)。
1.6 抑菌活性分析
单体化合物抗菌活性分析参照文献[9],采用微量稀释法于96 孔板分析单体化合物的最小抑菌浓度(MIC)值。化合物以二甲基亚砜(DMSO)溶解,采用二倍连续稀释法将化合物检测浓度范围设置为1~256 μg/mL,DMSO 在每个孔中的终浓度小于5%;以鲍曼不动杆菌(Acinetobacter baumanii)、金黄色葡萄球菌(Staphylococcus aureus)为病原指示细菌,用LB 培养基将细菌在37 ℃培养18 h 后使菌落数为1×105units/mL;以尖孢镰孢菌(Fusarium oxysporum)、人参链格孢(Alternaria panax)、腐皮镰孢菌(Fusarium solani)为病原指示真菌,用PDB 培养基将真菌在28 ℃培养24 h 后使菌落数为1×103units/mL;卡那霉素与制霉菌素分别作为抗细菌与真菌的阳性对照,DMSO 作为阴性对照;每个处理设三个重复,最后将接有细菌的板放置37 ℃培养24 h,接有真菌的96 孔板置28 ℃培养36 h 后,置显微镜下观察记录,最终将观察到孔中无菌体生长时所在化合物浓度定为该化合物的最小抑制浓度。
2 结果与讨论
2.1 铁载体活性
采用由真菌常用的培养基与通用CAS 检测平板构成的双层平板,拟康氏木霉菌YIM PH30002 能在上层的3 种不同培养基上生长良好,且在下层的CAS 检测平板上能够形成典型的铁载体螯合晕圈。从表1 结果可看出菌株YIM PH30002 在上层为PDA 培养基时所产生的铁载体特征晕圈大于在察氏与改良马丁培养基所形成的晕圈,且菌株在察氏培养基中产铁载体能力相对最弱;对菌株YIM PH30002 产铁载体形成的特征型螯合晕圈进行半定量分析,结果见表1,由于菌株在PDA 培养基生长速度最快,相应的铁载体螯合晕圈较大,因此,在铁载体螯合晕圈与菌落的直径比值上最大,由此可知,菌株YIM PH30002 在PDA 培养基上生长时,产铁载体能力最强。菌株YIM PH30002 在3 种不同培养基液体发酵的萃取粗提物铁载体检测分析结果见表2,由于CTAB 是最常用的金属离子螯合剂,所以将其作为阳性对照,CTAB 引起CAS 检测液出现特征颜色变化的 MTC 值为10 μg/mL;菌株 YIM PH30002 在察氏与改良马丁培养基发酵液中萃取的粗提物引起CAS 检测液出现特征颜色变化的MTC值分别为150 μg/mL 和100 μg/mL,而PDB 培养基发酵液萃取粗提物的MTC 值为50 μg/mL,与平板法检测结果一致,因此MTC 值可以作为微生物产铁载体能力的定量分析。化合物1~5 对铁离子螯合活性的MTC 值分析结果见表2,结果表明,化合物5在浓度即使大于1000 μg/mL 时也未能引起CAS 检测液出现特征颜色变化,即无铁载体活性,化合物2的铁载体活性相对化合物1、3 和4 较强,其MTC 值为300 μg/mL。
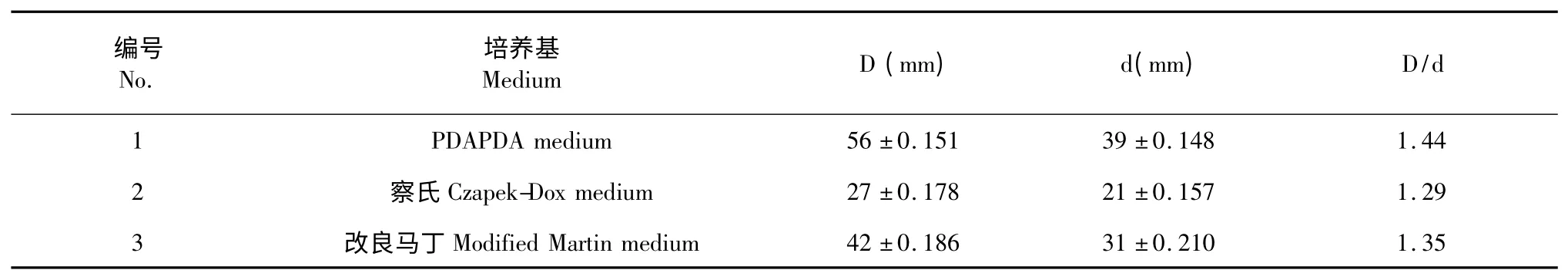
表1 YIM PH30002 在3 种培养基产铁载体比较Table 1 Comparison of siderophores produced by strain YIM PH30002 in three medium

表2 YIM PH30002 不同发酵液的粗提物与化合物1~5 的铁载体活性Table 2 The siderophores activities of the crude extracts and compounds 1-5
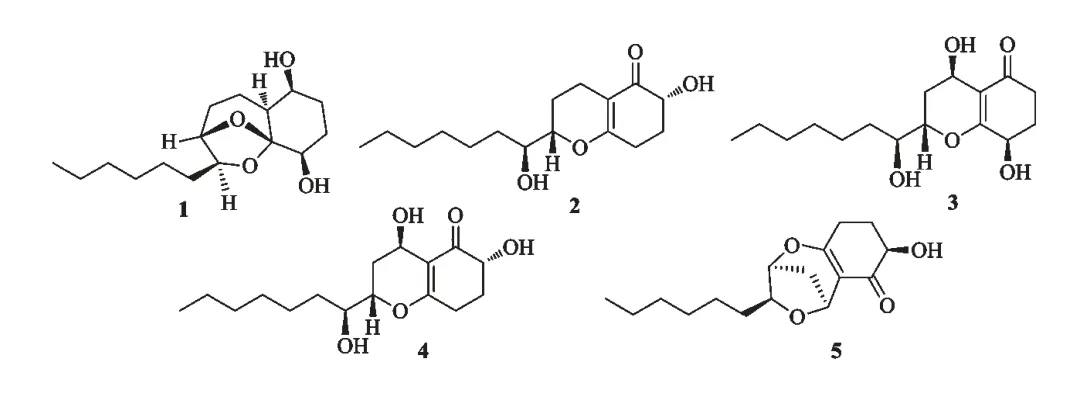
图1 化合物1~5 的化学结构Fig.1 Chemical structures of compounds 1-5
2.2 结构鉴定
化合物(1)Koninginin A,无色油状,C16H28O4;HR-ESI-MS m/z:307.1913[M+Na]+;1H NMR(400 MHz,CDCl3)δ:4.32(1H,s,H-9),4.03(1H,m,H-10),3.89(1H,dd,J=11.2,2.4Hz,H-1),3.62(1H,m,H-4),2.25(1H,m,H-8a),1.58(1H,m,H-8b),1.97(1H,m,H-3a),1.82(1H,m,H-3b),1.88(1H,m,H-2a),1.52(1H,m,H-2b),1.72(1H,m,H-7a),1.61(1H,m,H-7b),1.60(1H,m,H-6),1.57(2H,m,H-11),1.30(2H,m,H-14),1.28(2H,m,H-13),1.28(2H,m,H-15),1.27(2H,m,H-12),0.88(3H,t,J=6.0Hz,H-16);13C NMR(100 MHz,CDCl3)δ:109.2(C-5),79.4(C-10),79.1(C-9),72.7(C-4),69.9(C-1),41.4(C-6),35.2(C-11),31.7(C-14),30.8(C-2),29.1(C-13),27.3(C-8),25.6(C-3),25.2(C-12),22.5(C-15),20.6(C-7),14.0(C-16)。以上波谱数据与文献[10]报道一致。确定该化合物为koninginin A。
化合物(2)Koninginin B,无色油状,C16H26O4;HR-ESI-MS m/z:305.1773[M+Na]+;1H NMR(400 MHz,CDCl3)δ:4.04(1H,dd,J=13.2,5.2 Hz,H-2),3.87(1H,s,2-OH),3.78(1H,m,H-9),3.64(1H,br s,10-OH),3.77(1H,m,H-10),2.56(1H,m,H-4a),2.08(1H,m,H-4b),2.35(1H,m,H-3a),1.80(1H,m,H-3b),1.95(1H,m,H-7a),1.66(1H,m,H-7b),1.65(1H,m,H-8a),1.55(1H,m,H-8b),1.35(2H,m,H-12),1.33(2H,m,H-11),1.30(1H,m,H-13),1.31(2H,m,H-14),1.29(2H,m,H-15),0.87(3H,t,J=7.2Hz,H-16);13C NMR(100 MHz,CDCl3)δ:198.5(C-1),171.8(C-5),109.5(C-6),81.2(C-9),73.5(C-10),71.4(C-2),33.2(C-4),32.2(C-11),29.7(C-14),29.4(C-13),27.6(C-3),25.8(C-8),23.1(C-12),23.0(C-15),18.1(C-7),14.5(C-16)。以上波谱数据与文献[11]报道一致。确定该化合物为koninginin B。
化合物(3)Koninginin D,无色油状,C16H26O5;HR-ESI-MS m/z:321.1792[M+Na]+;1H NMR(400 MHz,CDCl3)δ:4.66(1H,br s,H-7),4.45(1H,m,H-4),4.10(1H,m,H-9),3.72(1H,m,H-10),2.64(1H,m,H-2a),2.37(1H,m,H-2b),2.23(1H,m,H-3a),2.01(1H,m,H-3b),1.97(1H,m,H-8a),1.77(1H,m,H-8b),1.60(2H,m,H-12),1.58(1H,m,H-11a),1.48(1H,m,H-11b),1.31(2H,m,H-13),1.30(2H,m,H-14),1.30(2H,m,H-15),0.89(3H,t,J=7.2Hz,H-16);13C NMR(100 MHz,CDCl3)δ:198.5(C-1),171.1(C-5),114.2(C-6),77.4(C-9),73.1(C-10),65.7(C-4),57.3(C-7),33.1(C-2),32.8(C-11),31.7(C-14),30.9(C-13),29.2(C-8),28.8(C-3),25.2(C-12),22.6(C-15),14.0(C-16)。以上波谱数据与文献[11]报道一致。确定该化合物为koninginin D。
化合物(4)Koninginin F,无色油状,C16H26O5;HR-ESI-MS m/z:321.1797[M+Na]+;1H NMR(400 MHz,CDCl3)δ:4.80(1H,br s,H-7),4.08(1H,m,H-9),4.06(1H,m,H-2),3.69(1H,s,H-10),2.62(1H,m,H-4a),2.37(1H,m,H-4b),2.35(1H,m,H-3a),1.98(1H,m,H-3b),1.97(1H,m,H-8a),1.80(1H,m,H-8b),1.62(2H,m,H-11),1.51(2H,m,H-12),1.31(2H,m,H-13),1.30(2H,m,H-14),1.29(2H,m,H-15),0.88(3H,t,J=7.0Hz,H-16);13C NMR(125 MHz,CDCl3)δ:198.3(C-1),173.5(C-5),112.6(C-6),77.3(C-9),72.8(C-10),71.0(C-2),57.2(C-7),33.1(C-4),31.7(C-11),31.4(C-14),29.2(C-13),28.6(C-8),27.1(C-3),25.4(C-12),22.6(C-15),14.0(C-16)。以上波谱数据与文献[12]报道一致。确定该化合物为koninginin F。
化合物(5)Koninginin M,无色油状,C16H24O4;HR-ESI-MS m/z:303.1620[M+Na]+;1H NMR(400 MHz,CDCl3)δ:4.99(1H,d,J=5.6 Hz,H-7),4.83(1H,br s,H-9),4.05(1H,m,H-10),3.94(1H,dd,J=7.9,5.2 Hz,H-2),3.81(1H,br s,2-OH),2.53(2H,m,H-4),2.35(1H,m,H-3a),1.83(1H,m,H-3b),1.64(1H,m,H-11a),1.48(1H,m,H-11b),1.30(2H,m,H-12),1.30(2H,m,H-13),1.28(2H,m,H-14),1.28(2H,m,H-15),0.88(3H,t,J=7.2Hz H-16);13C NMR(125 MHz,CDCl3)δ:194.8(C-1),173.8(C-5),116.1(C-6),85.9(C-10),79.5(C-9),70.9(C-2),66.2(C-7),32.5(C-8),31.7(C-11),31.6(C-14),29.2(C-13),29.0(C-3),26.4(C-4),26.3(C-12),22.5(C-15),14.1(C-16)。以上波谱数据与文献[13]报道一致,确定该化合物为koninginin M。
2.3 抑菌活性
抑菌活性分析结果(表3)表明,化合物1~5 对检测的病原指示真菌无显著的抑菌活性,MIC 值范围为128~256 μg/mL,而对病原指示细菌无抑菌活性,其MIC 值均大于256 μg/mL。
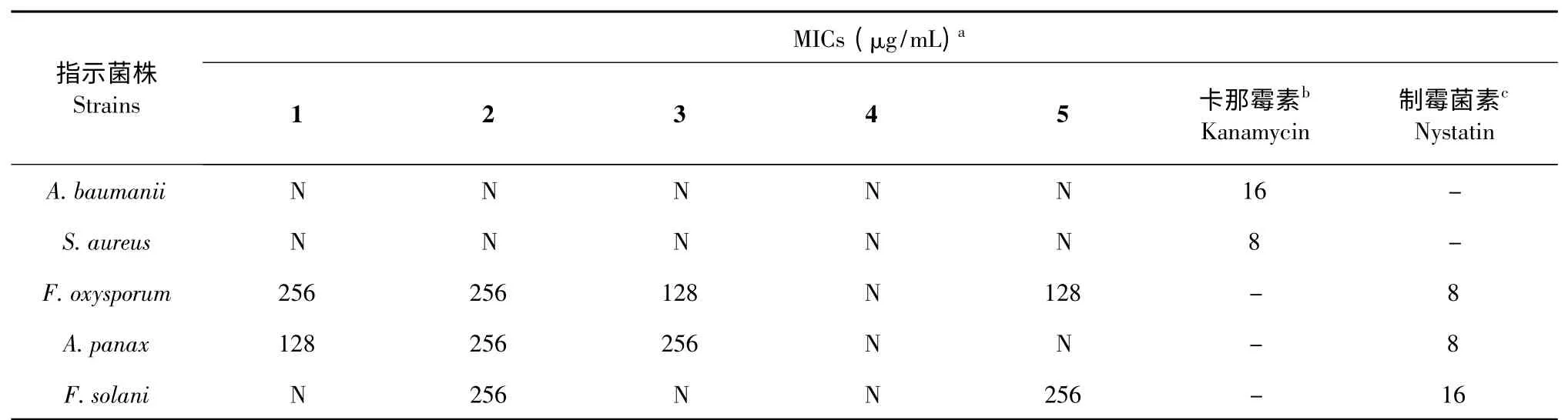
表3 化合物(1~5)对微生物的最小抑制浓度(MICs)Table 3 Minimal inhibitory concentration of compounds(1-5)against tested microorganisms
2.4 讨论
铁元素是大部分微生物生长的必须元素,真菌、细菌能通过自身代谢产生对环境中铁离子具有螯合活性的化合物[5],CAS 平板法已被广泛用于微生物产铁载体潜能检测[14]。铁离子、CAS 和HTDMA 会络合形成蓝色复合物(FeDye3-x)其具体显色原理可用化学式:FeDye3-x+Ly-→FeL3-y+Dyex-表示,当对Fe3+具有更高亲和力的配体(L)出现,如将铁载体加入FeDye3-x 蓝色复合物中,复合物中的铁离子便会转移到配体上,而释放出染料,此时溶液的颜色由蓝色变为黄色、紫色或橙色。因此用双层琼脂平板法可在平板上观察到典型铁载体颜色晕圈,微生物代谢提取物与CAS 溶液的理化反应同样可通过特征颜色变化来判断化合物铁离子螯合强度。本文研究发现菌株YIM PH30002 在三种不同培养基中产铁载体能力存在差异,其在PDA 培养基上特征颜色晕圈最大。铁载体特征螯合晕圈与菌落直径比值作为产铁载体能力的一种半定量分析方法[15],与菌株YIM PH30002 在三种不同液体培养基发酵液的提取物与CAS 检测液的理化反应的定量分析方法结果一致。微生物所产铁载体是一类较特殊的天然产物,近年来围绕微生物所产铁载体的功能与机制等方面引发了广泛讨论:研究发现阻断结核杆菌铁载体循环通路可诱发自毒效应,即内源铁载体物质积累导致结合杆菌死亡,这为结核病药物的研发提供了新的靶标[16];研究还表明微生物产生铁载体可促进植物生长[17],抑制病原菌等作用[18]。本文首次报道三七内生真菌拟康氏木霉菌YIM PH30002具有产铁载体的能力,并发现了部分化合物具有一定的铁载体活性,但未能发现具有极强铁离子螯合活性的单体,这与粗提物显示的螯合活性存在差异,可能与化合物间的协同作用有一定关联,有关菌株YIM PH30002 分泌的铁载体代谢产物对铁离子的协同螯合作用机制值得进一步深入研究。
1 Samuels GJ.Trichoderma:a review of biology and systematics of the genus.Mycol Res,1996,8:923-935.
2 Keswani C,Mishra S,Sarma BK,et al.Unraveling the efficient applications of secondary metabolites of various Trichoderma spp.Appl Microbiol Biot,2014,98:533-544.
3 Haas H.Molecular genetics of fungal siderophore biosynthesis and uptake:the role of siderophores in iron uptake and storage.Appl Microbiol Biot,2003,62:316-330.
4 Vinale F,Nigro M,Sivasithamparam K,et al.Harzianic acid:a novel siderophore from Trichoderma harzianum.FEMS Microbiol Lett,2013,347:123-129.
5 Hider RC,Kong XL.Chemistry and biology of siderophores.Nat Prod Rep,2010,27:637-657.
6 Miranda SP,Cabirol N,Téllez RG,et al.O-CAS,a fast and universal method for siderophore detection.J Microbiol Meth,2007,70:127-131.
7 Milagres AM,Machuca A,Napoleao D.Detection of siderophores production from several fungi and bacteria by a modification of chromeazurol S(CAS)agar plate assay.J Microbiol Meth,1999,37:1-6.
8 Schwyn B,Neilands JB.Universal chemical assay for the detection and determination of siderophores.Anal Biochem,1987,160:46-56.
9 Tian SZ,Pu X,Luo GY,et al.Isolation and characterization of new p-terphenyls with antifungal,antibacterial,and antioxidant activities from halophilic antinomycete Nocardiopsis gilva YIM 90087.J Agric Food Chem,2013,61:3006-3012.
10 Xu XX,Zhu YH.Total synthesis of koninginin A and its diastereoisomer.Tetrahedron Lett,1995,36:9173-9176.
11 Liu G,Wang Z.Total synthesis of koninginin D,B and E.Synthesis,2001,1:119-127.
12 Ghisalberti EL,Rowland CY.Antifungal metabolites from Trichoderma harzianum.J Nat Prod,1993,56:1799-1804.
13 Lang BY,Li J,Zhou XX,et al.Koninginins L and M,two polyketides from Trichoderma koningii 8662.Phytochem Lett,2015,11:1-4.
14 Shin SH,Lim Y,Lee SE,et al.CAS agar diffusion assay for the measurement of siderophores in biological fluids.J Microbiol Meth,2001,44:89-95.
15 Chen SX(陈绍兴),Zhao X(赵翔),Xie ZX(谢志雄).Detection of siderophore from Halophilic archaea with two-layer plate.Microbiol China(微生物学通报),2008,35:142-144.
16 Jones CM,Wells RM,Madduri AVR,et al.Self-poisoning of Mycobacterium tuberculosis by interrupting siderophore recycling.Proc Natl Acad Sci USA,2014,111:1945-1950.
17 Sadeghi A,Karimi E,Dahaji PA,et al.Plant growth promoting activity of an auxin and siderophore producing isolate of Streptomyces under saline soil conditions.World J Microb Biot,2012,28:1503-1509.
18 Miethka M,Marahiel MA.Siderophore-based iron acquisitionand pathogen control.Microbiol Mol Biol Res,2007,71:413-451.

