PI3K/Akt/GSK-3β 信号通路在6-姜酚保护PC12 细胞对抗β 淀粉样蛋白诱导细胞凋亡的作用
曾高峰,宗少晖,傅松文,农梦妮,李柯柯,严芳娜
1 广西医科大学公共卫生学院;2 广西医科大学第一附属医院脊柱骨病外科;3广西医科大学研究生学院,南宁 530021
已有的研究表明,阿尔茨海默病发病过程中的神经退行性改变与β 淀粉样蛋白的过量分泌密切相关[1]。体内实验显示,大鼠脑室内注射入Aβ 后,表现出认知功能、记忆功能降低等AD 样症状及神经元细胞凋亡等[2]。因而,抑制Aβ 诱导的神经元变性可能对AD 的防治具有重要作用。此外,大量的研究显示Aβ 引起的神经毒性作用与PI3K/Akt/GSK-3β 信号通路密切相关[3,4]。故逆转Aβ 通过PI3K/Akt/GSK-3β 信号通路导致的细胞毒性,可能成为防治AD 的途径之一。研究显示,6-姜酚可减轻Aβ 诱导的SH-SY5Y 细胞凋亡,因而可能具有神经保护作用[5]。然而,6-姜酚对AD 的防治作用尚未清楚,本研究旨在观察6-姜酚在Aβ1-42导致的PC12 细胞凋亡中的作用及其分子信号通路基础。
1 材料与方法
1.1 试剂
β 淀粉样蛋白(1-42)(武汉明皓生物科技股份有限公司),6-姜酚(上海抚生实业有限公司),F12K培养基(武汉博士德),神经生长因子(NGF,美国Millipore 公司),马血清(美国Gibco 公司),胎牛血清(美国Gibco 公司),噻唑兰(MTT,Amresco 公司),Akt、p-Akt(Ser473)、GSK-3β 及 p-GSK-3β(Ser9)抗体均购自于美国CST 公司,未分化PC12细胞购自中国科学院上海细胞库。
1.2 PC12 细胞的培养
PC12 细胞接种于含10% 马血清、5% 胎牛血清、100 U/mL 青霉素和100 μg/mL 链霉素的F12K培养基中,并置于37 ℃培养箱中培养,每2~3 d 换液一次。
1.3 MTT 法检测PC12 细胞的存活率
PC12 细胞接种于96 孔板,经NGF 诱导分化5 d 后,分别加入5、10 及20 μM Aβ1-42作用24、48 及72 h,MTT 实验分别检测不同浓度Aβ1-42对PC12 细胞作用24、48 及72 h 的细胞存活率;PC12 细胞中分别加入40、80、120、200 及300 μM 的6-姜酚作用4 h 后,加入10 μM Aβ1-42继续培养48 h,MTT 实验检测细胞存活率,以观察6-姜酚对Aβ1-42所致的PC12 细胞凋亡的影响。具体步骤为,药物作用结束后,每孔加入10 μL 5 mg/mL MTT 并置于37 ℃培养箱中孵育4 h,然后弃去反应后的上清液,加入150 μL DMSO 后置于振荡器上振荡10 min,紫色结晶完全溶解后,酶标仪570 nm 波长测吸光度。
1.4 Western blot 分析
药物作用结束后,离心收集PC12 细胞,以PBS漂洗2 遍后,加入RIPA 裂解液并置于冰上以将细胞充分裂解,离心收集上清液,采用BCA 法定量蛋白浓度。蛋白经变性后,以8% SDS-PAGE 进行电泳,蛋白经电泳分离后,采用湿转法将蛋白转移至硝酸纤维膜上。在室温下,以5% BSA 封闭1 h 后,分别加入GSK-3β、p-GSK-3β(Ser9)、Akt 及p-Akt 抗体并置于4 ℃,缓慢平摇孵育过夜。以TBST 进行漂洗4 遍后,加入辣根过氧化酶标记的二抗并于室温下,缓慢平摇孵育1.5 h,再以TBST 进行漂洗4 遍,在暗房中以ECL 发光显色剂对蛋白进行显色,并采用Image J 软件对蛋白条带进行定量分析。
1.5 统计学方法
2 实验结果
2.1 Aβ1-42对PC12 细胞存活率的影响
由图1 可见,分别以5、10 及20 μM 浓度的Aβ1-42 对分化的PC12 细胞进行处理24、48 h 及72 h,各时间组的细胞存活率,随着Aβ1-42浓度的增加而下降,且10、20 μM 组细胞存活率显著下降(P<0.05);Aβ1-42处理组细胞存活率随着作用时间延长而下降,与作用24 h 相比,48、72 h 各浓度组细胞存活率均显著降低(P<0.05)。
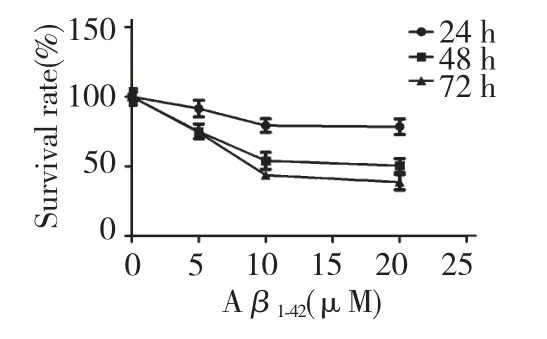
图1 Aβ1-42对PC12 细胞存活率的影响Fig.1 The effect of Aβ1-42on PC12 cell viability
2.2 6-姜酚对Aβ1-42致PC12 细胞凋亡的抑制作用
如表1 所示,与对照组相比,10 μM Aβ1-42对PC12 细胞进行作用48 h 后的细胞存活率显著下降,而以80、120 及200 μM 的6-姜酚对PC12 细胞进行预处理4 h 后再加入Aβ1-42(10 μM)继续培养48 h 的细胞存活率则较Aβ1-42处理组显著上升(如表2 所示)。表明6-姜酚在80、120、200 μM 时均能显著减少Aβ1-42引起的细胞凋亡,并且120 μM 的6-姜酚作用最明显;但当浓度达300 μM 时,则可加重细胞凋亡。
表1 6-姜酚对Aβ1-42致PC12 细胞凋亡的抑制作用(±S)Table 1 The inhibitory effect of 6-gingerol on Aβ1-42-induced apoptosis in PC12 cells(±S)

表1 6-姜酚对Aβ1-42致PC12 细胞凋亡的抑制作用(±S)Table 1 The inhibitory effect of 6-gingerol on Aβ1-42-induced apoptosis in PC12 cells(±S)
注:与对照组比较,* P<0.05,与Aβ1-42处理组比较,▲P<0.05。Note:Compared with the control group,* P<0.05;Compared with the Aβ1-42treatment group,▲P<0.05.
2.3 6-姜酚对Aβ1-42诱导的GSK-3β、Akt 磷酸化水平的影响
为了观察PI3K/Akt/GSK-3β 信号通路在6-姜酚保护PC12 细胞对抗Aβ1-42引起的细胞毒性的作用,以80、120 及200 μM 6-姜酚对PC12 细胞进行预处理4 h 后,再加入Aβ1-42(10 μM)继续培养48 h,采用蛋白免疫印迹法检测PC12 细胞中GSK-3β、p-GSK-3β、Akt 及p-Akt 的表达水平。结果显示(图2、图3):10 μM Aβ1-42处理组中PC12 细胞的GSK-3β磷酸化水平较对照组显著降低,而80 及120 μM 的6-姜酚预处理组中GSK-3β 的磷酸化水平则显著高于Aβ1-42处理组的;以10 μM Aβ1-42对PC12 细胞进行作用48 h 后的Akt 磷酸化水平较对照组显著降低,而以80 及120 μM 的6-姜酚对PC12 细胞进行预处理4 h 后再加入Aβ1-42(10 μM)继续培养48 h 的PC12 细胞的Akt 磷酸化水平则显著高于Aβ1-42处理组的。
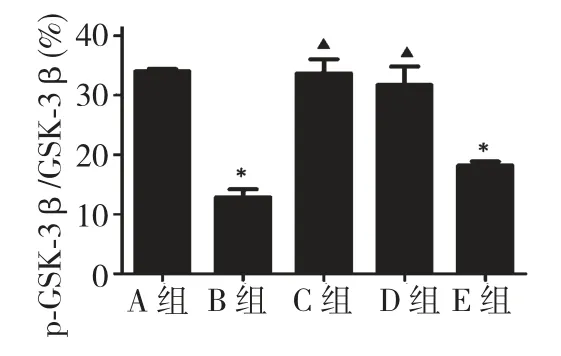
图2 6-姜酚对Aβ1-42诱导的GSK-3β 磷酸化水平的影响Fig.2 Effect of 6-gingerol on Aβ1-42-induced activation of GSK-3β

图3 6-姜酚对Aβ1-42诱导的Akt 磷酸化水平的影响Fig.3 Effect of 6-gingerol on Aβ1-42-induced activation of Akt
3 讨论与结论
体内研究表明,Aβ1-42可致大鼠神经发生退行性改变[6]。本研究结果显示,PC12 细胞的存活率随着Aβ1-42浓度的增加及作用时间的延长而下降,且10及20 μM Aβ1-42组在作用24、48 及72 h 后的细胞存活率均较对照组显著下降(P<0.05);与作用24 h相比,48 h 及72 h 各浓度组细胞存活率均显著降低。因而Aβ1-42可诱导PC12 细胞发生凋亡,导致细胞存活率下降,这与以往的研究结果一致[7,8]。而6-姜酚在80、120、200 μM 时均能显著减少Aβ1-42引起的细胞凋亡,并且在120 μM 时抑制效果最明显;但当浓度达300 μM 时,则可加重细胞凋亡。结果表明,6-姜酚在80~200 μM 的浓度范围内,通过对Aβ1-42所致细胞凋亡的抑制作用,表明6-姜酚对Aβ1-42所致的细胞凋亡具有保护作用,但高浓度的6-姜酚(300 μM)则具有毒性作用[9,10]。
AD 的发生与GSK-3β 密切相关。研究表明,tau蛋白的异常磷酸化通过神经毒性作用介导神经退行性疾病的发生,如AD[11,12],而GSK-3β 的活化可引起tau 蛋白的磷酸化水平异常增高[13]。此外,GSK-3β 的活化可导致细胞凋亡及酶的失活[14],而GSK-3β 的磷酸化水平增高可抑制GSK-3β 的活性[15]。本研究发现,PC12 细胞经Aβ1-42作用48 h 后,GSK-3β 的磷酸化水平较正常组显著降低,表明Aβ1-42可激活GSK-3β 的活性。以80 及120 μM 的6-姜酚对PC12 细胞进行预处理4 h 后再加入Aβ1-42(10 μM)继续培养48 h 的PC12 细胞的GSK-3β 磷酸化水平则显著高于Aβ1-42处理组的,这表明6-姜酚可抑制由Aβ1-42激活的GSK-3β 活性。因而,6-姜酚对Aβ1-42诱导细胞凋亡的保护作用可能与其抑制GSK-3β 的活性有关。
通过PI3K 通道,Akt 在Ser473 位点发生磷酸化,介导了Akt 的激活[16],从而具有神经保护作用[17]。研究表明,抑制PI3K/Akt 通道可显著增加GSK-3β 的活性,导致tau 蛋白过度磷酸化[18],从而与AD 的发生密切相关。而Akt 的激活,可以抑制GSK-3β 的活性[19]。本研究结果显示,Aβ1-42处理组中PC12 细胞的Akt 磷酸化水平较对照组显著降低,而80 及120 μM 6-姜酚预处理组中Akt 的磷酸化水平则显著高于Aβ1-42处理组的,表明Aβ1-42可抑制PC12 细胞的Akt 活性,而6-姜酚可显著抑制Aβ1-42导致的Akt 活性的下降。因而6-姜酚对Aβ1-42诱导细胞凋亡的保护作用可能与其激活Akt 的活性有关。
总之,本研究表明,6-姜酚可能通过PI3K/Akt/GSK-3β 信号通路保护PC12 细胞对抗Aβ1-42诱导的细胞凋亡。
1 Hardy J,Selkoe DJ.The amyloid hypothesis of Alzheimer's disease:progress and problems on the road to therapeutics.Science,2002,297:353-356.
2 Jan F(剑非),Chen H(陈红),Ren CS(任常山),et al.β-淀粉蛋白脑室内注射建立阿尔茨海默病大鼠模型.Chin J Nerv Ment Dis(中国神经精神疾病杂志),2005,2:145-147.
3 Ryder J,Su Y,Ni B.Akt/GSK3beta serine/threonine kinases:evidence for a signaling pathway mediated by familial Alzheimer's disease mutations.Cell Signal,2004,16:187-200.
4 Xian YF,Lin ZX,Mao QQ,et al.Isorhynchophylline protects PC12 cells against Beta-amyloid-induced apoptosis via PI3K/Akt signaling pathway.Evid Based Complement Alternat Med,2013,2013:163057.
5 Lee C,Park GH,Kim CY,et al.[6]-Gingerol attenuates beta-amyloid-induced oxidative cell death via fortifying cellular antioxidant defense system.Food Chem Toxicol,2011,49:1261-1269.
6 Shen WX,Chen JH,Lu JH,et al.TGF-beta1 Protection against Abeta1-42-Induced neuroinflammation and neurodegeneration in rats.Int J Mol Sci,2014,15:22092-22108.
7 Wan WB,Cao L,Liu LM,et al.EGb761 provides a protective effect against abeta1-42 oligomer-induced cell damage and blood-brain barrier disruption in an in vitro bEnd.3 endothelial model.PLoS One,2014,9:e113126.
8 Zhu Y,Sun X,Gong T,et al.Antioxidant and antiapoptotic effects of 1,1'-(biphenyl-4,4'-diyl)-bis(3-(dimethylamino)-propan-1-one)on protecting PC12 cells from Abeta-induced injury.Mol Pharm,2014,11:428-435.
9 Park KK,Chun KS,Lee JM,et al.Inhibitory effects of[6]-gingerol,a major pungent principle of ginger,on phorbol ester-induced inflammation,epidermal ornithine decarboxylase activity and skin tumor promotion in ICR mice.Cancer Lett,1998,129:139-144.
10 Surh YJ.Anti-tumor promoting potential of selected spice ingredients with antioxidative and anti-inflammatory activities:a short review.Food Chem Toxicol,2002,40:1091-1097.
11 Nisbet RM,Polanco JC,Ittner LM,et al.Tau aggregation and its interplay with amyloid-β.Acta Neuropathol,2014,129:207-220.
12 Steinhilb ML,Dias-Santagata D,Fulga TA,et al.Tau phosphorylation sites work in concert to promote neurotoxicity in vivo.Mol Biol Cell,2007,18:5060-5068.
13 Medina M,Avila J.New insights into the role of glycogen synthase kinase-3 in Alzheimer's disease.Expert Opin Ther Targets,2014,18:69-77.
14 Kaytor MD,Orr HT.The GSK3 beta signaling cascade and neurodegenerative disease.Curr Opin Neurobiol,2002,12:275-278.
15 Pap M,Cooper GM.Role of glycogen synthase kinase-3 in the phosphatidylinositol 3-Kinase/Akt cell survival pathway.J Biol Chem,1998,273:19929-19932.
16 Tato I,Bartrons R,Ventura F,et al.Amino acids activate mammalian target of rapamycin complex 2(mTORC2)via PI3K/Akt signaling.J Biol Chem,2011,286:6128-6142.
17 Griffin RJ,Moloney A,Kelliher M,et al.Activation of Akt/PKB,increased phosphorylation of Akt substrates and loss and altered distribution of Akt and PTEN are features of Alzheimer's disease pathology.J Neurochem,2005,93:105-117.
18 Baki L,Shioi J,Wen P,et al.PS1 activates PI3K thus inhibiting GSK-3 activity and tau overphosphorylation:effects of FAD mutations.EMBO J,2004,23:2586-2596.
19 Beaulieu JM,Gainetdinov RR,Caron MG.Akt/GSK3 signa-ling in the action of psychotropic drugs.Annu Rev Pharmacol Toxicol,2009,49:327-347.

